ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
Когда около 25 лет тому назад я впервые приступил к изучению действия гормонов, среди биологов было широко распространено убеждение, что действие гормонов бессмысленно изучать вне организованной клеточной структуры. Однако поразмыслив об истории биохимии, мне вполне реальной показалась возможность того, что гормоны могут действовать на молекулярном уровне.
Эрл Уилбур Сазерленд, Нобелевская лекция, 1971
12. БИОСИГНАЛИЗАЦИЯ
Способность клеток получать сигналы из пространства, находящегося за пределами плазматической мембраны, и отвечать на них является основополагающей для жизни. Бактериальные клетки получают постоянный входной сигнал от мембранных белков, работающих как рецепторы информации об окружающей среде, определяя там pH. осмотическую силу, наличие пищи, кислорода и света, а также присутствие отравляющих химических веществ, организмов-хищников или конкурентов в добыче пищи. Эти сигналы вызывают соответствующие ответы, такие как движение в направлении пищи или прочь от токсических веществ или образование покоящихся спор в лишенной питания среде. В многоклеточных организмах клетки, выполняющие разные функции, обмениваются множеством сигналов. Клетки растений отвечают на ростовые гормоны и на интенсивность солнечного света. Животные клетки обмениваются информацией о концентрации ионов и глюкозы во внеклеточных жидкостях, при этом в разных тканях протекают взаимозависимые метаболические процессы, а в зародыше организуется правильное расположение клеток в процессе развития. Во всех этих случаях сигнал представляет собой информацию, которая распознается и принимается специфическими рецепторами и преобразовывается в клеточный ответ, всегда включающий в себя химический процесс. Это превращение информации в химические реакции называется передачей (трансдукцией) сигнала и является универсальным свойством живых клеток.
12.1. Общие свойства систем передачи сигналов
Передача сигналов происходит в высшей степени специфично и с высокой чувствительностью. Специфичность достигается точной молекулярной комплементарностью между молекулами сигнального вещества и рецептора (рис. 12-1, а), опосредуемой теми же типами слабых (нековалентных) сил, которые опосредуют фермент- субстратные взаимодействия и взаимодействие антиген-антитело. Многоклеточные организмы имеют дополнительный уровень специфичности, так как рецепторы для данного сигнала или внутриклеточные мишени для данного сигнального пути присутствуют только в определенных типах клеток. Например, гормон, высвобождающий тиреотропин, запускает ответы в клетках передней доли гипофиза, но не в гепатоцитах (клетках печени), которые не имеют рецепторов для этого гормона. Адреналин изменяет метаболизм гликогена в гепатоцитах, но не в эритроцитах; хотя оба типа клеток имеют рецепторы для этого гормона, но клетки печени содержат гликоген и метаболизирующий его фермент, который стимулируется адреналином, в эритроцитах их нет.
Рис. 12-1. Четыре отличительных свойства систем передачи сигнала.
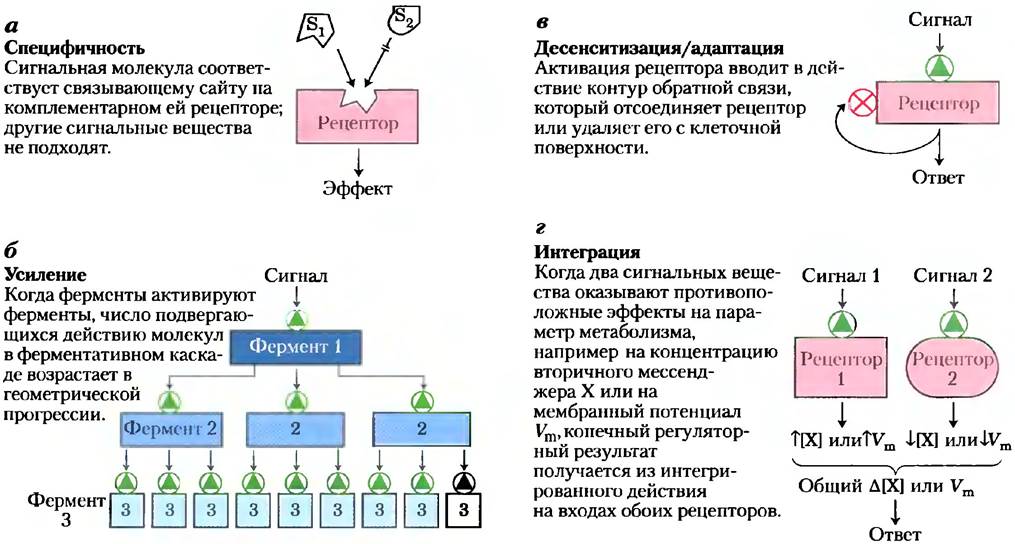
Чрезвычайно высокую чувствительность передатчиков (трансдукторов) сигнала обеспечивают три фактора: высокое сродство рецепторов к сигнальным молекулам, кооперативность (часто, но не всегда) лиганд-рецепторного взаимодействия и усиление сигнала ферментативными каскадами. Сродство между сигнальным
веществом (лигандом) и рецептором можно выразить с помощью константы диссоциации Кd, обычно ≤10-10 М, т. е. рецептор обнаруживает пикомолярные концентрации сигнального вещества. Лиганд-рецепторные взаимодействия оцениваются количественно анализом по Скэтчарду — определяют сродство (Кd) и число лиганд-связывающих центров в рецепторе (доп. 12-1).
Кооперативность лиганд-рецепторного взаимодействия приводит к сильной активации рецептора при малых изменениях концентрации лиганда (вспомним эффект кооперативности при связывании кислорода гемоглобином; рис. 5-12). Усиление ферментативными каскадами (амплификация) происходит, когда фермент, связанный с сигнальным рецептором, активируется и в свою очередь катализирует активацию многих молекул второго фермента, каждая из которых активирует много молекул третьего фермента и т. д. (рис. 12-1, б). Такие каскады могут в течение миллисекунд обеспечивать усиление величины на несколько порядков. Ответ на поступивший сигнал должен в какой-то момент прекращаться, чтобы вызванные реакции соответствовали силе исходного сигнала.
Дополнение 12-1. МЕТОДЫ. Анализ по Скэтчарду количественно характеризует взаимодействие лиганд-рецептор
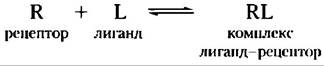
Действие гормона в клетке начинается, когда гормон (лиганд, L) специфически и прочно связывается со своим белковым рецептором (R) внутри или на поверхности клетки-мишени. Связывание опосредуется нековалентными взаимодействиями (образование водородных связей, гидрофобное и электростатическое взаимодействие) между комплементарными поверхностями лиганда и рецептора. Взаимодействие рецептор-лиганд приводит к изменению конформации, влияющему на биологическую активность рецептора, который может быть ферментом, регулятором фермента, ионным каналом или регулятором экспрессии гена.
Связывание лиганда и рецептора описывается уравнением
Подобно связыванию фермента и субстрата, такое связывание зависит от концентраций взаимодействующих компонентов и может быть охарактеризовано константой равновесия:
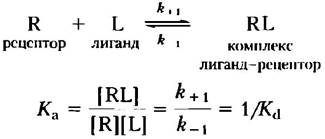
где Кa — константа ассоциации, Кd — константа диссоциации.
Как и связывание фермента с субстратом, связывание лиганд-рецептор является насыщаемым. По мере того как все большее количество лиганда добавляется к фиксированному количеству рецептора, число молекул рецептора, захватываемых лигандом, увеличивается (рис. 1, а). Для грубой оценки лиганд-рецепторного сродства служит концентрация лиганда, необходимая для полунасыщения рецептора. Используя анализ связывания лиганда и рецептора по Скэтчарду, мы можем оценить и константу диссоциации Кd, и число связывающих центров в данном препарате. Когда связывание достигает равновесия, общее число возможных связывающих центров Вmах равно сумме числа незанятых центров ([R]) и числа занятых лигандом центров ([RL]); т. е. Bmах=[R] + [RL]. Число незанятых центров можно выразить как общее число всех центров минус занятые центры: [R] = В|mах — [RL]. Для реакции ассоциации можно теперь записать
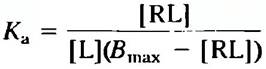
Рис. 1. Анализ взаимодействия лиганда с рецептором по Скэтчарду. Радиоактивно меченный лиганд L, например, гормон, в разных концентрациях добавляют к фиксированному количеству рецептора R и определяют фракцию гормона после отделения комплекса гормон-рецептор RL от свободного гормона. a) График [RL] от [L] + [RL] (от суммы свободного и связанного гормона, т. е. весь добавленный гормон) представляет собой гиперболу, восходящую к [RL] при насыщении рецептора. Чтобы контролировать ненасыщаемые неспецифические участки связывания (например, гормоны-эйкозаноиды неспецифически связываются с липидным бислоем), необходима отдельная серия экспериментов по связыванию. Вместе с разбавленным раствором меченого лиганда добавляют большой избыток немеченного гормона. Немеченные молекулы конкурируют с мечеными при специфическом связывании с насыщаемым сайтом на рецепторе, но не при неспецифическом связывании. Чтобы найти величину специфического связывания, надо вычесть неспецифическое связывание из общего. б) Линейный график в координатах [RL]/[L] от [RL] позволяет получить Кd и Вmах для комплекса рецептор-гормон. Сравните эти графики с графиками V0 от [S] и 1/V0 от 1/[S] для фермент- субстратного комплекса (рис. 6-12, доп. 6-1).
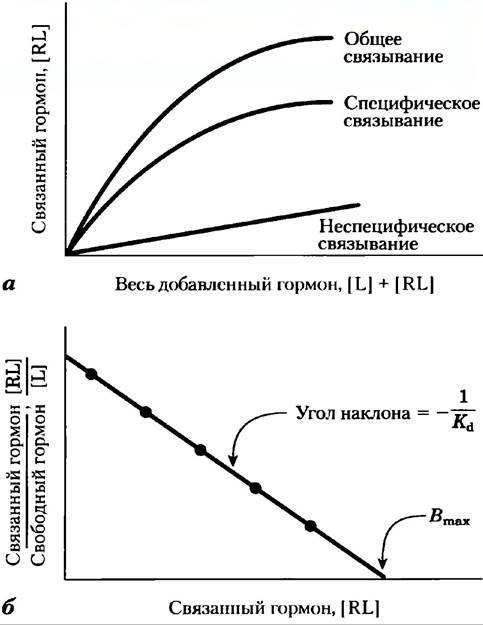
Сделав преобразования, получаем отношение связанного лиганда к свободному (несвязанному):
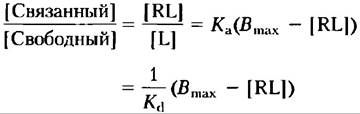
В координатах [связанный лиганд]/[свободный лиганд] — [свободный лиганд] получим прямую с углом наклона -Ка(-1/Кd), которая отсекает на оси абсцисс отрезок, равный Вmах (общее число связывающих сайтов) (рис. 1, б). Когда лиганды представляют собой гормоны, значения Кd находятся в интервале от 10-9 до 10-11 М, что соответствует очень прочному связыванию.
Анализ по Скэтчарду надежен для самых простых случаев, по, как и в случае графиков Лайнуивера- Бэрка для ферментов, если рецептор представлен аллостерическим белком, наблюдаются отклонения от линейного вида.
Чувствительность рецепторных систем может изменяться. Когда сигнальное вещество действует продолжительно (непрерывно), происходит десенситизация (потеря чувствительности) рецепторной системы (рис. 12-1, б); когда стимул ослабевает ниже порогового значения — система снова обретает чувствительность. Представьте себе, что случается с системой передачи зрительных сигналов, когда вы входите с яркого солнечного света в темную комнату или выходите из темноты на свет.
Последней отличительной чертой систем передачи сигналов является интеграция (рис. 12-1, г), т. е. способность системы получать множественные сигналы и давать единый ответ, в соответствии с нуждами клетки или организма. Различные сигнальные пути «переговариваются» друг с другом на разных уровнях, генерируя множество взаимодействий, которые поддерживают гомеостаз в клетке и организме.
При изучении механизмов передачи сигналов выявлена удивительная особенность — их высокая степень консерватизма в процессе эволюции. Хотя общее число различных биологических сигналов (см. табл. 12-1), по-видимому, составляет несколько тысяч и число возможных типов ответов столь же велико, система передачи всех этих сигналов состоит из десятка основных белковых компонентов. В данной главе мы рассмотрим несколько примеров основных механизмов передачи сигнала, и обсудим, каким образом они используются для выполнения специфических биологических функций, таких как передача нервного импульса, ответ на сигналы гормонов и ростовых факторов, зрительное, обонятельное и вкусовое восприятие, а также контроль клеточного цикла. Часто конечным этапом сигнального пути является фосфорилирование нескольких специфических белков в клетках-мишенях, что приводит к изменению активности этих белков и, как следствие, к изменению активности клеток. По ходу обсуждения мы постоянно будем обращать внимание на консервативность фундаментальных механизмов передачи биосигналов и на способы адаптации этих основных механизмов к широкому кругу сигнальных путей.
Таблица 12-1. Некоторые сигналы, на которые отвечают клетки

В этой главе мы рассмотрим молекулярные детали нескольких типичных систем передачи сигналов. Триггеры для разных систем разные, но главные стадии передачи сигналов общие для всех, а именно: сигнальное вещество реагирует с рецептором; активированный рецептор действует на клеточные механизмы, продуцируя второй сигнал или изменение активности клеточного белка; метаболическая активность (в широком смысле, включая метаболизм РНК, ДНК и белков) в клетке-мишени подвергается изменениям; и наконец, процесс трансдукции завершается, и клетка возвращается в первоначальное (бывшее до действия стимула) состояние. Чтобы проиллюстрировать эти общие свойства сигнальных систем, мы представим в качестве примеров шесть основных сигнальных механизмов (рис. 12-2).
1. Рецепторы, сопряженные с G-белком, которые опосредованно активируют (через GТР-связывающие белки, или G-белки) ферменты, генерирующие внутриклеточные вторичные мессенджеры. Это иллюстрируется на примере β-адренергической рецепторной системы, которая реагирует на адреналин (разд. 12.2).
2. Рецепторные тирозинкиназы — рецепторы плазматической мембраны, которые одновременно функционируют как ферменты. Когда один из этих рецепторов активируется его внеклеточным лигандом, он катализирует образование внутриклеточного вторичного мессенджера. Примерами могут служить рецептор инсулина (разд. 12.3) и рецептор эпидермального фактора роста (ЕGF-R).
3. Рецепторные гуанилатциклазы — рецепторы плазматической мембраны с цитоплазматическим ферментативным доменом. Внутриклеточный вторичный мессенджер для этих рецепторов циклический гуанозинмонофосфат (сGМР) активирует протеинкиназу в цитозоле, которая фосфорилирует клеточные белки и таким образом меняет их активность (разд. 12.4).
4. Управляемые (регулируемые) ионные каналы плазматической мембраны, которые открываются и закрываются в ответ на связывание химических лигандов или изменения трансмембранного потенциала. Эти каналы являются простейшими передатчиками сигнала. Пример такого механизма — ацетилхолиновый ионный канал (разд. 12.2).
Рис. 12-2. Шесть основных типов механизмов передачи сигнала.
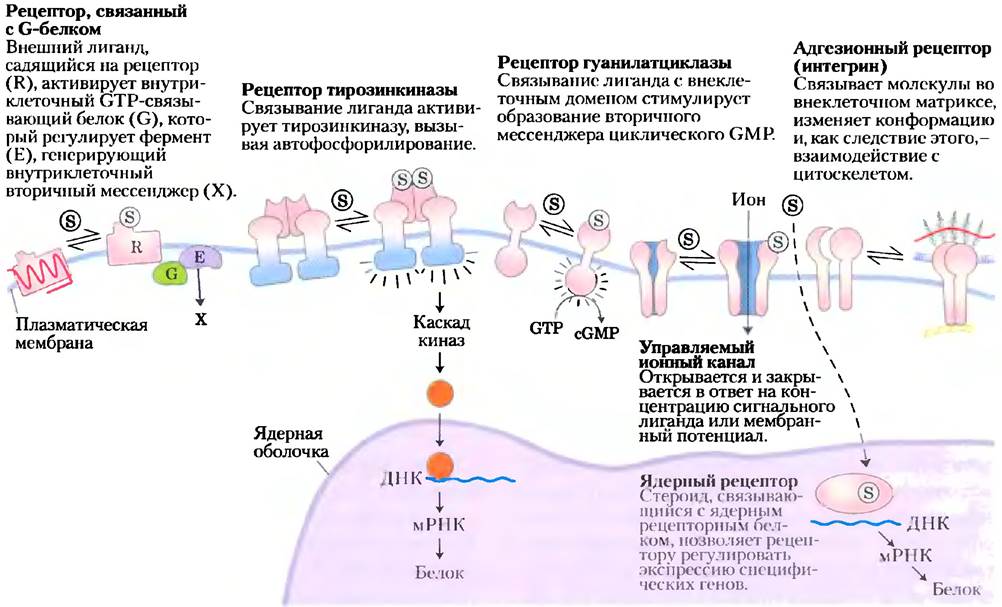
5. Адгезионные рецепторы, которые взаимодействуют с макромолекулярными компонентами внеклеточного матрикса (например, коллагеном) и передают системе цитоскелета инструкции, касающиеся миграции клетки или ее сцепления с матриксом. Интегрины (о них говорилось в гл. 10) иллюстрируют этот общий тип механизма передачи сигнала.
6. Ядерные рецепторы (стероидные рецепторы), которые при связывании со специфическим лигандом (например, эстрогеном) изменяют скорость, с которой специфические гены транскрибируются и транслируются в клеточные белки. Поскольку стероидные гормоны функционируют посредством механизма, тесно связанного с регуляцией экспрессии генов, здесь мы рассмотрим их очень кратко (разд. 12.8), а детальное обсуждение их действия отложим до гл. 28.
Мы приступаем к обсуждению механизмов передачи биосигналов и для начала скажем несколько слов о номенклатуре сигнальных белков. В большинстве случаев эти белки были открыты в ходе решения какой-то конкретной задачи и были названы соответствующим образом. Позднее выяснилось, что они участвуют в выполнении гораздо более широкого спектра биологических функций, с которыми их первоначальное название никак не связано. Например, белок ретинобластомы, pRb, исходно был идентифицирован как белок, мутация которого вносит вклад в развитие рака сетчатки (ретинобластомы). Однако теперь известно, что этот белок участвует во многих важных для клеточного деления процессах во всех клетках, а не только в клетках сетчатки. Некоторые гены и белки получили довольно неопределенные названия: например, супрессор опухолевого роста р53 — белок (англ. protein) с молекулярной массой 53 кДа, но такое название ничего не говорит о чрезвычайно важной роли этого белка в регуляции деления клеток и развитии рака. По ходу изложения материала мы будем объяснять смысл таких
названий и приводить названия, которые обычно используют исследователи, работающие в данной области. Не смущайтесь, если не сможете понять название белка при первом знакомстве с ним!
Краткое содержание раздела 12.1 Общие свойства передачи сигналов
■ Все клетки имеют специфические и высокочувствительные сигналпередающие механизмы, которые сохранились в процессе эволюции.
■ Множество разнообразных стимулов действуют через специфические белковые рецепторы в плазматической мембране.
■ Рецепторы связывают сигнальную молекулу, усиливают сигнал, интегрируют его с сигналами от других рецепторов и передают в клетку. Если сигнал продолжает действовать, десенсибилизация рецептора уменьшает или прекращает ответ.
■ У многоклеточных организмов существуют шесть основных типов механизмов сигнализации: мембранные белки, которые действуют через G-белки; рецепторные тирозинкиназы; рецепторные гуанилатциклазы, которые действуют через протеинкиназы; управляемые ионные каналы; ферменты; адгезионные рецепторы, которые переносят информацию между внеклеточным матриксом и цитоскелетом; ядерные белки, которые связывают стероиды и влияют на экспрессию генов.