ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
12. БИОСИГНАЛИЗАЦИЯ
12.3. Рецепторные ферменты
Рецепторные тирозинкиназы (RTK) — большое семейство рецепторов, расположенных в плазматической мембране и обладающих собственной протеин киназ ной активностью. Механизм передачи внеклеточных сигналов с помощью этих рецепторов принципиально отличается от механизма передачи сигнала при участии GPCR. Лигандсвязывающий домен RTK, расположенный на наружной поверхности плазматической мембраны, и активный центр фермента, расположенный на цитоплазматической поверхности, соединены между собой единственным трансмембранным сегментом. Цитоплазматический домен представляет собой протеинкиназу (тирозинкиназу), которая фосфорилирует остатки Туr в специфических белках-мишенях. Прототипами белков этой группы являются рецептор инсулина и рецептор эпидермального фактора роста.
Стимуляция рецептора инсулина запускает каскад реакций фосфорилирования белков
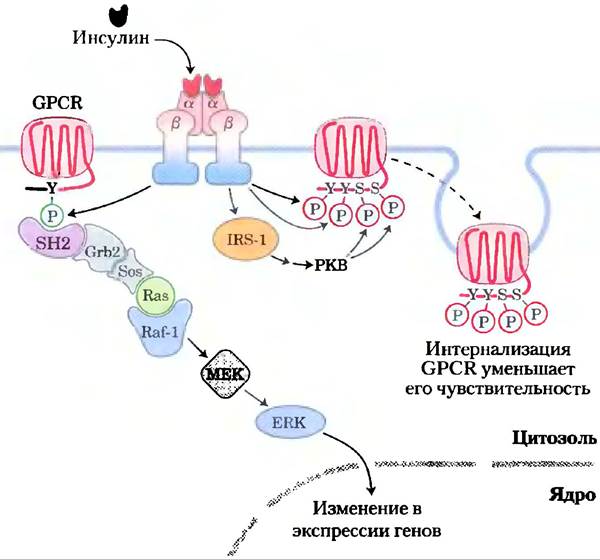
Инсулин регулирует и метаболизм, и экспрессию генов: инсулиновый сигнал идет от рецептора на плазматической мембране к инсулинчувствительным метаболическим ферментам и к ядру, где он стимулирует транскрипцию специфических генов. Активный инсулиновый рецептор (INS-R) состоит из двух идентичных a-цепей, выступающих с внешней стороны плазматической мембраны, и двух трансмембранных β-субъединиц, С-концы которых направлены в цитозоль (рис. 12-14). α-Цепи содержат инсулинсвязывающий домен, а внутриклеточные домены β-цепей, обладающие протеинкиназной активностью, переносят фосфорильную группу от АТР к гидроксильной группе остатков Туr в специфических белках- мишенях. Передача сигнала через инсулиновый рецептор начинается, когда связывание инсулина с a-цепями активирует тирозинкиназную активность β-цепей, и каждый a β-мономер фосфорилирует три ключевых остатка Туг вблизи С-конца β-цепи его партнера в димере. Аутофосфорилированиеоткрывает активный центр таким образом, что фермент может фосфорилировать остатки Туr других белков-мишеней. Стимуляция инсулинового рецептора инициирует каскад реакций фосфорилирования белка. Механизм активации протеинкиназной активности инсулинового рецептора аналогичен таковому для РКА и РКС: участок цитоплазматического домена (ингибирующая последовательность), которая в норме закрывает активный центр, после фосфорилирования покидает активный центр и делает его доступным для связывания белков-мишеней (рис. 12-14).
Одним из таких белков-мишеней (рис. 12-15, стадия (1)) является субстрат-1 инсулинового рецептора (IRS-1; стадия (2)). Однократно фосфорилированный по своим Туr-остаткам, IRS-1 служит центром образования комплекса белков (стадия (3)), который переносит информацию от инсулинового рецептора к конечным мишеням в цитозоле и ядре через целую серию промежуточных белков. Прежде всего, остаток![]() Туг в IRS-1 связывается SН2-доменом белка Grb2. (SH2 — от англ. Src homology 2\ аминокислотные последовательности SH2-доменов сходны с последовательностью домена в другой тирозинкиназе белков — Src (произносится «сарк»)). Несколько сигнальных белков содержат SН2-домены, все они связывают остатки
Туг в IRS-1 связывается SН2-доменом белка Grb2. (SH2 — от англ. Src homology 2\ аминокислотные последовательности SH2-доменов сходны с последовательностью домена в другой тирозинкиназе белков — Src (произносится «сарк»)). Несколько сигнальных белков содержат SН2-домены, все они связывают остатки![]() -Туг белка-партнера. Grb2 содержит также второй белоксвязывающий домен SH3, который связывается с участками, богатыми остатками Pro. Grb2 связывается с богатой пролином областью Sos, вовлекая Sos в разрастающийся рецепторный комплекс. Связанный с Grb2, Sos выступает как фактор обмена нуклеотидов (GEF), катализируя замещение связанного GDP на GTP в белке Ras (G-белке).
-Туг белка-партнера. Grb2 содержит также второй белоксвязывающий домен SH3, который связывается с участками, богатыми остатками Pro. Grb2 связывается с богатой пролином областью Sos, вовлекая Sos в разрастающийся рецепторный комплекс. Связанный с Grb2, Sos выступает как фактор обмена нуклеотидов (GEF), катализируя замещение связанного GDP на GTP в белке Ras (G-белке).
Ras — представитель семейства малых G-белков, которые опосредуют передачу множества разнообразных сигналов (доп. 12-2). Подобно тримерному G-белку, участвующему в ß-адренергической системе передачи сигнала (рис. 12-5), белок Ras может находиться в активной конформации (в комплексе с GTP) и в неактивной конформации (в комплексе с GDP), однако Ras — мономер (-20 кДа). Когда GTP связывается, Ras может активировать протеин- киназу Raf-1 (рис. 12-15, стадия (4)), первую из трех протеинкиназ — Raf-1, MEK и ERK, — которые образуют каскад, где каждая киназа активирует следующую путем фосфорилирования (стадия (5)). Протеинкиназы МЕК и ERK активируются при фосфорилировании остатков Thr и Туr. В активированном состоянии они опосредуют некоторые из биологических эффектов
инсулина, входя в ядро и фосфорилируя такие белки, как Elk 1(стадия (6)), модулирующий транскрипцию почти 100 регулируемых инсулином генов (стадия (7)).
Рис. 12-14. Активация тироэинкинаэы инсулинового рецептора аутофосфорилированием. а) Инсулинсвязывающий участок (розовый; изображен в виде контура поверхностикристаллическойструктуры; взято из РDВ ID 2DTG) инсулиновогорецепторанаходитсявне клетки и состоит из (б) двух α-субъединиц и внеклеточных участков двух β-субъединиц. (Структуру трансмембранного домена не удалось установить методом РСА.) Информация о связывании инсулина (красный; РDВ ID 2СЕU) передается по единственной трансмембранной спирали каждой β-субъединицы к соответствующим тирозинкиназным доменам внутри клетки, в результате чего они активируются и фосфорилируют друг друга по трем остаткам тирозина, в) В неактивной форме тирозинкиназного домена (РDВ ID IРК) активационная петля (синий цвет) находится в активном центре, и ни один из ключевых остатков Туг (черно-красные шаростержневые модели) не фосфорилируется. Эта конформация стабилизируется образованием водородной связи между Туr1162 и Аsр1132. г) Активация тирозинкиназы позволяет каждой β-субъединице димера фосфорилировать три остатка Туr (Туr1158, Туr1162 и Туr1163) на другой субъединице (РDВ ID 1 IR3. (Фосфорильные группы обозначены с помощью шаростержневой модели: атомы фосфора оранжевые, атомы кислорода красные.) Эффект трех заряженных остатков (P)-Туrзаключается в том, чтобы заставить активационную петлю отклониться от своего положения на 30 А в сторону от центра связывания субстрата, который получает возможность связывать и фосфорилировать белок-мишень, показанный красной стрелкой.
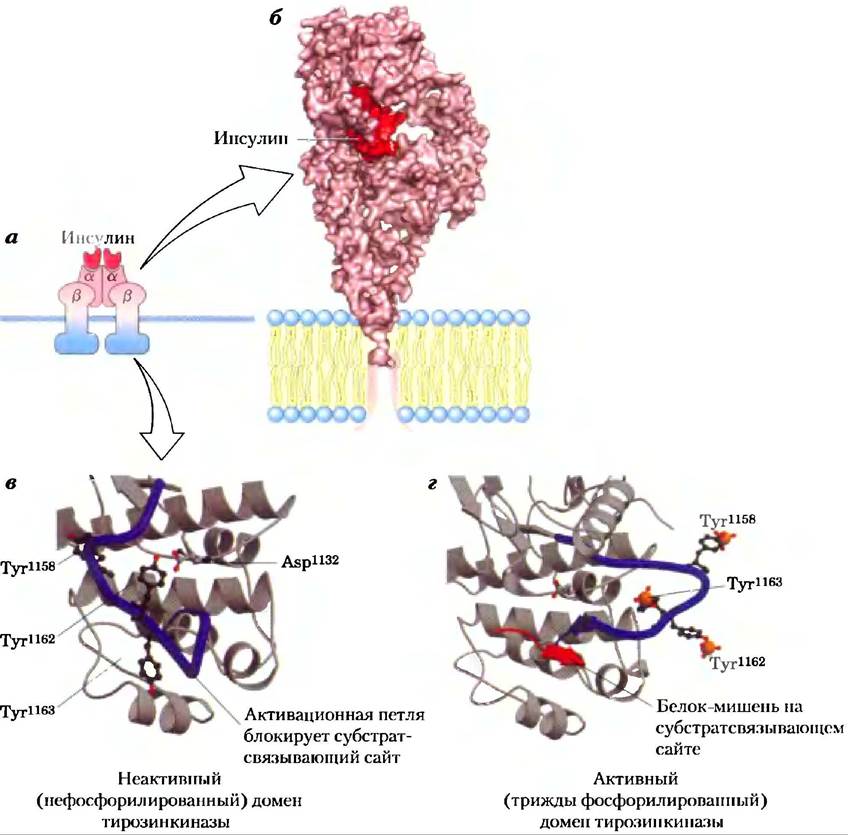
Рис. 12-15. Регуляция экспрессии генов инсулином. Рецептор инсулина (INS-R) состоит из двух a-цепей, расположенных на внешней стороне плазматической мембраны, и двух β-цепей, которые пересекают мембрану и выступают с внутренней стороны. Связывание инсулина с a-цепями вызывает конформационную перестройку, которая делает возможным аутофосфорилирование остатков Туr в С-концевом домене β-субъединиц. Аутофосфорилирование активирует тирозинкиназный домен, который затем катализирует фосфорилирование других белков-мишеней. Сигнальный путь, по которому инсулин регулирует экспрессию специфических генов, состоит из каскада протеинкиназ, каждая из которых активирует следующую. Рецептор инсулина является тирозинспецифичной киназой; другие киназы (все окрашены в голубой цвет) фосфорилируют остатки Ser или Thr. МЕК — киназа с двойной специфичностью, которая фосфорилирует остатки и Thr, и Туr в ERK (от англ. extracellular regulated kinase — внеклеточная регулируемая киназа); МЕК — киназа, активируемая митогеном и активирующая ERK; SRF — сывороточный фактор отклика (англ. serum response factor).
Белки Raf-1, МЕК и ERK — члены трех больших семейств, которые классифицируют несколькими способами. ERK — член семейства МАРК (от англ, mitogen-activated proteinkinases; митогены — это сигнальные вещества, которые действуют извне и индуцируют митоз и клеточное деление). Вскоре после открытия первой МАРК было обнаружено, что этот фермент активируется другой протеинкиназой, которую пришлось назвать киназой MAP-киназы (МЕК принадлежит к этому семейству); а когда была открыта третья киназа, которая активирует киназу MAP-киназы, ей дали немного нелепое название «МАР-киназа киназы киназы» (Raf-1 является членом этого семейства; рис. 12-15, стадия (4)). Акронимы этих трех семейств менее громоздки: МАРК, МАРКК, МАРККК. Киназы семейств МАРК и МАРККК специфичны к остаткам Ser или Thr, а киназы МАРКК (здесь МЕК) фосфорилируют в своих субстратах (МАРК, здесь ERK) остатки и Ser, и Туr.
В настоящее время биохимики поняли, что инсулиновый путь не единственный пример универсального механизма, по которому гормональные сигналы приводят к фосфорилированию ферментов-мишеней протеинкиназами способами, сходными с показанными на рис. 12-15. Мишенью для фосфорилирования часто служит другая протсинкиназа, которая затем фосфорилирует третью протеинкиназу и т. д. В результате каскад ферментативных реакций усиливает первоначальный сигнал на много порядков (см. рис. 12-1, б). МАРК-каскады (рис. 12-15) опосредуют передачу сигналов, вызванных различными ростовыми факторами, такими как тромбоцитарный фактор роста (PDGF) и эпидермальный фактор роста (EGF). Еще одна общая схема, рассмотренная здесь на примере инсулинового рецептора, состоит в использовании адаптерных белков, соединяющих компоненты разветвленного сигнального пути.
Мембранный фосфолипид РIР3 работает в одной из ветвей передачи сигнала инсулина
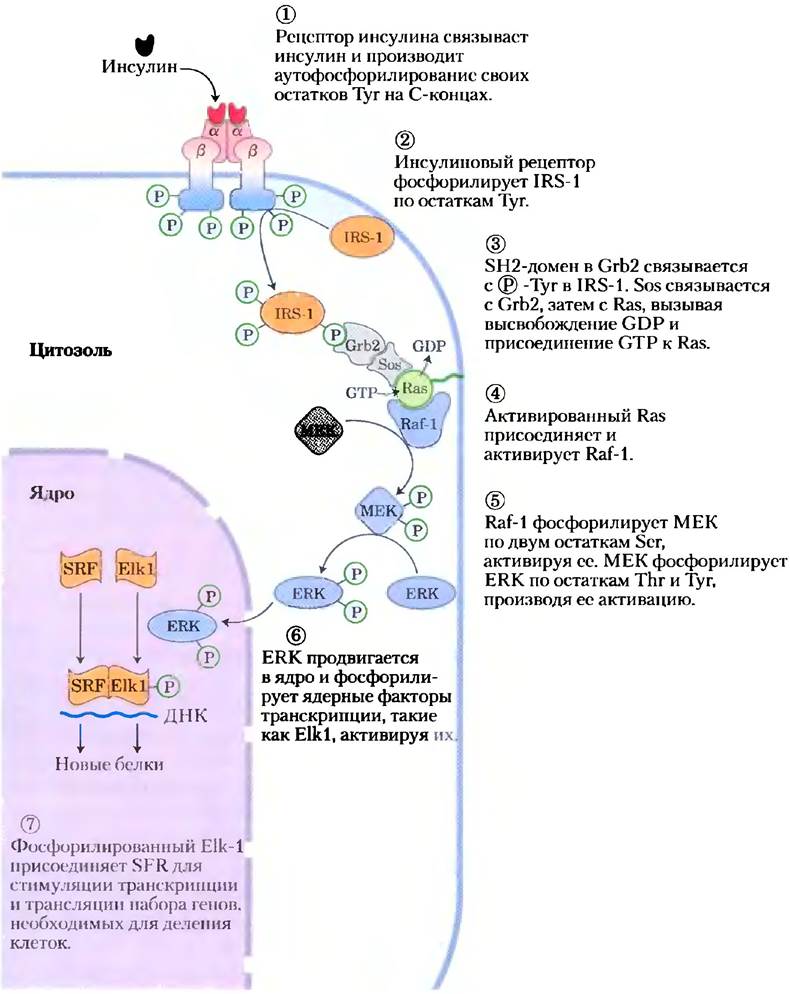
Путь передачи сигнала, инициированного инсулином, разветвляется на уровне субстрата 1RS-1 (рис. 12-15, стадия (D). Белок Grb2 — не единственный белок, связывающийся с фосфорилированпым IRS-1. Фермент фосфоинозитид- 3-киназа (Р1-ЗК) соединяется с IRS-1 через ее SН2-домен (рис. 12-16). Активированная таким образом, PI-3K превращает мембранный липид фосфатидилинозит-4,5-бисфосфат (см. рис. 10-16), называемый также РIР2, в фосфатидилинозит-3,4,5-трисфосфат (PIP3). Несущая на себе несколько зарядов «головка» PIP3, выступающая из цитоплазматической поверхности плазматической мембраны, является исходной точкой для второй ветви сигнального пути, в которой задействован еще один каскад протеинкиназ. Когда с Р1Р3 связана протеин- киназа В (РКВ), она фосфорилируется и активируется другой протеинкиназой PDK1. Затем активированная РКВ фосфорилирует остатки Ser или Thr своих белков-мишеней, один из которых — киназа 3-гликогенсинтазы (GSK3). В активной нефосфорилированной форме GSK3 фосфорилирует гликогенсинтазу, инактивируя ее и тем самым обеспечивая замедление синтеза гликогена. (Этот механизм — только часть процесса, описывающего влияние инсулина на метаболизм гликогена.) При фосфорилировании посредством РКВ GSK3 инактивируется. Препятствуя таким образом инактивации гликоген- синтазы в печени и мышцах, каскад фосфорилирования белков, инициированный инсулином, стимулирует синтез гликогена (рис. 12-16). В мышцах РКВ запускает движение транспортеров глюкозы (GLUT4) из внутренних везикул к плазматической мембране, стимулируя поглощение глюкозы из крови (рис. 12-16, стадия (5); см. также доп. 11-2).
Рис. 12-16. Активация гликогенсинтазы инсулином. Передача сигнала опосредуется РI-3- киназой (Р1-3К) и протеинкиназой В (РКВ).
Протеинкиназа В участвует также в других сигнальных путях, включая тот, который запускается ∆9-тетрагидроканнабинолом (ТНС), активным ингредиентом марихуаны и гашиша. ТНС активирует СВ1-рецептор в плазматической мембране нейронов головного мозга, запуская сигнальный каскад, в который входят МАР-киназы. Одно из последствий активации СВ, проявляется как стимуляция аппетита — известный эффект употребления марихуаны. В организме лигандами рецептора СВ, являются эндоканнабиноиды, такие как анандамид, который служит для защиты мозга от токсического действия избыточной нервной активности, например, эпилептических судорог. Гашиш веками использовался для лечения эпилепсии.
Как и во всех сигнальных путях, существует механизм прекращения передачи сигнала через каскад РI-3К-РКВ. РIР3-специфичная фосфатаза (у человека РТЕN) отщепляет от РIР3 фосфат в положении 3 с образованием РIР2, который более не является лигандом для РКВ, и цепь сигнализации прерывается. На поздних стадиях рака различной локализации опухолевые клетки часто имеют дефект в гене РТЕN и вследствие этого имеют аномально высокий уровень РIР3 и активности РКВ. В результате, по-видимому, возникает непрекращающийся сигнал, побуждающий клетки к делению, а опухоль к росту. ■
Помимо многих рецепторов, которые действуют как протеинтирозинкиназы, целый ряд рецептороподобных белков в плазматической мембране обладают активностью протеинтирозинфосфатазы. Основываясь на структурах этих белков, мы можем предположить, что их лигандами являются компоненты внеклеточного матрикса или поверхностей других клеток. Хотя их роль в сигнализации пока еще до конца не понята, как и роль рецепторных тирозинкиназ, очевидно, что они имеют возможность обращать действие сигналов, стимулирующих эти киназы.
Инсулиновый рецептор — прототип целого ряда рецепторных ферментов с похожей структурой и активностью рецепторной тирозинкиназы (рис. 12-17). Например, рецепторы эпидермального фактора роста и фактора роста, производимого тромбоцитами, имеют сходство в структуре и аминокислотной последовательности с инсулиновым рецептором, и оба обладают активностью протеинтирозинкиназы, которая фосфорилирует IRS-1. Многие из этих рецепторов после связывания лиганда димеризуются; инсулиновый рецептор представляет собой димер до присоединения инсулина. Связывание адаптерных белков, таких как Сrb2, с остатками (P)-Туr — общий механизм для облегчения белок-белковых взаимодействий. К этому предмету мы вернемся в разд. 12.5.
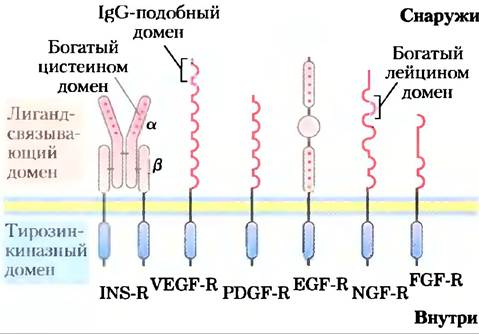
Рис. 12-17. Рецепторные тирозинкиназы. К рецепторам ростовых факторов, передающих сигнал посредством тирозинкиназной активности, относятся рецепторы инсулина (INS-R), фактора роста сосудистого эндотелия (VEGF-R), фактора роста тромбоцитов (PDGF-R), фактора роста эпидермиса (EGF-R), фактора роста нервов (NGF-R) и фактора роста фибробластов (FGF-R). Все эти рецепторы содержат тирозинкиназный домен на цитоплазматической стороне плазматической мембраны (синий цвет). Внеклеточный домен у каждого рецептора свой, поскольку каждый рецептор обладает сродством только к определенному фактору роста. Эти внеклеточные домены обычно представляют собой комбинацию структурных мотивов, таких как богатые цистеином или лейцином последовательности и участки, содержащие один или несколько мотивов, характерных для иммуноглобулинов (Ig-подобные домены; см. с. 203). В геноме человека закодировано много других рецепторов данного типа, и каждый из них имеет собственный внеклеточный домен.
Что стимулировало эволюцию такого сложного регуляторного механизма? Эта система позволяет одному активированному рецептору активировать несколько молекул IRS-1, усиливая инсулиновый сигнал, что обеспечивает интеграцию сигналов от нескольких рецепторов, каждый может фосфорилировать IRS-1. Болес того, поскольку IRS-1 может активировать любой из белков, которые содержат SH2-домены, единичный рецептор, действующий через IRS-1, может инициировать два (или более) сигнальных пути. Так, инсулин влияет на экспрессию генов через каскад Grb2-Sos-Ras-MAPK и на метаболизм гликогена через каскад РI-ЗК-РКВ. Наконец, существует несколько близкородственных белков IRS (IRS-1, IRS-2), каждый из которых характерным образом распределен в тканях и выполняет особые функции, что дополнительно расширяет возможности сигнальных путей, инициируемых RKT.
Сигнальная система JAK-STAT также использует тирозинкиназную активность
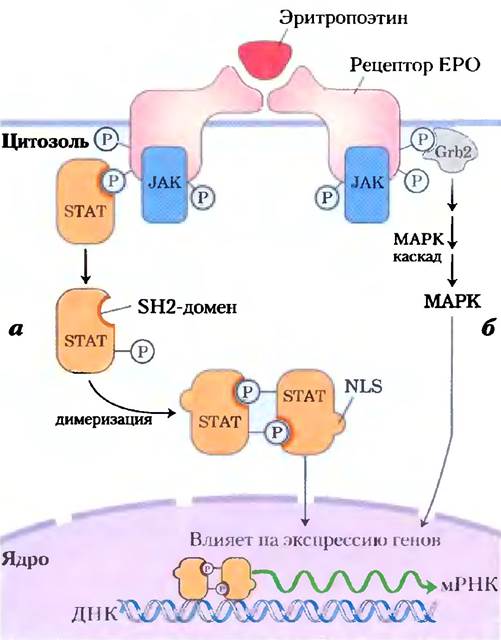
Вариация на основную тему рецепторных тирозинкиназ просматривается и в рецепторах, которые не обладают собственной протеинкиназной активностью, но после присоединения своих лигандов связываются с тирозинкиназой в цитозоле. Один из примеров — система, которая регулирует образование эритроцитов у млекопитающих. Цитокином (сигнальным веществом, связанным с развитием) для этой системы является эритропоэтин (ЕРО) — состоящий из 165 аминокислот белок, производимый почками. Когда ЕРО связывается со своим рецептором на плазматической мембране (рис. 12-18), рецептор димеризуется и становится способным присоединять растворимую протеинкиназу JAK (англ. Janus kinase). Это связывание активирует JAK, которая фосфорилирует несколько остатков Туг в цитоплазматическом домене рецептора ЕРО. Семейство факторов транскрипции, называемых STAT (от англ. signal transducers and activators of transcription), также является мишенями активности JAK. SН2-домен в STAT5 связывает остатки (P)-Туr в рецепторе ЕРО, переводя их в положение, удобное для фосфорилирования протеинкиназой (JAK). Когда STAT5 фосфорилируется в ответ на действие ЕРО, он образует димеры, способные проникать в ядро. Здесь STAT5 вызывает экспрессию (транскрипцию) специфических генов, необходимых для созревания эритроцитов. Система JAK-STAT работает в нескольких сигнальных путях, включая путь гормона лептина, детально описанный в гл. 23 (рис. 23-37). Активированная JAK может также при участии Grb2 запускать каскад МАРК (рис. 12-18, б), который приводит к изменению экспрессии специфических генов.
Рис. 12-18. Механизм передачи сигнала JAK-STAT для рецептора эритропоэтина. Связывание эритропоэтина (ЕРО) вызывает димеризацию рецептора ЕРО, что позволяет растворимой тирозинкиназе JAK присоединиться к внутреннему домену рецептора и фосфорилировать его по нескольким остаткам Туr. а) По одному сигнальному пути SН2-домен белка STAT5 связывается на рецепторе с остатками![]() -Туr, что приводит к сближению рецептора и JAK. Фосфорилирование STAT5 JAK-киназой позволяет двум молекулам STAT образовать димер, при этом каждая молекула связывает разные остатки
-Туr, что приводит к сближению рецептора и JAK. Фосфорилирование STAT5 JAK-киназой позволяет двум молекулам STAT образовать димер, при этом каждая молекула связывает разные остатки![]() -Туr. Димеризация STAT5 экспонирует последовательность NLS (от англ. nuclear localization sequence), которая обеспечивает транспорт STAT5 в ядро. В ядре STAT вызывает экспрессию генов, контролируемых ЕРО. б) Второй сигнальный путь запускается аутофосфорилированием JAK, которая присоединяется к ЕРО, связанному с рецептором, адаптерный белок Grb2 связывает
-Туr. Димеризация STAT5 экспонирует последовательность NLS (от англ. nuclear localization sequence), которая обеспечивает транспорт STAT5 в ядро. В ядре STAT вызывает экспрессию генов, контролируемых ЕРО. б) Второй сигнальный путь запускается аутофосфорилированием JAK, которая присоединяется к ЕРО, связанному с рецептором, адаптерный белок Grb2 связывает![]() -Туr в JAK и запускает каскад МАРК, как в инсулиновой системе (см. рис. 12-15).
-Туr в JAK и запускает каскад МАРК, как в инсулиновой системе (см. рис. 12-15).
Белок Src — еще одна растворимая протеинтирозинкиназа, которая связывается с некоторыми рецепторами, когда они присоединяют лиганды. В белке Src впервые был обнаружен характерный![]() -Туг-связывающий домен, который впоследствии получил название «SН2-домен».
-Туг-связывающий домен, который впоследствии получил название «SН2-домен».
Сигнальные системы связаны между собой сложным образом
Для простоты мы рассматривали отдельные пути передачи сигналов как независимые последовательности событий, приводящих к отдельным метаболическим последствиям, однако на самом деле между сигнальными системами существует тесная взаимосвязь. Система регуляции метаболизма сложно переплетена и многослойна. Мы отдельно обсуждали пути передачи сигнала от инсулина и адреналина, но они не являются независимыми. Во многих тканях действие инсулина противоположно метаболическому действию адреналина, а активация инсулинового сигнального пути ослабляет передачу сигнала по β-адренергическому пути. Например, тирозиикиназа инсулинового рецептора напрямую фосфорилирует два остатка Туr в цитоплазматическом домене β2-адренергического рецептора, а активированная инсулином РКВ (рис. 12-19) фосфорилирует два остатка Ser в той же области. Фосфорилирование этих четырех остатков приводит к интернализации β2-адренергического рецептора, в результате чего он «выходит из строя», а клетка становится менее чувствительной к адреналину. Другой тип связи между этими рецепторами проявляется, когда остатки![]() Туr в β2-адренергическом рецепторе, фосфорилированные под действием инсулинового рецептора, служат местом присоединения содержащих SH2-домен белков, таких как Grb2 (рис. 12-19, слева). Активация инсулином фермента ERK в МАРК-каскаде (см. рис. 12-15) происходит в 5-10 раз активнее в присутствии β2-адренергического рецептора, возможно, благодаря существованию этой взаимосвязи. Системы передачи сигнала, использующие сАМР и Са2+, также взаимозависимы: каждый вторичный мессенджер влияет на образование и концентрацию другого. Одна из основных задач системной биологии состоит в сортировке результатов таких взаимодействий в метаболизме всех тканей организма — прямо скажем, задача не из легких!
Туr в β2-адренергическом рецепторе, фосфорилированные под действием инсулинового рецептора, служат местом присоединения содержащих SH2-домен белков, таких как Grb2 (рис. 12-19, слева). Активация инсулином фермента ERK в МАРК-каскаде (см. рис. 12-15) происходит в 5-10 раз активнее в присутствии β2-адренергического рецептора, возможно, благодаря существованию этой взаимосвязи. Системы передачи сигнала, использующие сАМР и Са2+, также взаимозависимы: каждый вторичный мессенджер влияет на образование и концентрацию другого. Одна из основных задач системной биологии состоит в сортировке результатов таких взаимодействий в метаболизме всех тканей организма — прямо скажем, задача не из легких!
Рис. 12-19. Взаимодействие между инсулиновым рецептором и β2-адренергическим рецептором (или другим GPCR). При активации INS-R в результате связывания инсулина его тирозинкиназа напрямую фосфорилирует β2-адренергический рецептор (справа) по двум остаткам тирозина (Туr350 и Туr364) вблизи С-конца белка и, кроме того, путем активации протеинкиназы В (РКВ; см. рис. 12-16) вызывает фосфорилирование двух остатков Ser в той же области. В результате такого фосфорилирования происходит интернализация адренергического рецептора, ослабляющая ответ на адреналин. С другой стороны, катализируемое инсулиновым рецептором фосфорилирование GPCR (это может быть, как адренергический, так и какой-то другой рецептор) по С-концевым остаткам Туr (слева) создает условия для активации МАРК-каскада (см. рис. 12-15); роль адаптерного белка при этом исполняет Grb2. В данном случае INS-R использует GPCR для усиления проведения собственного сигнала.
Краткое содержание раздела 12.3 Рецепторные ферменты
■ Инсулиновый рецептор (INS-R) — прототип рецепторных ферментов с тирозинкиназной активностью. Котла инсулин связывается с рецептором, каждый ар-димер рецептора фосфорилирует β-цепь его партнера, активируя тирозинкиназную активность рецептора. Эта киназа катализирует фосфорилирование остатков Туг в других белках, таких как IRS-1.
■ Фосфорилированные остатки IRS-1 служат центрами связывания для белков с SН2- доменами. Некоторые из этих белков, такие как Grb2, имеют два (или более) связывающих белки домена и могут служить адаптерами, сближающими два белка.
■ Sos связывается с Grb2 и катализирует обмен GDP на GTP на белке Ras (малый G-белок), который в свою очередь активирует каскад протеинкиназ, заканчивающийся фосфорилированием белков-мишеней в цитозоле или ядре. Результатом являются специфические изменения метаболизма и экспрессии генов.
■ Фермент PI-3K, активированный в результате взаимодействия с субстратом IRS-1, превращает мембранный липид РIР2 в PIP3, который становится местом сборки белковых комплексов для второй и третьей ветвей инсулинового сигнального пути.
■ В сигнальной системе JAK-STAT растворимая тирозинкиназа JAK активируется в результате связывания с рецептором, а затем фосфорилирует фактор транскрипции STAT, который входит в ядро и влияет на экспрессию ряда генов. Между сигнальными системами существуют сложные и протяженные связи, которые позволяют осуществлять контроль и тонкую настройку действия множества гормонов.