ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
20. БИОСИНТЕЗ УГЛЕВОДОВ У РАСТЕНИЙ И БАКТЕРИЙ
20.3. Биосинтез крахмала и сахарозы
При активном фотосинтезе на ярком свете в листьях растений синтезируется больше углеводов (триозофосфатов), чем нужно для получения энергии или предшественников в реакциях синтеза. Излишек превращается в сахарозу и транспортируется в другие части растения для использования в качестве топлива или для хранения. У большинства растений крахмал — главное запасаемое вещество, но у некоторых растений, таких как сахарная свекла или сахарный тростник, главным запасаемым веществом служит сахароза. Синтез сахарозы и крахмала происходит в разных отделах клетки (в цитозоле и пластидах соответственно), и эти процессы управляются различными регуляторными механизмами, которые чувствительны к изменениям интенсивности света и скорости фотосинтеза.
ADP-глюкоза — субстрат для синтеза крахмала в пластидах растений и гликогена у бактерий
Крахмал, как и гликоген, — высокомолекулярный полимер D-глюкозы с α (1 —> 4)-связыо. В качестве одного из стабильных конечных продуктов фотосинтеза он синтезируется для временного хранения в хлоропластах, а для запасания (на длительные сроки) он производится в нефотосинтезирующих частях растения — семенах, корнях и клубнях (подземных стеблях).
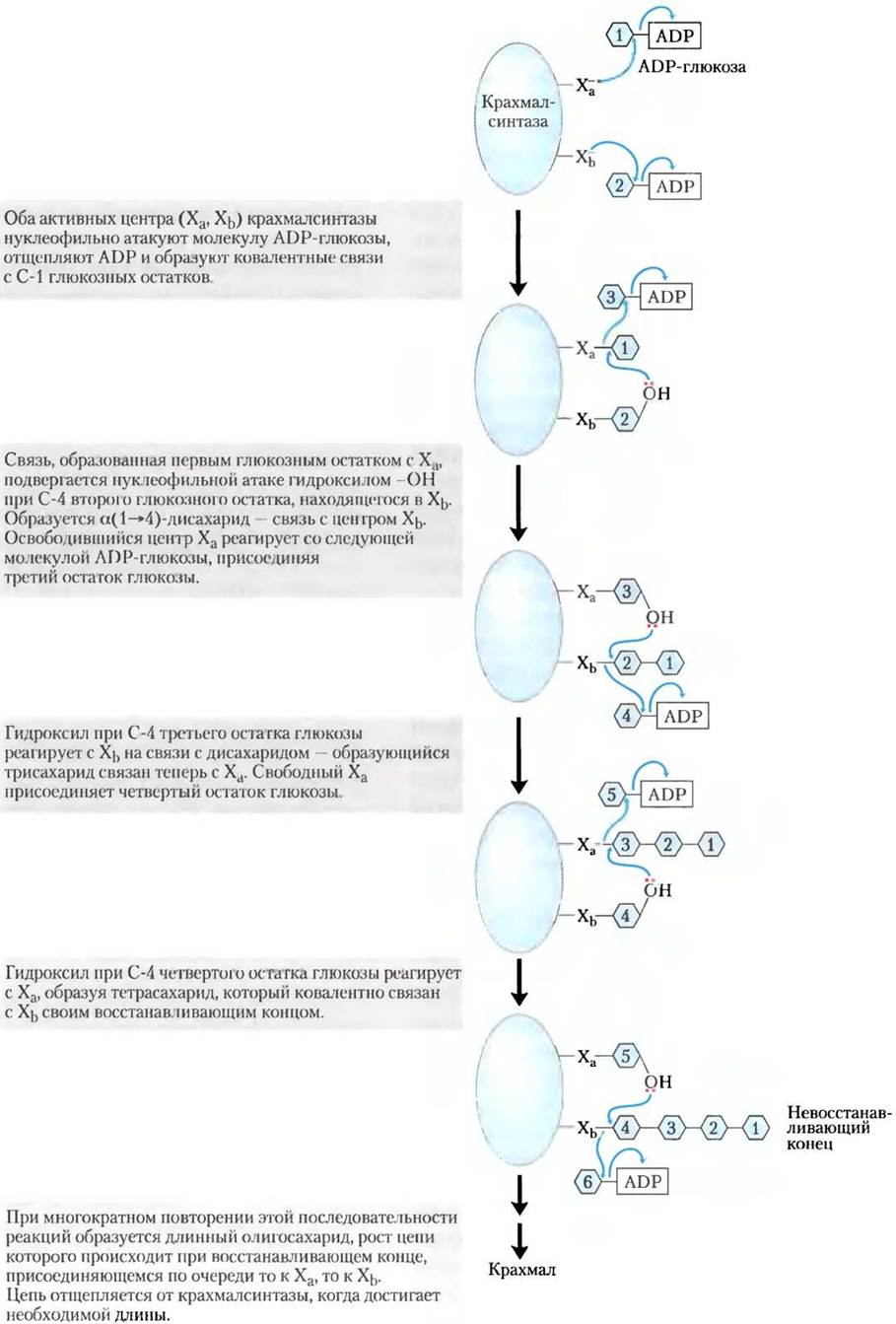
Механизм вовлечения глюкозы в синтез крахмала похож на аналогичный механизм при синтезе гликогена. В результате конденсации глюкозо-1-фосфата с АТР в реакции, равновесие в которой в присутствии неорганической пирофосфатазы сильно сдвинута вправо (с. 38), образуется активированный сахаронуклеотид, в данном случае ADP-глюкоза. Затем крахмалсинтаза переносит остаток глюкозы с ADP-глюкозы на уже существующую молекулу крахмала. Хотя ранее считалось, что глюкоза присоединяется к невосстанавливающему концу крахмала, как и в синтезе гликогена (см. рис. 15-30), сейчас появились данные о том, что крахмалсинтаза имеет два эквивалентных активных центра, которые по очереди присоединяют гликозильный остаток к восстанавливающему концу крахмала. Этот конец остается ковалентно связанным с ферментом, сначала в одном активном центре, потом в другом (рис. 20-24). Присоединение гликозильно- го остатка к одному активному центру эффективно активирует восстанавливающий конец растущей цепи крахмала. За этим следует нуклеофильное отщепление от фермента путем атаки гидроксила при С-4 атоме остатка глюкозы, связанного с другим активным центром, после чего образуется α (1 —> 4)-связь, характерная для крахмала.
Рис. 20-24. Синтез крахмала. Согласно представленной модели, синтез крахмала происходит с участием двух активных центров и АDР- глюкозы в качестве донора гликозила. Два идентичных активных центра в крахмалсинтазе по очереди присоединяют единицы глюкозы к растущей цепи по восстанавливающему концу.
Амилоза крахмала не разветвлена, но амилопектин имеет многочисленные α (1 —> 6)-связанные ветви (см. рис. 7-14). Хлоропласты содержат разветвляющий фермент, похожий на гликоген- разветвляющий фермент (см. рис. 15-31), который вставляет α (1 —> 6)-ветви амилопектина. С учетом гидролиза пирофосфата PPi, выделяющегося в процессе синтеза ADP-глюкозы неорганической пирофосфатазой, реакция образования крахмала из глюкозо-1-фосфата можно записать следующим образом:
Крахмалn + глюкозо-1-фосфат + АТР —> крахмалn+1 + ADP + 2Рi
∆G'° = -50 кДж/моль
Синтез крахмала регулируется скоростью образования ADP-глюкозы, как будет показано ниже.
Большинство бактерий запасают углеводы в виде гликогена (похож на крахмал, только сильно разветвленный), который они синтезируют в реакции, аналогичной гликогенсинтазной реакции у животных. Бактерии, как и пластиды растений, используют ADP-глюкозу как активированную форму глюкозы, в то время как животные клетки используют UDP-глюкозу. И снова сходство между метаболизмом пластид и бактерий подтверждает эндосимбиотическую гипотезу происхождения органелл (см. с. 59, т. 1).
UDР-глюкоза является субстратом для синтеза сахарозы в цитозоле клеток листьев
Основное количество триозофосфатов, полученных при фиксации СO2 растениями, превращается в сахарозу (рис. 20-25) или крахмал. В процессе эволюции сахароза могла быть выбрана в качестве транспортера углерода из-за наличия в ее молекуле необычной связи между аномерным атомом С-1 глюкозы и аномерным атомом С-2 фруктозы. Эта связь не гидролизуется амилазами или другими обычными разрезающими углеводы ферментами, а недоступность аномерных атомов углерода препятствует неферментативным реакциям сахарозы с аминокислотами и белками (в которые может вступать глюкоза).
Рис. 20-25. Синтез сахарозы. Сахароза синтезируется из UDР-глюкозы и фруктозо-6-фосфата, которые образуются из триозофосфатов в цитозоле растительной клетки по путям, изображенным на рис. 15-29 и 20-9. У большинства видов растений сахарозо-6-фосфатсинтаза аллостерически регулируется глюкозо-6-фосфатом и фосфатом Pi

Синтез сахарозы происходит в цитозоле и начинается с транспорта дигидроксиацетонфосфата и глицеральдегид-3-фосфата из хлоропластов. После конденсации двух триозофосфатов с образованием фруктозо-1,6-бисфосфата (катализируется альдолазой) происходит гидролиз фруктозо-1,6- бисфосфата с образованием фруктозо-6-фосфата. Затем сахарозо-6-фосфатсинтаза катализирует реакцию фруктозо-6-фосфата с UDP-глюкозой с образованием сахарозо-6-фосфата (рис. 20-25). В конце концов сахарозо-6-фосфатфосфатаза отщепляет фосфатную группу, в результате сахароза становится доступной для экспорта в другие ткани. Реакция, катализируемая сахарозо-6- фосфатсинтазой, — низкоэнергетический процесс (∆G′° = -5,7 кДж/моль), но гидролиз сахарозо-6- фосфата до сахарозы достаточно экзотермичен (∆G′° = -16,5 кДж/моль), что делает весь синтез сахарозы необратимым. Синтез сахарозы регулируется и хорошо согласован с синтезом крахмала, как мы увидим в дальнейшем.
Отличие между клетками растений и животных всего одно, и оно заключается в отсутствии в цитозоле клеток растений фермента неорганической пирофосфатазы, которая катализирует реакцию:
PPi + H2O —> 2Pi ∆G′° = -19,2 кДж/моль
Для многих реакций биосинтеза, в которых высвобождается пирофосфат РРi, пирофосфатазная активность делает эту реакцию энергетически более выгодной, что обеспечивает ее необратимость. У растений этот фермент присутствует в пластидах, но отсутствует в цитозоле. В результате в цитозоле клеток листьев содержится значительная концентрация пирофосфата (-0,3 мМ) для того, чтобы сделать реакции, такие как катализируемая UDР-глюкозопирофосфорилазой (рис. 15-29), легко обратимыми. Вспомним из гл. 14 (с. 73), что у растений цитозольный изозим фосфофруктокиназы использует в качестве донора фосфата PPi, а не АТР.
Превращение триозофосфатов в сахарозу и крахмал жестко регулируется
Как мы уже отмечали, триозофосфаты, полученные в цикле Кальвина при ярком дневном свете, могут быть временно запасены в хлоропластах в виде крахмала или превращаться в сахарозу для экспорта в нефотосинтезирующие части растения, или и то, и другое. Баланс между этими двумя процессами строго регулируется, а также координируется со скоростью фиксации углерода. Пять из шести молекул триозофосфатов, образованных в цикле Кальвина, должны быть превращены в рибулозо-1,5-бисфосфат (рис. 20-14); если же для синтеза сахарозы или крахмала из цикла выведется больше, чем одна из шести молекул триозофосфатов, цикл замедлится или остановится. Однако недостаточное превращение триозофосфатов в крахмал или сахарозу происходит, когда хлоропласт, дефицитный по Рi, теряет также фосфаты, которые необходимы для цикла Кальвина.
Скорость включения триозофосфатов в сахарозу регулируется активностью фруктозо-1,6- бисфосфатазой (ФБФаза-1) и ферментом, который эффективно осуществляет противоположное действие — пирофосфат-зависимой фосфофруктокиназой (ПФ-ФФК-1; с. 73). Эти ферменты ключевые для определения судьбы триозофосфатов. получающихся в фотосинтезе. Оба фермента регулируются фруктозо-2,6-бисфосфатом (Ф2,6БФ), который ингибирует ФБФазу-1 и стимулирует ПФ-ФФК-1. У сосудистых растений концентрация Ф2,6БФ обратно пропорциональна скорости фотосинтеза (рис. 20-26). Фосфофруктокиназа-2 (ФФК-2), ответственная за синтез Ф2,6БФ, ингибируется дигидроксиацетонфосфатом или 3-фосфоглицератом и стимулируется фруктозо-6-фосфатом и Pi. При активном фотосинтезе концентрация дигидроксиацетонфосфата увеличивается, а концентрация Pi уменьшается, в результате ФФК-2 ингибируется и концентрация Ф2,6БФ снижается. Это обеспечивает увеличение скорости вовлечения триозофосфатов в процесс образования фруктозо-6-фосфата и в синтез сахарозы. С такой системой регуляции синтез сахарозы происходит, когда уровень триозофосфатов, получающихся в цикле Кальвина, значительно превышает уровень, необходимый для поддержания работы цикла.
Синтез сахарозы тоже регулируется уровнем сахарозо-6-фосфатсинтазы, которая аллостерически активируется глюкозо-6-фосфатом и ингибируется фосфатом Pi. Этот фермент также регулируется фосфорилированием и дефосфорилированием; протеинкиназа фосфорилирует его по специфическому остатку Ser, что делает сахарозо-6-фосфатсинтазу менее активной, а фосфатаза снимает это ингибирование удалением фосфата (рис. 20-27). Ингибирование киназы глюкозоб-фосфатом, а фосфатазы фосфатом усиливает влияние двух этих соединений на синтез сахарозы. При излишке гексозофосфатов сахарозо-6- фосфатсинтаза активируется глюкозо-6-фосфатом; когда же повышается уровень фосфата Рi (а значит, уменьшается скорость фотосинтеза), синтез сахарозы замедляется. В процессе активного фотосинтеза триозофосфаты превращаются в фруктозо-6-фосфат, который под действием фермента фосфогексозоизомеразы в обратимой реакции быстро превращается в глюкозо-6-фосфат. Равновесие сильно сдвинуто в сторону глюкозо-6-фосфата, поэтому, как только накапливается фруктозо-6-фосфат, уровень глюкозо-6-фосфата увеличивается, что стимулирует синтез сахарозы.
Рис. 20-26. Фруктозо-2,6-бисфосфат — регулятор синтеза сахарозы. Концентрация аллостерического регулятора фруктозо-2,6-бисфосфата в растительной клетке регулируется продуктами фотосинтетической ассимиляции углерода и Рi. Дигидроксиацетонфосфат и 3-фосфоглицерат, образующиеся при ассимиляции СО2, ингибируют фосфофруктокиназу-2 (ФФК-2), фермент, который синтезирует регулятор; Pi стимулирует ФФК-2. Поэтому концентрация регулятора обратно пропорциональна скорости фотосинтеза. В темноте концентрация фруктозо-2,6-бисфосфата возрастает, что стимулирует фермент гликолиза РРi-зависимую фосфофруктокиназу-1 (ПФ-ФФК-1), в то время как фермент глюконеогенеза фруктозо-1,6-бисфосфатаза (ФБФаза-1) ингибируется. Когда активно происходит фотосинтез (на свету), концентрация регулятора падает, и стимулируется синтез фруктозо-6-фосфата и сахарозы.
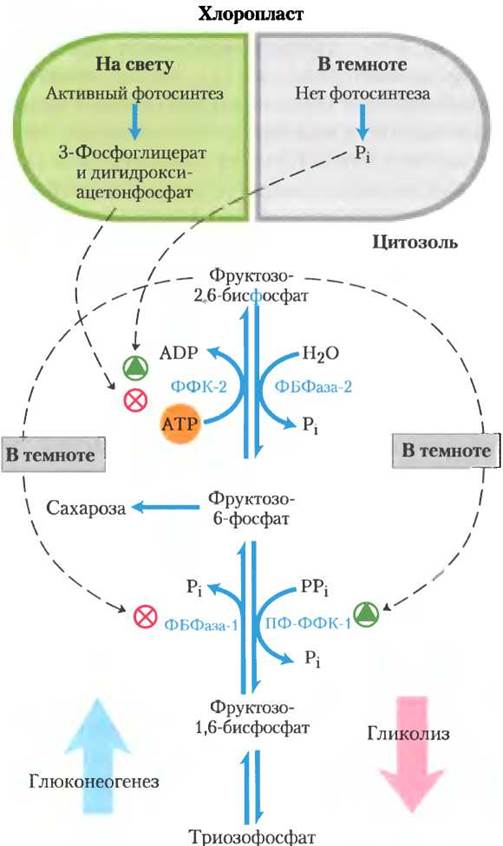
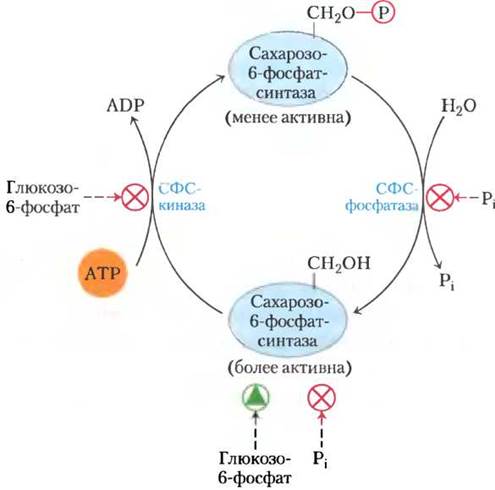
Рис. 20-27. Регуляция сахарозофосфатсинтазы фосфорилированием. Протеинкиназа (СФС-киназа), специфичная для сахарозофосфатсинтазы (СФС), фосфорилирует остаток Ser в СФС, инактивируя ее; а специфичная фосфатаза (СФС-фосфатаза) снимает это ингибирование. Киназа аллостерически ингибируется глюкозо-6-фосфатом, который также аллостерически активирует СФС. Фосфатаза ингибируется Pi, непосредственно ингибирующий также СФС. Таким образом, когда в результате активного фотосинтеза концентрация глкозо-6-фосфата высокая, СФС активируется и синтезирует сахарозофосфат. При высокой концентрации Pi,которая повышается при низкой скорости превращения ADP в АТР в ходе фотосинтеза, синтез сахарозофосфата ингибируется.
Ключевой регуляторный фермент в синтезе крахмала — это ADP-глюкозопирофосфорилаза (рис. 20-28); она активируется 3-фосфоглицератом (накапливается при активном фотосинтезе) и ингибируется фосфатом Pi(который накапливается, когда светозависимая конденсация фосфата с ADP ослабляется). Когда синтез сахарозы замедляется, накапливается 3-фосфоглицерат, получающийся при фиксации СO2; он активирует фермент и стимулирует синтез крахмала.
Рис. 20-28. Регуляция АРР-глюкозофосфорилазы 3-фос- фоглицератом и Рi. Этот фермент синтезирует предшественник крахмала и является лимитирующим при его синтезе. Он аллостерически стимулируется 3-фосфоглицератом (3-ФГК) и ингибируется Рi; отношение [3-ФГК]/[Pi], которое возрастает с увеличением скорости фотосинтеза, оказывается ключевым для этой стадии синтеза крахмала.

Краткое содержание раздела 20.3 Биосинтез крахмала и сахарозы
■ Крахмалсинтаза в хлоропластах и амилопластах катализирует присоединение по одному остатку глюкозы из ADP-глюкозы к восстанавливающему концу растущей молекулы на двух активных центрах. За ветвление амилопектина отвечает второй фермент.
■ Сахароза синтезируется в цитозоле из UDP- глюкозы и фруктозо-1-фосфата в две стадии.
■ Распределение триозофосфатов между синтезом сахарозы и синтезом крахмала регулируется фруктозо-2,6-бисфосфатом (Ф2,6БФ) — аллостерическим эффектором фермента, который определяет уровень фруктозо-6-фосфата. Концентрация Ф2,6БФ обратно пропорциональна скорости фотосинтеза, и Ф2,6БФ ингибирует синтез фруктозо-6-фосфата, предшественника сахарозы.