ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
Не помню, как возникло «разделение труда». Возможно, мы тянули жребий. Во всяком случае Дэвид Шемин «вытянул» метаболизм аминокислот, что привело к его классической работе по биосинтезу гема. Дэвиду Ритенбур- гу выпало продолжать удовлетворение своего интереса к синтезу и обмену белков, а липиды достались на мою долю.
Конрад Блох, о том, как судьба привела его к проблемам липидного метаболизма после смерти его руководителя Рудольфа Шёнхеймера; статья в Annual Review ofBiochemistry, 1987
21. БИОСИНТЕЗ ЛИПИДОВ
Липиды играют в клетке множество ролей, и о некоторых из этих ролей (функций) стало известно совсем недавно. У большинства организмов липиды — главная форма запасания энергии, а также преобладающий компонент клеточных мембран. Специализированные липиды служат пигментами (ретиналь, каротин), кофакторами (витамин К), детергентами (желчные соли), транспортерами (долихолы), гормонами (производные витамина D, половые гормоны), межклеточными и внутриклеточными мессенджерами (эйкозаноиды, производные фосфатидилинозита) и якорями для мембранных белков (ковалентно связанные жирные кислоты, пренильные группы и фосфатидилинозит). Способность синтезировать множество липидов жизненно необходима всем организмам. В этой главе описаны пути биосинтеза некоторых из наиболее распространенных клеточных липидов, показаны алгоритмы, используемые для сборки этих нерастворимых в воде продуктов из водорастворимых предшественников, таких как ацетат. Подобно другим биосинтетическим путям, эти последовательности реакций происходят эндергонически и по своей сути они восстановительные. Они используют АТР в качестве источника метаболической энергии и восстановленные переносчики электрона (обычно NADPH) в качестве восстановителей.
Сначала мы опишем биосинтез жирных кислот (первичных компонентов триацилглицеринов) и фосфолипидов, затем исследуем сборку (с участием жирных кислот) триацилглицеринов и более простых мембранных фосфолипидов. Наконец, мы рассмотрим синтез холестерина, компонента некоторых мембран и предшественника стероидов, таких как желчные кислоты, половые гормоны и гормоны надпочечников.
21.1. Биосинтез жирных кислот и эйкозаноидов
После открытия, что окисление жирных кислот происходит путем последовательного окислительного отщепления двухуглеродных (ацетил- СоА) фрагментов (см. рис. 17-8), биохимики предположили, что биосинтез жирных кислот, вероятно, происходит просто в обратных реакциях тех же самых ферментативных стадий. Однако, как удалось обнаружить, биосинтез и распад жирных кислот протекают по различным путям, катализируются разными наборами ферментов и идут в разных частях клетки. Более того, биосинтез требует участия трехуглеродного промежуточного соединения малонил-СоА, который не задействован в распаде жирных кислот.
Прежде всего мы сосредоточимся на реакциях синтеза жирных кислот, затем переключимся на регуляцию этого метаболического пути и на биосинтез длинноцепочечных жирных кислот, ненасыщенных жирных кислот и их производных — эйкозаноидов.
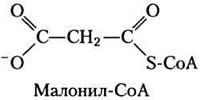
Малонил-СоА образуется из ацетил-СоА и гидрокарбоната
Образование малонил-СоА из ацетил-СоА — необратимый процесс, который катализируется ацетил-СоА-карбоксилазой. Бактериальный фермент состоит из трех полипептидных субъединиц (рис. 21-1); в животных клетках ферментативную активность обеспечивает один полифункциональный полипептид. Растительные клетки содержат оба типа ацетил- СоА-карбоксилазы. Фермент с биотином как простетической группой всегда ковалентно связан амидной связью с ε-аминогруппой остатка Lys одной из трех полипептидных субъединиц или одного из доменов полифункционального фермента. Двухстадийная реакция, катализируемая этим ферментом, очень похожа на другие био тинзависимые реакции карбоксилирования, например, катализируемые пируваткарбоксилазой (рис. 16-16) и пропионил-СоА-карбоксилазой (рис. 17-11).
Рис. 21-1. Реакция ацетил-СоА-карбоксилазы. Ацетил- СоА-карбоксилаза имеет три функциональные области: биотин-переносящий белок (серый); биотинкарбоксилазу, которая активирует СO2, присоединяя его к азоту в биотиновом кольце путем АТР-зависимой реакции (см. рис. 16-16), и транскарбоксилазу, которая переносит активированный СO2(выделен зеленым) с биотина на ацетил-СоА, образуя малонил-СоА. Длинная подвижная биотиновая «рука» переносит активированный СO2 от биотинкарбоксилазы на активный центр транскарбоксилазы. Активный фермент в каждой стадии выделен голубым.
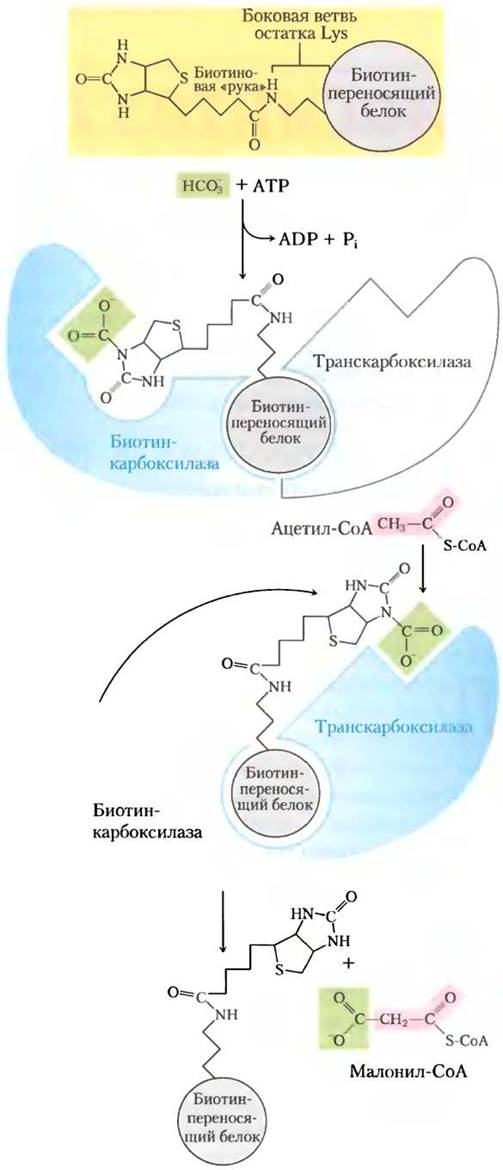
Карбоксильная группа, получающаяся из гидрокарбоната (НСО-3), первой переносится на биотин в АТР-зависимой реакции. Биоти- нильная группа служит временным переносчиком СO2, во второй стадии передавая его на ацетил-СоА с образованием малонил-СоА.
Синтез жирных кислот происходит в повторяющихся реакционных циклах
У всех организмов длинные углеродные цепи жирных кислот собираются в ходе четырехстадийной последовательности реакций (рис. 21-2), которая катализируется ферментативной системой, называемой синтазой жирных кислот (СЖК).
Рис. 21-2. Присоединение двух атомов углерода к ацилу жирной кислоты: четыре стадии. Любой ацил (малонил, ацетил или более длинный ацил) активируются путем присоединения к синтазе жирных кислот тиоэфирной связью. (1) Ацильная цепь удлиняется на два атома углерода за счет конденсации активированного ацила (ацетил из ацетил-СоА начинает ряд ацилов) и двух атомов углерода из малонил-СоА, при этом СO2 из малонильной группы удаляется. Чтобы проиллюстрировать роль декарбоксилирования в облегчении конденсации, приведен механизм первой стадии этой реакции. β-Кетопродукт этой конденсации затем восстанавливается еще в трех стадиях (почти идентичных реакциям β-окисления, но в обратной последовательности): (2) β-кетогруппа восстанавливается до спиртовой, (3) удаление Н2O создает двойную связь и (4) двойная связь восстанавливается с образованием соответствующего насыщенного ацила жирной кислоты.
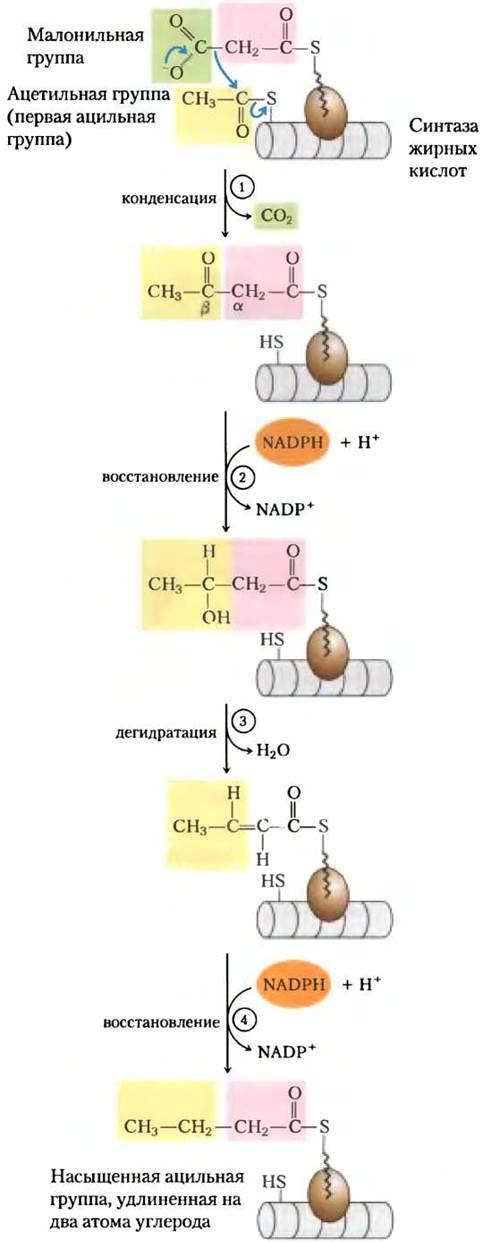
Насыщенная ацильная группа, получающаяся в этих реакциях, становится субстратом для последующей конденсации с активированной малонильной группой. При каждом обороте цикла длина жирнокислотной цепи увеличивается на два углерода.
В восстановительной анаболической последовательности реакций и переносящий электроны кофактор, и активирующие группы отличаются от участвующих в окислительном катаболическом процессе. Вспомним, что в β-окислении акцепторами электрона служат NAD+ и FAD, а активирующей группой — тиольная (-SH) группа кофермента А (см. рис. 17-8). В противоположность этому восстанавливающий агент в последовательности реакций биосинтеза — это NАDРН, а активирующими группами являются, как будет описано в следующем разделе, две связанные с ферментом группы -SН.
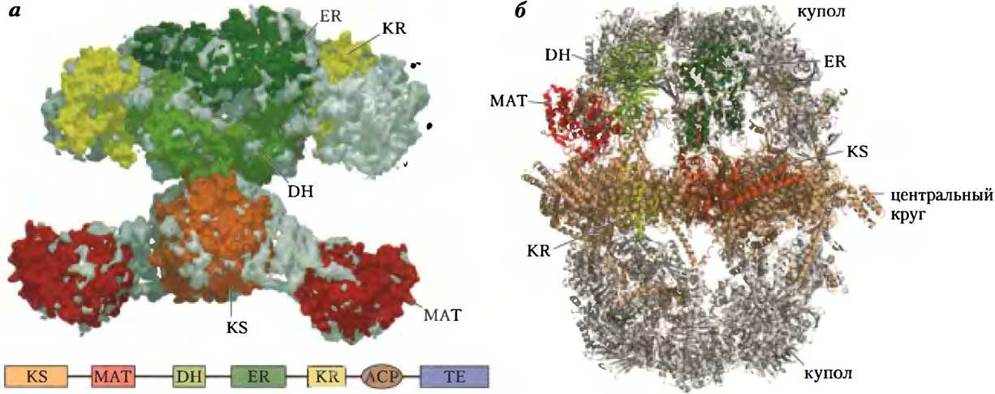
Существуют два основных типа синтазы жирных кислот (СЖК): синтаза типа I обнаружена у позвоночных и грибов, а синтаза типа II — у растений и бактерий. Фермент позвоночных состоит из одной полифункциональной полипептидной цепи (Мr = 240 000). Прототип такого фермента — СЖК млекопитающих. Семь активных центров фермента, предназначенные для осуществления разных реакций, расположены в отдельных доменах (рис. 21-3, а). Полипептид из клеток млекопитающих функционирует в виде гомодимера (Мr = 480 000). По-видимому, субъединицы фермента работают независимо друг от друга. Если в результате мутации инактивируются все активные центры на одной из субъединиц, синтез жирных кислот хотя и ослабевает, но совсем незначительно. У пекарских дрожжей и грибов других видов обнаружена другая синтаза типа I, состоящая из двух полифункциональных полипептидных цепей. Этот ферментативный комплекс отличается от фермента позвоночных (рис. 21-3, б): из семи активных центров три располагаются на α-субъединице, а четыре других — на β-субъединице.
Рис. 21-3. Структура синтазы жирных кислот типа I. Приведены структуры СЖК, полученные с низким разрешением, из клеток (а) млекопитающих (свинья; по PDB ID 2CF2) и (б) грибов (по PDB ID 2UV9, 2UVA, 2UVB и 2UVC). а — в ферментной системе млекопитающих все активности находятся в разных доменах одной большой полипептидной цепи. Присутствуют следующие ферментативные активности: 3-кетоацил-[АСР]-синтаза (KS), [АСР] -S-малонил/ацетилтрансфераза (МАТ), 3-гидроксиацил-[АСР]-дегидратаза (DH), еноил-[АСР]-редуктаза (ER) и 3-кетоацил-[АСР]-редуктаза (KR), где АСР — ацилпереносящий белок. Под структурой показано расположение доменов в этом полипептиде. Седьмой домен — это тиоэстераза (ТЕ), отщепляющая пальмитат от АСР при завершении синтеза. Домены АСР и ТЕ при кристаллизации разрушаются, поэтому они здесь не показаны. б — в структуре синтазы жирных кислот типа I из гриба Thermomyces lanuginosus присутствуют те же активные центры, но они распределены между двумя полифункциональными полипептидными цепями, действующими совместно. В 12-доменном ферментном комплексе обнаружены по шесть копий с каждого полипептида; шесть α-субъединиц, содержащих АСР и активности KS и KR располагаются в центре комплекса по кругу: три субъединицы с одной стороной, три — с другой. Вверху и внизу этот круг венчают «купола», построенные из тримеров β-субъединиц с активностями ER и DH. Домены субъединиц каждого типа окрашены в те же цвета, что и соответствующие активные центры в ферментативной системе млекопитающих на рисунке (а).
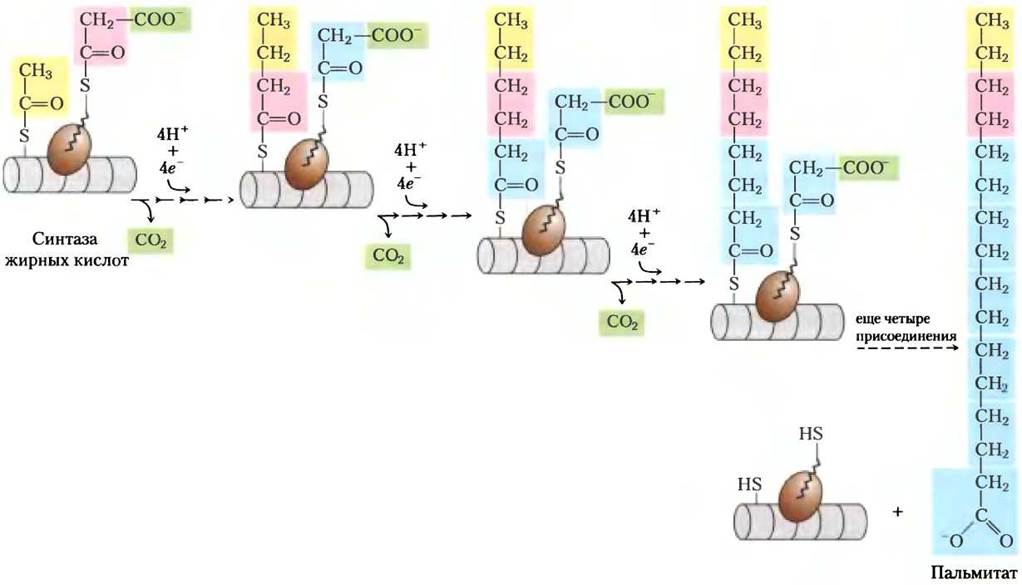
При синтезе жирных кислот с помощью СЖК типа I происходит образование единственного продукта без высвобождения промежуточных продуктов. Когда длина цепи достигает 16 атомов углерода, продукт (пальмитат, 16:0, см. табл. 10-1) покидает цикл. В молекуле пальмитата атомы С-16 и С-15 происходят из метильного и карбоксильного углеродов ацетил- СоА, который участвует в самой первой стадии (рис. 21-4); остальные атомы углерода приходят от малонил-СоА.
У растений и бактерий СЖК типа II действует по-другому: каждую стадию синтеза катализирует отдельный и свободно диффундирующий фермент. Промежуточные продукты биосинтеза также могут диффундировать и участвовать в других путях биосинтеза (например, в синтезе липоевой кислоты). В отличие от СЖК типа I, СЖК типа II генерирует несколько продуктов, включая насыщенные жирные кислоты с разной длиной цепи, а также ненасыщенные разветвленные жирные кислоты и гидроксикислоты. Синтаза жирных кислот типа II обнаружена также в митохондриях позвоночных. Ниже мы остановимся подробнее на СЖК типа I из клеток млекопитающих.
Рис. 21-4. Полный синтез пальмитата. Ацильная цепь увеличивается путем присоединения двухуглеродных единиц, которые поставляются активированным малонатом, при этом на каждой стадии происходит высвобождение СО2. Исходная ацетильная группа выделена желтым, С-1 и С-2 из малоната выделены розовым, а атом углерода, высвобождающийся в виде СО2, — зеленым. Каждый раз при присоединении двух атомов углерода происходит восстановление и удлинение цепи насыщенной жирной кислоты: сначала в ней четыре углерода, затем шесть, восемь и т. д. атомов углерода. Конечный продукт — пальмитат.
Синтаза жирных кислот млекопитающих содержит несколько активных центров
Домены синтазы жирных кислот типа I из клеток млекопитающих действуют как отдельные, но связанные между собой ферменты. Активные центры находятся в разных доменах полипептидной цепи фермента.
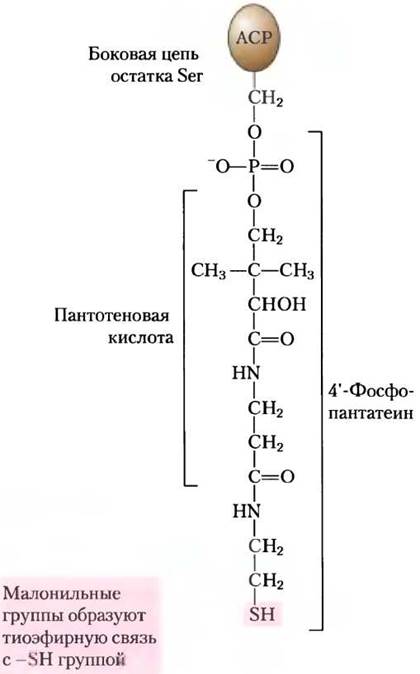
Рис. 21-5. Ацилпереносящий белок (АСР). Простетической группой является 4'-фосфопантатеин, который ковалентно связывается с гидроксильной группой остатка Ser в АСР. Фосфопантотеин содержит пантотеновую кислоту (витамин В5), входящую также в состав молекулы кофермента А. При синтезе жирных кислот малонильные группы вводятся по -SH-группе фосфопантатеина.
Промежуточные продукты синтеза ацилов жирных кислот ковалентно связаны тиоэфирной связью с одной или двумя тиольными группами синтазного комплекса вплоть до финальной стадии этой ферментативной реакции. Присоединение происходит по -SH-группе остатка Cys в одном из семи доменов синтазы (например, в β-кетоацил- АСР-синтазе; KS) и по -SH-группе в АСР, другого домена этого же полипептида. Гидролиз тиоэфиров экзергоничен; высвобождающаяся энергия делает термодинамически выгодными две стадии синтеза жирных кислот (1) и (5) на рис. 21-6).
Ацилпереносящий белок (АСР) — это челнок, связывающий между собой отдельные участки ферментного комплекса. АСР из клеток Escherichia coli — это небольшой белок (Мr= 8860), содержащий простетическую группу 4'-фосфопантатеин (рис. 21-5; сравните с пантотеновой кислотой и β-меркаптоэтиламиновым фрагментом кофермента А на рис. 8-38, т. 1). Считается, что 4'-фосфопантатеиновая простетиче- ская группа АСР служит гибким манипулятором, присоединяющим растущую жирноацильную цепь к поверхности комплекса синтазы жирных кислот при переносе промежуточных продуктов реакции от активного центра одного фермента к следующему. АСР из клеток млекопитающих выполняет похожую функцию и содержит ту же простетическую группу. Однако, как мы видели, он является доменом гораздо более крупного полифункционального полипептида.
Синтаза жирных кислот присоединяет ацетильную и малонильную группы
Прежде чем могут начаться реакции конденсации, которые достраивают жирнокислотную цепь, на двух тиольных группах в ферментном комплексе должны быть созданы заряды с помощью ионизованных ацильных групп (рис. 21-6, вверху). В первую очередь в реакции, катализируемой малонил/ ацетил-СоА-АСР-трансферазой (этот фермент обозначен как МАТ на рис. 21-6 и образует отдельный домен полифункционального полипептида), ацетильная группа ацетил-СоА переносится на АСР. Затем ацетильная группа переносится на -SH-группу цистеина β-кетоацил-АСР-синтазы (KS). Вторая реакция — перенос малонильной группы от малонил-СоА на -SH-группу АСР — также катализируется малонил/ацетил-СоА- АСР-трансферазой. В ионизованном синтазном комплексе ацетильная и малонильная группы находятся очень близко друг к другу и, чтобы произошло удлинение цепи, они должны быть просто активированы. Первые четыре стадии этого процесса мы сейчас рассмотрим довольно подробно; номера стадий соответствуют номерам на рис. 21-6.
Рис. 21-6. Последовательность реакций при синтезе жирных кислот. Вверху — комплекс синтазы жирных кислот (СЖК) типа I из клеток млекопитающих; каталитические домены окрашены в те же цвета, что и на рис. 21-3. Каждый домен этого крупного полипептида проявляет одну из шести ферментативных активностей комплекса, имеющего форму компактно упакованной буквы S. Хотя ацилпереносящий белок (АСР) на рис. 21-3 не показан, однако известно, что он связан с доменом KS. Фосфопантетеиновое плечо АСР заканчивается -SH-группой. Начиная со второй схемы, цветом выделен тот фермент, который реагирует на следующей стадии. Как и на рис. 21-4, первый ацетил выделен желтым, атомы С-1 и С-2 малоната — розовым, а атом углерода, который уходит в виде СO2, — зеленым. Стадии (1)-(4) описаны в тексте.
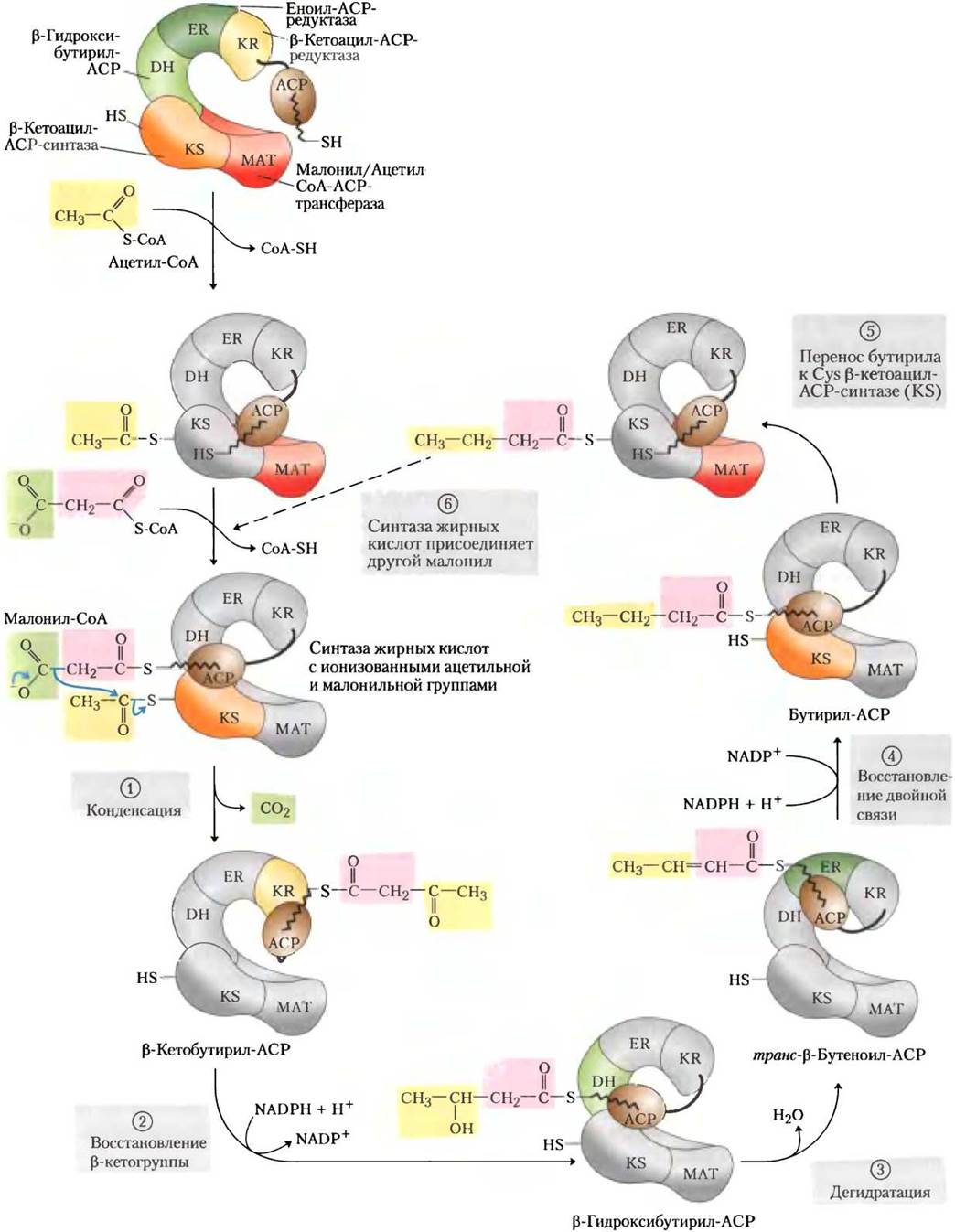
Стадия (1). Конденсация. При образовании жирнокислотной цепи первой реакций формально является конденсация Кляйзена с участием активированных ацетильной и малонильной групп, в результате чего получается ацетоацетил-АСР, где ацетоацетильная группа связана с АСР через -SH-группу фосфопантатеина; одновременно высвобождается молекула СO2. В этой реакции, катализируемой β-кетоацил-АСР-синтазой (KS), ацетил переносится от -SH-группы на цистеине в молекуле фермента к малонилу на -SH в АСР и становится двухуглеродной единицей новой аце- тоацетильной группы с метилом на конце.
Углеродный атом СO2, образующегося в этой реакции, — это тот самый атом углерода, который был первоначально введен в малонил- СоА из НСO3- путем карбоксилазной реакции (рис. 21-1). Таким образом, при биосинтезе жирных кислот СO2 связан ковалентно и только на время; он удаляется по мере добавления каждой двухуглеродной единицы.
Почему же клетки, которые «трудились», чтобы присоединить СO2 и создать малонильную группу из ацетильной, теперь теряют СO2, образуя ацетоацетат? Вспомним, что при β-окислении жирных кислот (см. рис. 17-8) расщепление связи между двумя ацилами (отщепление ацетила от ацильной цепи) очень экзергонично, так что простая конденсация двух ацилов (например, двух молекул ацетил- СоА) — в высшей степени эндергоничная реакция. Именно использование активированного малонила, а не ацетила делает реакции конденсации термодинамически выгодными. Метиленовый углерод (С-2) малонильной группы, находящийся между карбонильным и карбоксильным атомами углерода, как в сэндвиче, удобен в качестве хорошего нуклеофила. На стадии конденсации (стадия (1)) декарбоксилирование малонильной группы облегчает нуклеофильную атаку метиленового углерода тиоэфира, связывающего ацетил с β-кетоацил- АСР-синтазой, перемещая -SH-группу фермента. Сопряжение конденсации с декарбоксилированием малонила делает весь процесс в высокой степени экзергоничным. Похожие последовательные реакции карбоксилирования- декарбоксилирования облегчают образование фосфоенолпирувата из пирувата при глюконеогенезе (см. рис. 14-17).
Используя активированные малонилы в синтезе жирных кислот и активированный ацетат в их деградации, клетка делает оба процесса энергетически благоприятными, хотя по результату они противоположны. Дополнительную энергию, необходимую для того, чтобы сделать синтез жирных кислот энергетически выгодным, предоставляет АТР, который участвует в синтезе малонил-СоА из ацетил-СоА и НСО3- (рис. 21-1).
Стадия (2). Восстановление карбонильной группы. Карбонильная группа на С-3 ацетоацетила- АСР, образованного на стадии конденсации, восстанавливается до D-p-гидроксибутирил- АСР. Эта реакция катализируется β-кетоацил- АСР-редуктазой(KR), а донором электронов служит NADPH. Заметим, что геометрия D-β- гидроксибутирильной группы не такая, как у L-β- гидроксиацильного интермедиата при окислении жирных кислот (см. рис. 17-8).
Стадия (3). Дегидратация. От С-2 и С-3 в D-β- гидроксибутирил-АСР удаляется молекула воды с образованием двойной связи в продукте реакции транс-∆2-бутеноил-АСР.Эту дегидратацию катализирует фермент β-гидроксиацил-АСР- дегидратаза (HD).
Стадия (4). Восстановление двойной связи. Наконец, двойная связь транс-∆2-бутеноил-АСР восстанавливается — под действием еноил-АСР- редуктазы(ER) образуется бутирил-АСР; причем донором электрона вновь служит NADPH.
Реакции, катализируемые синтазой жирных кислот, повторяются до образования пальмитата
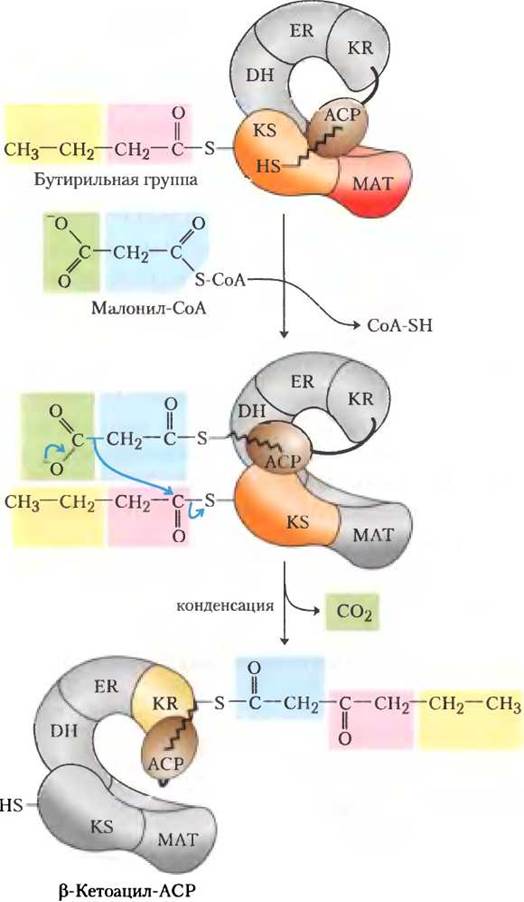
Образование АСР, содержащего насыщенный жирный ацил, завершает один проход через комплекс синтазы жирных кислот. Бутирил переносится теперь от -SHфосфопантатеина в АСР на -SH-группу цистеина в р-кетоацил-АСР- синтазе, которая первоначально несла ацетил (рис. 21-6). Чтобы начать следующий цикл из четырех реакций, удлиняющий цепь еще на два атома углерода, к незанятой в этот момент -SH- группе фосфопантатеина в АСР присоединяется другой малонил (рис. 21-7). Происходит конденсация — бутирил, как ацетил в первом цикле, связывает два атома углерода малонил-АСР с одновременным высвобождением СO2. Продуктом этой конденсации является шестиуглеродный ацил, ковалентно связанная с -SH-группой фосфопантатеина. В следующих трех реакциях синтазного цикла p-кетогруппа восстанавливается и, как и в первой стадии, образуется шестиуглеродный продукт.
Рис. 21-7. Начало второй стадии цикла синтеза жирных кислот. Бутирил находится на -SН-группе Суs. Приходящий малонил присоединяется сначала к фосфопантатеиновой -SН-группе. Затем на стадии конденсации вся бутирильная группа на Суs-SН заменяется на карбоксильную группу малонильного остатка, часть которого уходит в виде СO2(зеленый цвет). Эта стадия аналогична стадии (1) на рис. 21-6. Продукт, шестиуглеродная β-кетоацильная группа, содержит теперь четыре углерод из малонил-СоА и два углерода из ацетил-СоА, который начинал реакцию. р-Кетоацильная группа затем проходит через стадии (2)-(4) (рис. 21-6).
Семь циклов конденсации-восстановления производят 16-углеродную насыщенную пальмитоильную группу, пока еще связанную с АСР. По недостаточно пока понятной причине элонгация цепи синтазным комплексом в этот момент прекращается, и свободный пальмитат под действием гидролитического компонента комплекса (тиоэстеразы; ТЕ) отщепляется от АСР.
Можно считать, что полная реакция синтеза пальмитата из ацетил-СоА состоит из двух стадий. Первая стадия — это образование семи молекул малонил-СоА:
7 Ацетил-СоА + 7 СO2 + 7 АТР —> 7 малонил-СоА + 7 ADP + 7 Рi (21-1)
Затем происходят семь циклов конденсации- восстановления:
Ацетил-Со А + 7 малонил-СоА + 14 NАDРН + 14 Н+ —> пальмитат + 7 СO2 + 8 СоА + 14 NАDР+ + 6 Н2O (21-2)
Обратите внимание, в итоге образуется шесть молекул воды, поскольку одна молекула расходуется для гидролиза тиоэфирной связи между пальмитатом (продуктом реакции) и ферментом. Суммарная реакция (уравнения 21-1 и 21-2):
8 Ацетил-СоА + 7 АТР + 14 NADPH + 14 Н+ —> пальмитат + 8 СоА + 7 ADP + 7Pi + 14 NADP+ + 6 Н2O (21-3)
Таким образом, биосинтез жирных кислот, таких как пальмитат, нуждается в ацетил-СоА и в поступлении химической энергии в двух формах: энергии переноса группы АТР и восстановительного потенциала NADPH. Для присоединения СO2 к ацетил-СоА с образованием малонил-СоА необходим АТР; NADPH требуется для восстановления двойных связей.
У нефотосинтезирующих эукариот синтез жирных кислот требует дополнительных затрат, поскольку образующийся в митохондриях ацетил-СоА должен быть перенесен в цитозоль. Как мы увидим далее, при этом на перенос одной молекулы ацетил-СоА затрачиваются две молекулы АТР, что увеличивает энергетические затраты в синтезе жирных кислот до трех молекул АТР на один двухуглеродный фрагмент.
Синтез жирных кислот у многих организмов происходит в цитозоле, а у растений — в хлоропластах
У большинства высших эукариот комплекс синтазы жирных кислот находится исключительно в цитозоле (рис. 21-8), как и ферменты биосинтеза нуклеотидов, аминокислот и глюкозы. Такая локализация обеспечивает изоляцию реакций биосинтеза от катаболических реакций, многие из которых протекают в митохондриальном матриксе. Существует и соответствующая сегрегация (изоляция) электронпереносящих кофакторов, используемых в анаболизме (в основном в реакциях восстановления), и кофакторов, используемых в катаболизме (в основном в реакциях окисления).
Рис. 21-8. Внутриклеточная локализация метаболизма липидов. Клетки дрожжей и позвоночных отличаются от клеток высших растений по компартментализации липидного метаболизма. Синтез жирных кислот происходит в компартменте, где NADРН доступен для восстановительного синтеза (т. е. где отношение [NADРН/NADР+] высокое). Красным шрифтом даны названия процессов, описанных в данной главе.
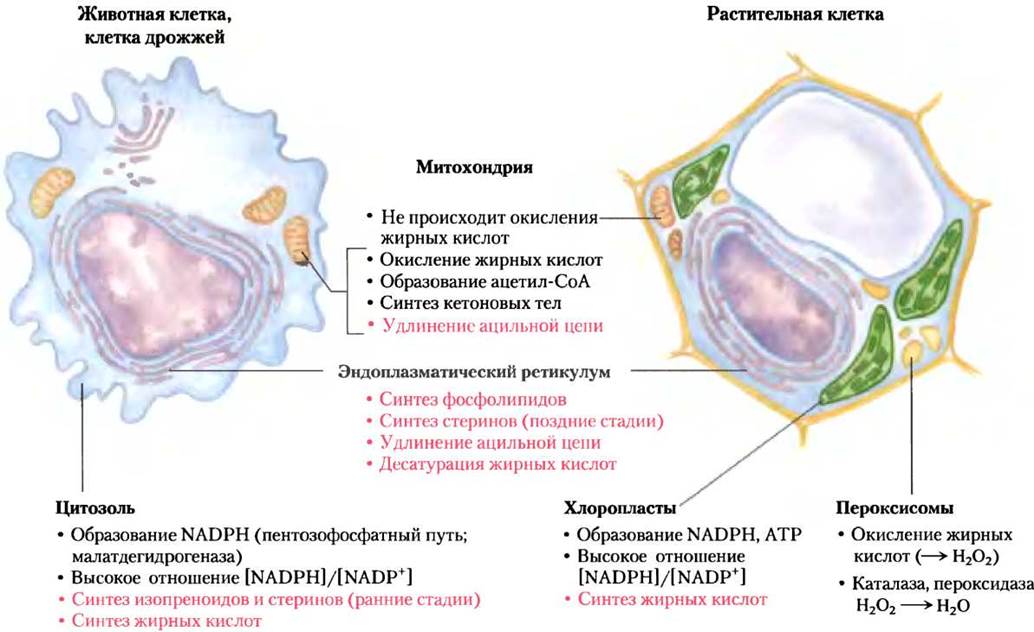
Обычно NАDРН служит переносчиком электронов в анаболических, а NАD+ — в катаболических реакциях. В гепатоцитах очень высокое отношение [NАDРН]/[NАDР+] ≈75, что обеспечивает сильное восстанавливающее окружение для восстановительного синтеза жирных кислот и других биомолекул. Цитозольное отношение [NАDРН]/[NАD+] гораздо ниже, ~8 • 10-4, так что NАD+-зависимый окислительный катаболизм глюкозы может происходить в том же компартменте и в то же самое время, что и синтез жирных кислот. В митохондриях отношение [NАDРН]/ [NАD] немного выше, чем в цитозоле, что обусловлено потоком электронов к NAD+ при окислении жирных кислот, аминокислот, пирувата и ацетил-СоА. В митохондриях высокое отношение [NADPH]/[NAD+] благоприятствует восстановлению кислорода в дыхательной цепи.
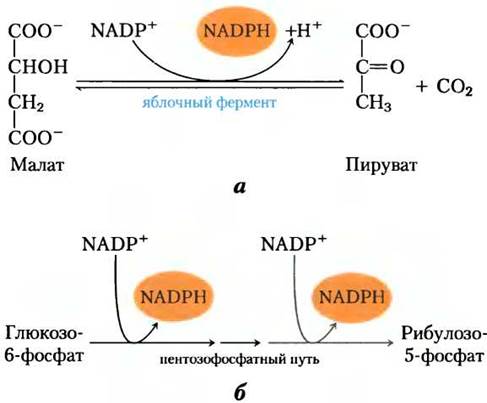
В гепатоцитах и адипоцитах цитозольный NADPH образуется главным образом в пентозофосфатном цикле (см. рис. 14-21) с участием яблочного фермента(малатдегидрогеназы, или малик-фермента; рис. 21-9, а). Катализирующая образование NADP малатдегидрогеназа, обеспечивающая ассимиляцию углерода у С4-растений (см. рис. 20-23), выполняет и другую функцию. Пируват, образующийся в реакции, показанной на рис. 21-9, а, возвращается в митохондрии. Необходимый для биосинтеза жирных кислот NADPH поставляется в гепатоциты и в молочные железы млекопитающих из пентозофосфатного пути (рис. 21-9, б).
Рис. 21-9. Образование NАDРН. Два пути образования NADРН: а — катализ яблочным ферментом и б — пентозофосфатный путь.
В фотосинтезирующих клетках растений синтез жирных кислот происходит не в цитозоле, а в строме хлоропласта (рис. 21-8). Это объясняется тем, что NАDРН образуется в хлоропластах в ходе световых реакций фотосинтеза:
![]()
Ацетат выводится из митохондрий в виде цитрата
У нефотосинтезирующих эукариот почти весь ацетил-СоА, используемый в синтезе жирных кислот, образуется в митохондриях в результате окисления пирувата и катаболизма углеродных остовов аминокислот. Ацетил-СоА, образующийся при окислении жирных кислот, не вносит существенного вклада в биосинтез жирных кислот у животных, поскольку два этих пути взаиморегулируются, как описано ниже.
Внутренняя мембрана митохондрий непроницаема для ацетил-СоА, поэтому ацетильные эквиваленты переносит через внутреннюю мембрану дополнительный челнок (рис. 21-10). Внутримитохондриальный ацетил-СоА сначала реагирует с оксалоацетатом в цикле лимонной кислоты, образуя цитрат по реакции, катализируемой цитратсинтазой (см. рис. 16-7).
Рис. 21-10. Челнок для переноса ацетильных групп из митохондрий в цитозоль. Наружная митохондриальная мембрана легко проницаема для всех упомянутых компонентов. Пируват, образующийся при катаболизме аминокислот в митохондриальном матриксе или из глюкозы при гликолизе в цитозоле, превращается в ацетил-СоА в матриксе. Ацетильные группы выходят из митохондрии в виде цитрата; в цитозоль они доставляются для синтеза жирных кислот в виде ацетил-СоА. Оксалоацетат восстанавливается до малата, который возвращается в митохондриальный матрикс и превращается в оксалоацетат. Малат в цитозоле окисляется яблочным ферментом с образованием NADРН, который остается в цитозоле, а пируват возвращается в митохондриальный матрикс.
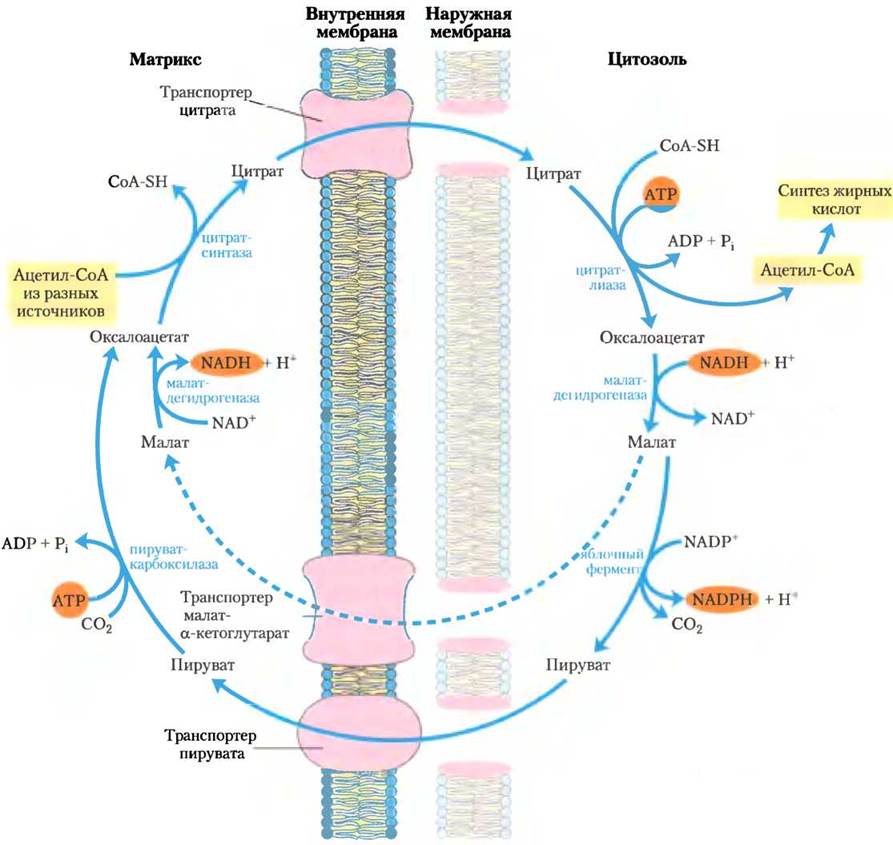
Затем цитрат проходит через внутреннюю мембрану на цитратный транспортер. В цитозоле при расщеплении цитрата цитратлиазой в результате ATP-зависимой реакции регенерируется ацетил-СоА. Оксалоацетат не может вернуться непосредственно в митохондриальный матрикс, поскольку для него нет переносчика. Вместо этого цитозольная малатдегидрогеназа восстанавливает оксалоацетат до малата, который возвращается в митохондриальный матрикс с помощью малат-α-кетоглутаратного транспортера в обмен на цитрат. В матриксе малат повторно окисляется до оксалоацетата, завершая челночный цикл. Однако основные количества малата, образующегося в цитозоле, используются для производства цитозольного NADPH с помощью яблочного фермента (рис. 21-9, а). Образующийся пируват переносится в митохондрии специализированным переносчиком (рис. 21-10) и в матриксе превращается обратно в оксалоацетат при участии пируваткарбоксилазы. На этот цикл расходуется две молекулы АТР (одна нужна в цитратлиазной реакции, другая — пируваткарбоксилазной) на молекулу ацетил-СоА. После отщепления цитрата с образованием ацетил-СоА происходит превращение четырех оставшихся атомов углерода в молекулы пирувата и СO2 при участии яблочного фермента, что сопровождается образованием приблизительно половины того количества NADPH, которое необходимо для синтеза жирных кислот. Остальной NADPH поступает из пентозофосфатного пути.
Биосинтез жирных кислот жестко регулируется
Когда у клетки или организма метаболической энергии больше, чем нужно для удовлетворения ее энергетических потребностей, этот избыток обычно конвертируется в жирные кислоты и сохраняется в виде липидов (триацилглицеринов). Реакция, катализируемая ацетил-СоА-карбоксилазой, является лимитирующей скорость стадией в биосинтезе жирных кислот, и этот фермент играет важную роль в регуляции. У позвоночных пальмитоил-СоА, главный продукт синтеза жирных кислот, действует по принципу обратной связи как ингибитор фермента; цитрат служит аллостерическим активатором (рис. 21-11, а), увеличивающим Vmах. Цитрат играет центральную роль в переключении клеточного метаболизма с потребления (окисления) метаболического топлива на хранение его в виде жирных кислот. Когда концентрации митохондриальных ацетил-СоА и АТР увеличиваются, цитрат выводится из митохондрий; он становится и предшественником цитозольного ацетил-СоА,
и аллостерическим сигналом для активации ацетил-СоА-карбоксилазы. Цитрат же ингибирует активность фосфофруктокиназы-1 (см. рис. 15-14), уменьшая обмен углерода в гликолизе.
Рис. 21-11. Регуляция синтеза жирных кислот, а — в клетках позвоночных и аллостерическая регуляция, и гормон- зависимая ковалентная модификация влияют на образование малонил-СоА из предшественников. У растений ацетил-СоА-карбоксилаза активируется изменениями концентрации Мg2+ и pH, которые происходят при освещении (не показано), б — филаменты ацетил-СоА-карбоксилазы (активная дефосфорилированная форма) в электронном микроскопе.
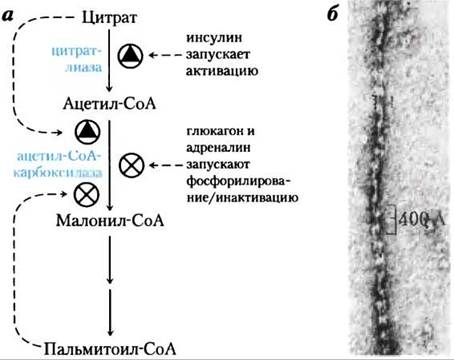
Ацетил-СоА-карбоксилаза регулируется также путем ковалентной модификации. Фосфорилирование, приводимое в действие гормонами глюкагоном и адреналином, инактивирует фермент и уменьшает его чувствительность к активации цитратом, тем самым замедляя синтез жирных кислот. В активной (дефосфорилированной) форме ацетил-СоА-карбоксилаза полимеризуется, образуя длинные филаменты (рис. 21-11, б); фосфорилирование сопровождается диссоциацией на мономерные субъединицы и потерей активности.
Ацетил-СоА-карбоксилаза растений и бактерий не регулируется цитратом или циклом фосфорилирование-дефосфорилирование. Фермент растений активируется при увеличении pH и концентрации Mg2+ в строме, которое происходит при освещении растения (см. рис. 20-17). Бактерии не используют триацилглицерины как форму хранения энергии. У Е. coli главная роль синтеза жирных кислот заключается в получении предшественников для синтеза мембранных липидов; этот процесс имеет сложную регуляцию при участии гуаниннуклеотидов (таких как ppGpp), которые координируют рост клетки и образование мембраны (см. рис. 8-39, т. 1; 28-24, т. 3).
Наряду с регуляцией ферментативной активности эти метаболические пути дополнительно имеют регуляцию на уровне экспрессии генов. Например, когда животные переваривают избыточное количество некоторых полиненасыщенных жирных кислот, экспрессия генов, кодирующих целый ряд производящих липиды ферментов в печени, подавляется. Детальный механизм регуляции этих генов пока неясен.
Если бы синтез жирных кислот и β-окисление протекали одновременно, эти два процесса работали бы как бесполезный цикл с напрасной затратой энергии. Ранее мы отмечали (см. рис. 17-12), что β-окисление блокируется под действием малонил-СоА, который ингибирует карнитина- цилтрансферазу I. При этом образование первого промежуточного продукта синтеза жирных кислот малонил-СоА останавливает β-окисление на уровне транспортной системы во внутренней мембране митохондрий. Этот регуляторный механизм иллюстрирует еще одно преимущество изоляции (сегрегации) процессов синтеза и распада в разных клеточных компартментах.
Длинноцепочечные насыщенные жирные кислоты синтезируются из пальмитата
В животных клетках пальмитат, главный продукт системы синтазы жирных кислот, является предшественником других длинноцепочечных жирных кислот (рис. 21-12). Его можно удлинить до стеарата (18:0) или даже до более длинных насыщенных жирных кислот путем последовательного добавления ацетильных групп. Это происходит с помощью работы системы элонгации жирных кислот, которая находится в гладком эндоплазматическом ретикулуме и митохондриях. Более активная система эндоплазматического ретикулума (ЭР) удлиняет 16-углеродную цепь пальмитоил-СоА на два атома углерода, образуя стеароил-СоА. Механизм элонгации в ЭР в остальном идентичен механизму синтеза пальмитата, хотя в них участвуют разные ферментные системы и более вероятным переносчиком ацила в этой реакции является кофермент А, а не АСР. Отщепление двух атомов углерода от малонил-СоА тоже происходит в ЭР, далее следует восстановление, дегидратация и восстановление до насыщенной 18-углеродной цепи, стеароил-СоА.
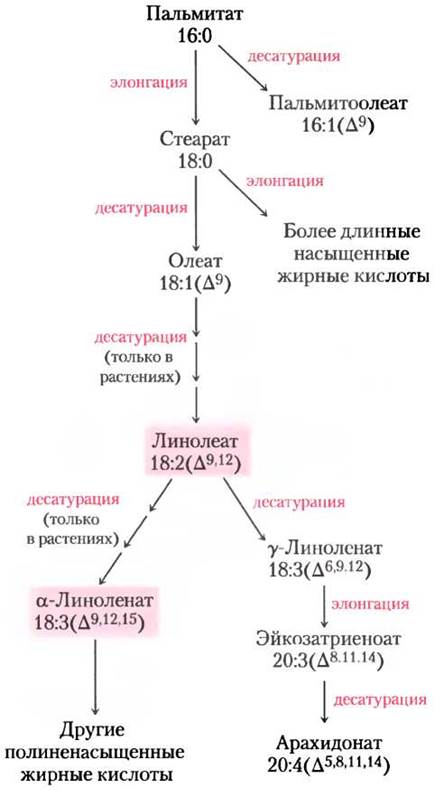
Рис. 21-12. Пути синтеза других жирных кислот. Пальмитат — предшественник стеарата и более длинноцепочечных насыщенных жирных кислот, а также мононенасыщенных кислот пальмитоолеата и олеата. Млекопитающие не могут превращать олеат в линолеат или линоленат (выделены розовым цветом), поэтому эти вещества должны присутствовать в пище; это незаменимые жирные кислоты. Схематически изображено превращение линолеата в другие полиненасыщенные жирные кислоты и эйкозаноиды. В названиях ненасыщенных жирных кислот указывают число углеродных атомов и положение двойных связей, как показано в табл. 10-1, т. 1.
Для десатурации жирных кислот требуются оксидазы со смешанной функцией
Пальмитат и стеарат служат предшественниками двух наиболее распространенных в животных тканях мононенасыщенных жирных кислот: пальмитоолеата, 16:1 (∆9) и олеата 18:1 (∆9); обе эти жирные кислоты содержат одну двойную связь в цис-положении между С-9 и С-10 (см. табл. 10-1). Двойная связь вводится в цепь жирной кислоты в окислительной реакции, катализируемой ацил-СоА-десатуразой (рис. 21-13), оксидазой со смешанной функцией (доп. 21-1).
Рис. 21-13. Перенос электронов при десатурации жирных кислот у позвоночных. Голубые стрелки показывают путь электронов при окислении молекулярным кислородом двух субстратов: ацил-СоА и NADРН. Эти реакции происходят на внутренней поверхности гладкого ЭР. Похожий путь, но с участием других переносчиков электронов есть и у растений.
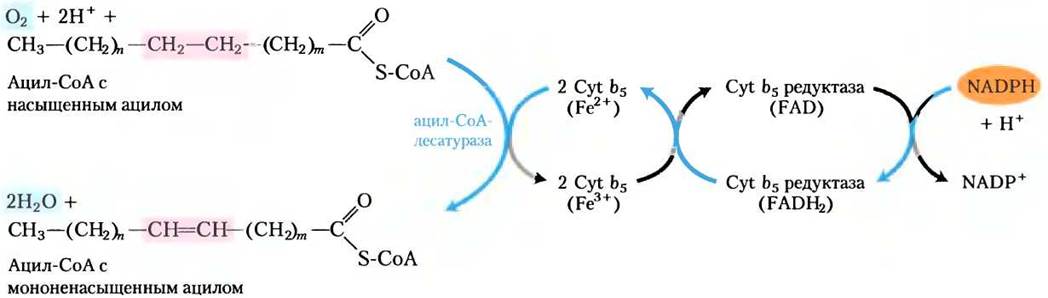
Два разных субстрата — жирная кислота и NADH или NADPH — одновременно подвергаются двухэлектронному окислению. Путь электронов проходит через цитохром (цитохром b5,) и флавопротеин (цитохром-b5-редуктазу). Оба этих компонента, как и ацил-СоА-десатураза, находятся в гладком ЭР. У бактерий две цитохром- b5-редуктазы: NADH-зависимая и NADPH- зависимая. Какая из них выступает главным донором электронов in vivo — неясно. У растений олеат образуется в строме хлоропластов с помощью стеароил-АСР-десатуразы, которая в качестве донора электронов использует восстановленный ферредоксин.
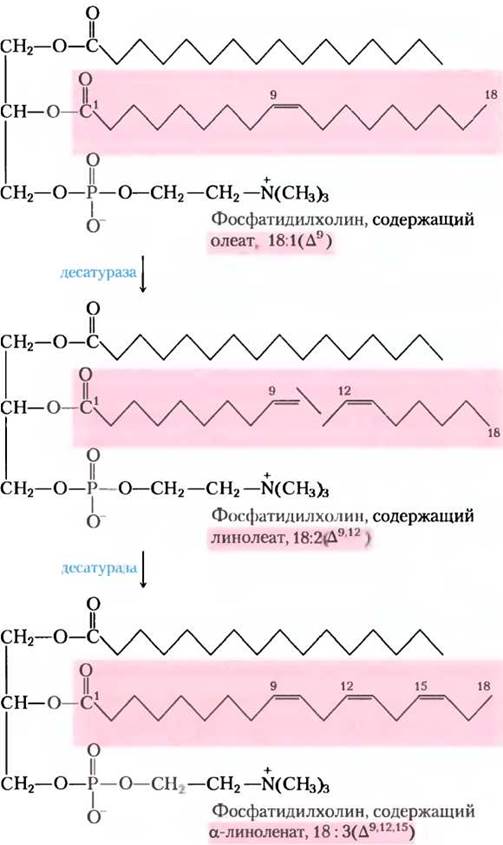
Гепатоциты млекопитающих способны легко вводить двойные связи в положение ∆9 жирных кислот, но не способны вводить дополнительные двойные связи между С-10 и концевой метильной группой. Таким образом, млекопитающие не могут синтезировать линолеат 18:2(∆9,12) или α-линоленат 18:3(∆9,12,15). Однако в растениях возможен синтез обоих этих веществ; десатуразы, которые вводят двойные связи в положения ∆12 или ∆15, локализованы в ЭР и хлоропластах. Ферменты ЭР действуют не только на свободные жирные кислоты, но и на фосфолипид фосфатидилхолин, который содержит, по крайней мере, одну молекулу олеата, связанную с глицерином (рис. 21-14). И растения, и бактерии должны синтезировать полиненасыщенные жирные кислоты для обеспечения необходимой текучести мембран при пониженных температурах. Рис. 21-14. Работа растительных десатураз. Десатуразы растений окисляют связанный в составе фосфатидилхолина олеат с образованием полиненасыщенных жирных кислот; некоторые продукты высвобождаются из фосфатидилхолина путем гидролиза.
Поскольку линолеат и линоленат необходимы как предшественники для синтеза других продуктов, для млекопитающих они являются незаменимыми жирными кислотами. Млекопитающие получают их с растительной пищей. Поступивший внутрь линолеат может превращаться в некоторые другие полиненасыщенные кислоты, в частности улиноленат, эйкозатри- еноат и арахидонат (эйкозатетраеноат). Все эти кислоты могут производиться только из линолеата (рис. 21-12). Арахидонат 20:4 (∆5,8,11,14)-необходимый предшественник регуляторных липидов — эйкозаноидов. В реакциях элонгации жирных кислот, аналогичных реакциям, описанным на с. 457, из линолеата (и линолената) синтезируются 20-углеродные жирные кислоты.
Дополнение 21-1. Оксидазы со смешанной функцией, оксигеназы и цитохром Р-450
В этой главе мы говорили о нескольких ферментах, осуществляющих окислительно-восстановительные реакции с участием молекулярного кислорода. Одна из таких реакций — образование двойной связи в цепи жирной кислоты (см. рис. 21-13).
Номенклатура ферментов, которые катализируют реакции этого типа, часто сбивает с толку студентов в отношении механизма этих реакций. Оксидазы — это общее название ферментов, катализирующих реакции окисления, в которых молекулярный кислород служит акцептором электронов, но атомы кислорода в окисленном продукте не присутствуют (однако, как мы увидим, из этого «правила» есть исключение!). Оксидаза этого типа — фермент, который создает двойную связь в остатке жирной кислоты ацил-СоА при окислении жирных кислот в пероксисомах (см. рис. 17- 13); второй пример — цитохромоксидаза электроннотранспортной цепи митохондрий (см. рис. 19-14). В первом случае перенос двух электронов на Н2O дает пероксид водорода; во втором — два электрона восстанавливают 1/2 O2 до Н2O. Многие, но не все, оксидазы являются флавопротеинами.
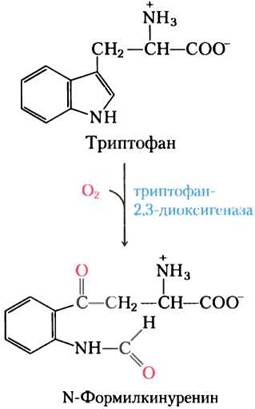
Оксигеназы катализируют окислительные реакции, в которых атомы кислорода непосредственно включаются в молекулу субстрата, образуя, например, новую гидроксильную или карбоксильную группу. Диоксигеназы катализируют реакции, в которых оба кислородных атома O2 включаются в молекулу органического субстрата. Пример диоксигеназы — триптофан-2,3-диоксигеназа, катализирующая раскрытие пятичленного кольца триптофана при катаболизме этой аминокислоты. Когда эта реакция протекает в присутствии 18O2, меченые атомы кислорода обнаруживаются в двух карбонильных группах продукта (выделены красным цветом).
Монооксигеназы более многочисленны и более сложные по своему действию. Они катализируют реакции, в которых только один из двух кислородных атомов молекулы O2включается в органический субстрат, второй кислород восстанавливается до Н2O. Монооксигеназам требуются два субстрата для восстановления двух кислородных атомов O2. Главный субстрат принимает один из двух кислородных атомов, а косубстрат предоставляет атомы водорода для восстановления второго атома кислорода до Н2O. Общее уравнение реакции для монооксигеназ выглядит следующим образом:
АН + ВН2 + O-O —> А-ОН + В + Н2O
где АН — главный субстрат, а ВН2 — косубстрат. Поскольку большинство монооксигеназ катализирует реакции, в которых главный субстрат гидроксилируется, их называют также гидроксилазами. Иногда их называют оксидазами со смешанной функцией или оксигеназами со смешанной функцией, чтобы показать, что они окисляют одновременно два разных субстрата. (Заметим, что использование здесь слова «оксидаза» — отклонение от общепринятого значения этого термина, о котором говорилось выше.)
Существуют различные классы монооксигеназ в зависимости от природы косубстрата. Некоторые монооксигеназы используют флавиннуклеотиды (FМNН2 или FАDН2), другие — NАDН или NАDРН, а третьи — α-кетоглутарат в качестве косубстрата. Фермент, который гидроксилирует фенильное кольцо фенилаланина с образованием тирозина, — это монооксигеназа, косубстратом для которой служит тетрагидробиоптерин (см. рис. 18-23). При развитии у человека генетического заболевания фенилкетонурии этот фермент поврежден.
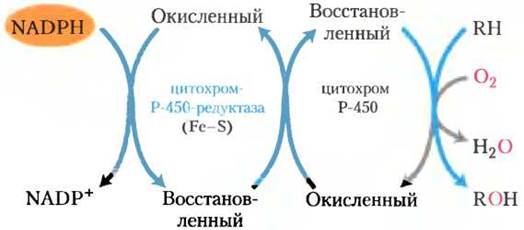
Самые многочисленные и наиболее сложные монооксигеназные реакции используют один из гемо-протеинов — цитохром Р-450. Этот цитохром присутствует обычно в гладком ЭР, а не в митохондриях. Подобно митохондриальной цитохромоксидазе, цитохром Р-450 может реагировать с O2 и связывать монооксид углерода СО, но его можно отличить от цитохром- оксидазы, поскольку комплекс его восстановленной формы с монооксидом углерода поглощает свет строго при 450 нм — отсюда и название Р-450.
Цитохром Р-450 катализирует реакции гидроксилирования, при которых органический субстрат RН гидроксилируется до R-ОН, т. е. включает в свой состав один кислород из молекулы O2; а другой кислород восстанавливается до Н2O с помощью восстановительных эквивалентов, которые предоставляются NАDН или NАDРН, но передаются на цитохром Р-450 обычно посредством железосерного белка. На рис. 1 представлена упрощенная схема работы цитохрома Р-450, в которой есть пока еще не до конца понятные промежуточные стадии.
Рис. 1.
Цитохром Р-450 представлен на самом деле целым семейством похожих белков; известны несколько сотен белков этого семейства, и каждый из них имеет отличную от других субстратную специфичность. Например, в коре надпочечников специфический цитохром Р-450 участвует в гидроксилировании стероидов с образованием гормонов (см. рис. 21-46). Цитохром Р-450 играет важную роль в гидроксилировании многих лекарств, таких как барбитураты, а также других ксенобиотиков (чужеродных для организма веществ), особенно если это гидрофобные вещества, практически не растворимые в воде. Присутствующий в окружающей среде канцероген бензо[а] пирен (обнаруженный в дыме сигарет) для детоксикации подвергается гидроксилированию с помощью цитохрома Р-450. Гидроксилирование ксенобиотиков делает их более растворимыми в воде, и таким образом становится возможным их выведение с мочой. К сожалению, гидроксилирование некоторых соединений превращает их в токсичные вещества, которые разрушают систему детоксикации.
Реакции, катализируемые оксидазами со смешанной функцией, описанные в данной главе, относятся к путям десатурации ацил-СоА жирных кислот (рис. 21-13); эти реакции встречаются при синтезе лейкотриенов (рис. 21-16), синтезе плазмалогенов (рис. 21-30), при превращениях сквалена в холестерин (рис. 21-37) и при синтезе стероидных гормонов (рис. 21-46).
Эйкозаноиды образуются из содержащих 20 углеродных атомов полиненасыщенных жирных кислот
Эйкозаноиды — семейство очень мощных сигнальных биомолекул, которые работают как мессенджеры ближнего действия, влияя на ткани, находящиеся вблизи тех клеток, в которых эти биомолекулы продуцируются. В ответ на гормональные или иные стимулы фосфолипаза А2, присутствующая в большинстве клеток млекопитающих, атакует мембранные фосфолипиды, при этом отщепляется арахидонат, находящийся у среднего атома глицерина. Затем ферменты гладкого ЭР превращают арахидонат в простагландины, начиная с образования простагландина Н2(PGH2) — непосредственного предшественника многих других простагландинов и тромбоксанов (рис. 21-15, а). Две реакции биосинтеза PGH2 катализируются бифункциональным ферментом циклооксигеназой (СОХ), называемой также синтазой простагландина Н2. В первой реакции в результате циклооксигеназной активности вводится молекулярный кислород, превращая арахидонат в PGG2. На второй — в результате пероксидазной активности СОХ PGG2превращается в PGH2.
Рис. 21-15. «Циклический» путь от арахидоната до простагландинов и тромбоксанов. а — после того как арахмдонат высвобождается из фосфолипидов под действием фосфолипазы А2, циклооксигеназная и перок- сидазная активности СОХ (синтазы простагландина Н2) катализируют образование PGH2, предшественника других простагландинов и тромбоксанов. б — аспирин ингибирует первую реакцию, ацетилируя самый главный (незаменимый) остаток Ser в ферменте. Ибупрофен и напроксен ингибируют ту же самую реакцию, вероятно, имитируя структуру субстрата или промежуточного продукта реакции. в — специфические ингибиторы СОХ-2, которые получили применение как болеутоляющие (см. текст).
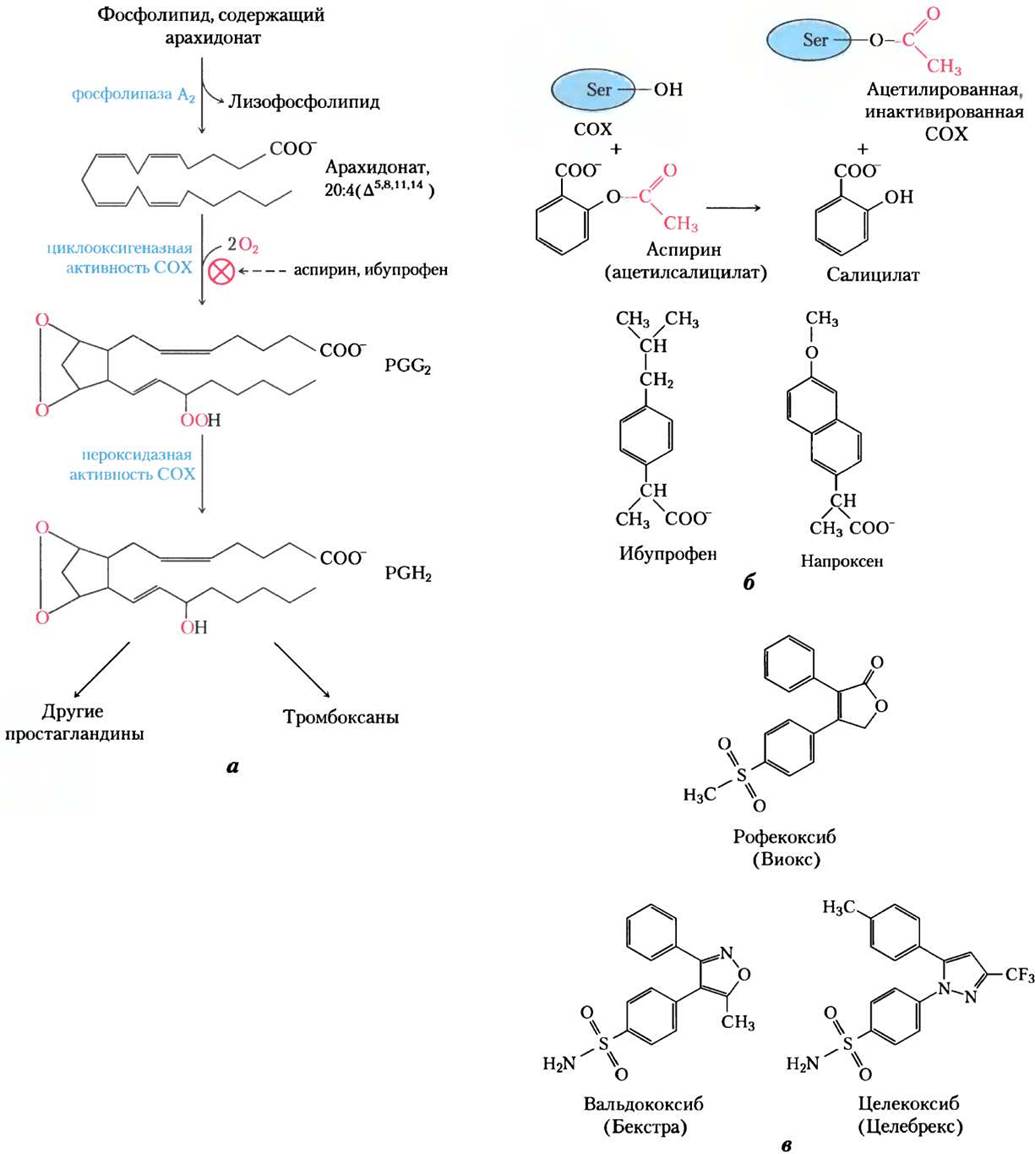
У млекопитающих существуют два изофермента синтазы простагландина Н2 — СОХ-1 и СОХ-2. У них разные функции, но очень похожие последовательности аминокислот (идентичность почти 60%) и механизмы реакции на обоих каталитических центрах. СОХ-1 отвечает за синтез простагландинов, регулирующих секрецию желудочного муцина, а СОХ-2 — за синтез простагландинов, которые являются медиаторами воспаления, боли и лихорадочного состояния.
Боли можно облегчить, ингибируя СОХ-2. Первым лекарственным препаратом, широко применяемым для этой цели, стал аспирин (ацетилсалицилат; рис. 21-15, б). Торговое название «аспирин» (а от ацетила и spir от Spirsaüre, немецкого названия салициловой кислоты, получаемой из лабазника вязолистного Spiraea ulmaria) появилось в 1899 г., когда это лекарство стало производиться фирмой Bayer. Аспирин почти одинаково ингибирует циклооксигеназную активность обеих изоферментов СОХ, ацетилируя остатки серина и блокируя активные центры каждого из этих ферментов. Тем самым ингибируется также синтез простагландинов и тромбоксанов. Эту пару ферментов ингибирует также ибупрофен и другие широко используемые нестероидные противовоспалительные препараты (НПВП; рис. 21-15, б). Но ингибирование СОХ-1 может приводить к неприятным побочным эффектам, включая раздражение желудка и более серьезные последствия. В 1990-х гг. после определения кристаллических структур СОХ-1 и СОХ-2 были созданы соединения, которые проявляют гораздо большую специфичность в отношении СОХ-2. Эти вещества эффективно облегчают боли разного генезиса. Наиболее широко стали применяться три препарата — рофекоксиб (Виокс), вальдекоксиб (Бекстра) и целекоксиб (Целебрекс) (рис. 21-15, в). Они были разработаны в конце 1990-х гг. и сразу привлекли внимание фармацевтических компаний. Однако по мере накопления отчетов о клинических испытаниях энтузиазма поубавилось, так как было доказано, что эти лекарства увеличивают риск инфаркта миокарда и инсульта. Причины таких побочных эффектов до сих пор неизвестны, но некоторые исследователи предполагают, что ингибиторы СОХ-2 нарушают «хрупкое» равновесие между гормоном простациклином, который расширяет просвет кровеносных сосудов, препятствует свертыванию крови и чье действие снимают ингибиторы СОХ-2, и тромбок- санами, синтезирующимися с участием СОХ-1 и играющими роль в свертывании крови. Виокс был снят с производства и изъят из продажи в 2004 г., вскоре последовал и запрещение на Бекстру. Целебрекс пока используется (2013 г.), но с повышенной осторожностью.
В тромбоцитах крови присутствует тромбоксансинтаза, превращающая РGН2 в тромбоксан А2, от которого происходят и другие тромбоксаны (рис. 21-15, а). Тромбоксаны вызывают сокращение кровеносных сосудов и агрегацию тромбоцитов на ранних стадиях свертывания крови. Малые дозы аспирина, принимаемые регулярно, уменьшают вероятность сердечных приступов и инсультов, снижая выделение тромбоксанов. ■
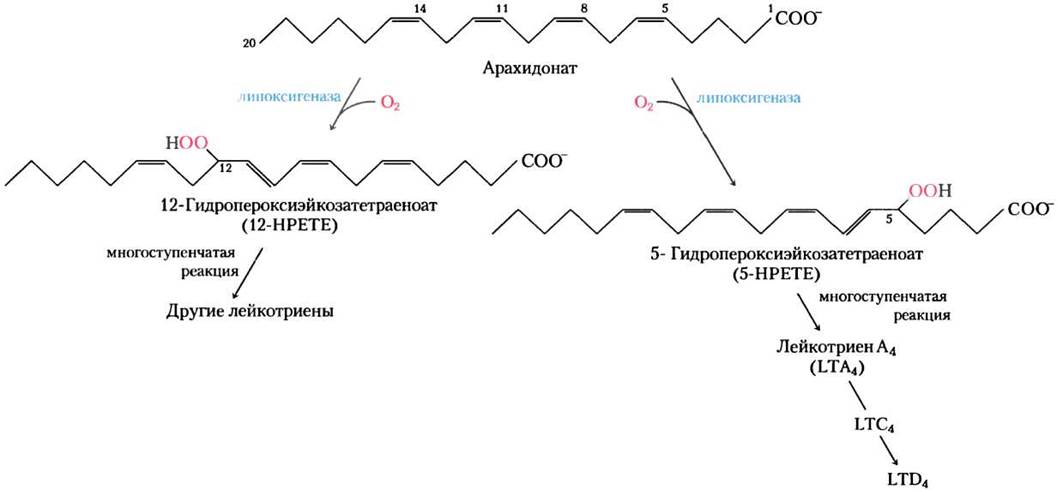
Тромбоксаны, как и простагландины, содержат кольцо из пяти или шести атомов; путь от арахидоната до соединений этих двух классов иногда называют «циклическим» путем, чтобы отличать его от «линейного» пути от арахидоната до лейкотриенов, соединений с линейной углеродной цепью (рис. 21-16). Синтез лейкотриенов начинается с действия нескольких липоксигеназ, которые катализируют включение молекулярного кислорода в арахидонат. Эти ферменты, обнаруженные в лейкоцитах, сердце, головном мозге, легких и селезенке, относятся к оксидазам со смешанной функцией; наиболее распространенная оксидаза со смешанной функцией — цитохром Р-450 (доп. 21-1). Разные лейкотриены отличаются положением пероксидной группы, вводимой липоксигеназами. «Линейный» путь от арахидоната, в отличие от «циклического» пути, не ингибируется аспирином или другими НПВП.
Рис. 21-16. «Линейный» путь от арахидоната до лейкотриенов.
Растения тоже производят важные сигнальные молекулы из жирных кислот. Как и у животных, на ключевой стадии инициации сигнального пути происходит активация специфической фосфолипазы. У растений высвобождающийся жирнокислотный субстрат — это α-линолеат. Затем на первой стадии пути липоксигеназа катализирует превращение линолеата в жасмонат. Известно, что жасмонат (см. рис. 12-32 в т. 1) выполняет сигнальные функции при защите от насекомых, обеспечении устойчивости к патогенам грибного происхождения и при созревании пыльцы. Кроме того, он влияет на прорастание семян, рост корня, развитие плодов и семян.
Краткое содержание раздела 21.1 Биосинтез жирных кислот и эйкозаноидов
■ Длинноцепочечные жирные кислоты синтезируются из ацетил-СоА с помощью цитозольного ферментного комплекса (шесть активных центров) и апилпереносящего белка (АСР). Существует два типа синтазы жирных кислот. СЖК типа I обнаружена у позвоночных и у грибов; она состоит из полифункциональных полипептидов. СЖК типа II представлена комплексом из отдельных белков; она обнаружена у бактерий и растений. Эти две синтазы содержат разные -SH-группы (от фосфопантатеина из АСР и от остатка Cys β-кетоацил-АСР- синтазы), которые функционируют как переносчики содержащих жирные ацилы интермедиатов.
■ Малонил-АСР, образованный из ацетил-СоА («челнок» митохондрий) и СO2, конденсируется с ацетилом, связанным с Cys-SH, образуя ацетоацетил-АСР и СO2. За этим следует восстановление до D-β-гидроксипроизводного, дегидратация с получением транс-∆2-ненасыщенного ацил-АСР и восстановление до бутирил-АСР. Донором электронов для обоих реакций восстановления служит NADPH. Синтез жирной кислоты регулируется на уровне образования малонил-СоА.
■ Еще шесть молекул малонил-АСР успешно вступают в реакцию, присоединяясь на карбоксильном конце растущей жирнокислотной цепи, образуя конечный продукт реакции синтазы жирных кислот — пальмитоил-АСР. Пальмитат высвобождается путем гидролиза.
■ Пальмитат может быть удлинен до 18-углеродного стеарата. Пальмитат и стеарат могут десатурироваться под действием оксидаз со смешанной функцией с образованием пальмитоолеата и олеата соответственно.
■ Млекопитающие не могут вырабатывать линолеат и должны получать его из растительных источников; они превращают экзогенный линолеат в арахидонат — исходное соединение для биосинтеза эйкозаноидов (простагландинов, тромбоксанов и лейкотриенов — семейство очень мощных сигнальных молекул). Синтез простагландинов и тромбоксанов ингибируют НПВС, которые действуют на активность синтазы простагландина Н2.