ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
21. БИОСИНТЕЗ ЛИПИДОВ
21.2. Биосинтез триацилглицеринов
Основные количества синтезируемых или усваиваемых организмом жирных кислот имеют две возможные судьбы: включение в триацилглицерины для сохранения метаболической энергии или образование фосфолипидных компонентов мембран. Выбор между этими альтернативными путями зависит от текущих потребностей организма. Во время быстрого роста синтез новых мембран требует производства мембранных фосфолипидов; когда организм получает обильное питание, но активно не растет, он направляет большую часть своих жирных кислот в жировые депо (сохраняемые жиры). Оба пути начинаются с одного и того же — образования эфиров глицерина и жирных кислот. В следующем разделе мы рассмотрим ход образования триацилглицеринов и его регуляцию, и образование глицерин- 3-фосфата в процессе глицеронеогенеза.
Триацилглицерины и глицерофосфолипиды синтезируются из одних и тех же предшественников
Животные могут синтезировать и сохранять огромные количества триацилглицеринов для последующего использования в качестве топлива (см. доп. 17-1). В печени и мышцах человека может накапливаться только несколько сотен граммов гликогена, и этого едва хватает для удовлетворения энергетических потребностей организма в течение 12 часов. В то же время в теле мужчины среднего телосложения массой ~70 кг имеется около 15 кг триацилглицеринов, и этого достаточно для удовлетворения основных энергетических нужд организма в течение 12 недель (см. табл. 23-5). В триацилглицеринах заключено более 38 кДж/r энергии, чем в других питательных веществах. Всякий раз, когда происходит всасывание углеводов в количестве, превышающем способность организма депонировать гликоген, их избыток превращается в триацилглицерины и хранится в жировой ткани. Растения также производят триацилглицерины, богатые энергией топливные молекулы, и накапливают их главным образом в сочных плодах, орехах и семенах.
В животных тканях у триацилглицеринов и глицерофосфолипидов, например, фосфатидил-этаноламина, два общих предшественника (ацил- СоА жирных кислот и L-глицерин-З-фосфат); они образуются в нескольких реакциях биосинтеза. Основные количества глицерин-3-фосфата получаются из промежуточного продукта гликолиза дигидроксиацетонфосфата под действием связанной с NAD глицерин-3-фосфат- дегидрогеназы; в печени и почках образуются небольшие количества глицерин-3-фосфата также из глицерина под действием глицеринкиназы (рис. 21-17). Другие предшественники триацилглицеринов — это ацил-СоА, образующиеся из жирных кислот под действием ацил-СоА- синтаз, тех же ферментов, которые отвечают за активацию жирных кислот при β-окислении (см. рис. 17-5).
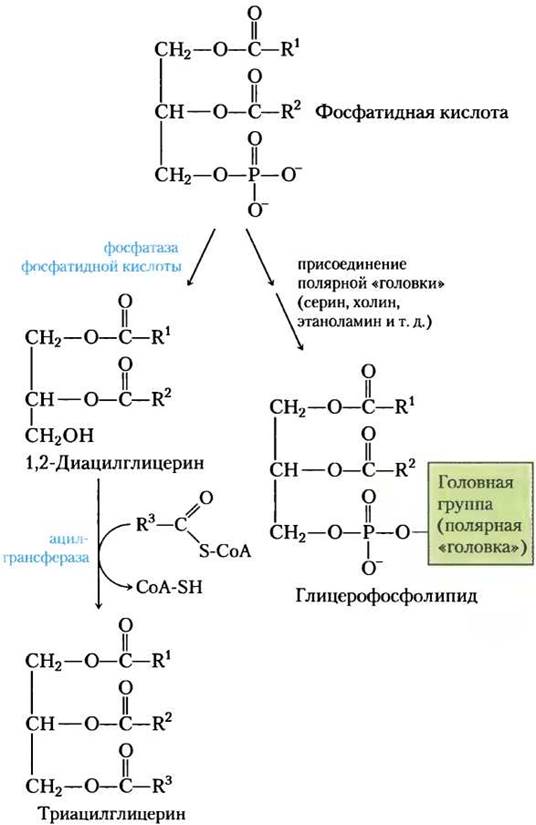
Первая стадия в биосинтезе триацлглицеринов — ацилирование двух свободных гидроксильных групп L-глицерин-3-фосфата двумя молекулами ацил-СоА с образованием диацилглицерин-3-фосфата, который чаще называют фосфатидной кислотой или фосфатидатом (рис. 21-17). Фосфатидная кислота присутствует в клетках только в следовых количествах, но является центральным интермедиатом в биосинтезе липидов — она может превращаться либо в триацилглицерин, либо в глицерофосфолипид. На пути образования триацилглицеринов фосфатидная кислота гидролизуется фосфатазой фосфатидной кислоты с образованием 1,2-диацилглицерина (рис. 21-18). Затем диацилглицерины путем трансэтерификации третьей молекулой ацил-СоА превращаются в триацилглицерины.
Рис. 21-17. Биосинтез фосфатидной кислоты. Ацил жирной кислоты активируется путем образования ацил-СоА, затем переносится к сложноэфирной связи в L-глицеринтрифосфате, образованном по одному из двух представленных здесь путей. Фосфатидная кислота изображена здесь в правильной конфигурации при С-2 молекулы глицерина.
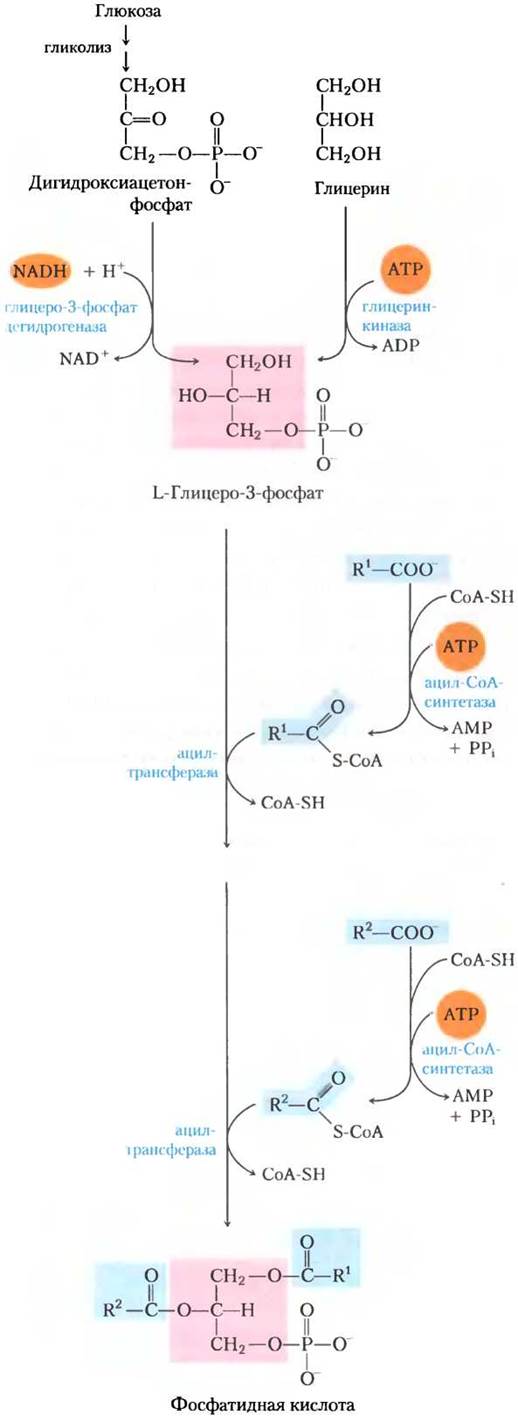
Рис. 21-18. Фосфатидная кислота в биосинтезе липидов. Фосфатидная кислота — предшественник и триацилглицеринов, и глицерофосфолипидов. Механизмы присоединения полярной «головки» при синтезе фосфолипидов описываются далее.
Биосинтез триацилглицеринов у животных регулируется гормонами
У человека количество жира в организме остается относительно постоянным в течение длительных периодов времени, хотя возможны незначительные кратковременные изменения из-за потребления пищи разной калорийности. Углеводороды, жиры или белки, поглощенные в количестве, превышающем энергетические потребности, сохраняются в форме триацилглицеринов. Этот запас энергии помогает организму выдержать периоды голодания.
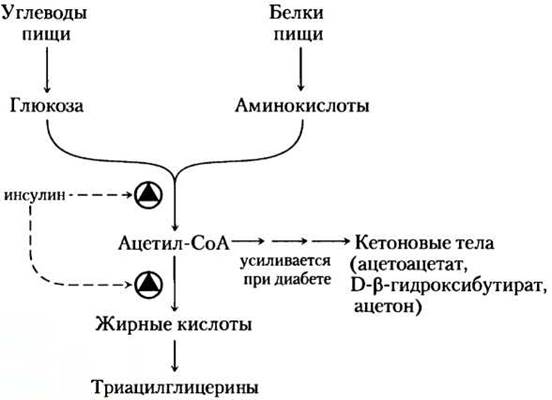
Пути биосинтеза и деградации триацилглицеринов зависят от метаболических ресурсов и потребностей организма в данное время. Скорость биосинтеза триацилглицеринов очень сильно меняется при действии некоторых гормонов. Например, инсулин облегчает превращение углеводов в триацилглицерины (рис. 21-19). Больные с тяжелыми формами сахарного диабета из-за недостатка секреции инсулина или отсутствия его действия не только не способны должным образом использовать глюкозу, поступающую с пищей, но не могут также синтезировать жирные кислоты из углеводов или аминокислот. В отсутствие лечения у больных диабетом наблюдается увеличение скорости окисления жиров и образования кетоновых тел (гл. 17), а, следовательно, потеря массы тела. ■
Рис. 21-19. Регуляция синтеза триацилглицеринов инсулином. Инсулин стимулирует превращение углеводов и белков пищи в жиры. У людей, страдающих сахарным диабетом, не хватает инсулина, и, если болезнь не лечить, синтез жирных кислот уменьшается и вместо этого ацетил-СоА из катаболизма углеводов и белков идет на синтез кетоновых тел. Люди с сильным кетозом пахнут ацетоном, поэтому их иногда путают с пьяными (с. 605).
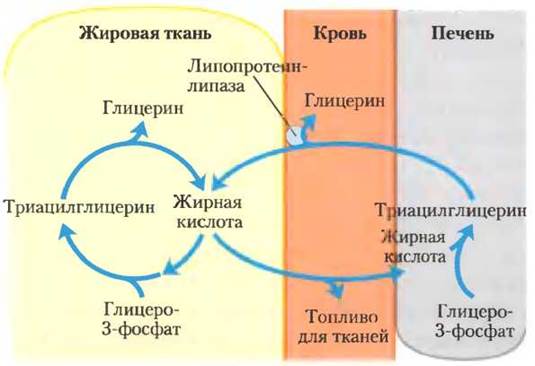
Баланс между биосинтезом и деградацией триацилглицеринов обусловлен тем, что примерно 75% всех жирных кислот, высвобождаемых при липолизе, снова этерифицируются, образуя триацилглицерины, а не используются в качестве топлива. Такое соотношение сохраняется даже в условиях истощения, когда энергетический метаболизм переключается с использования углеводов на окисление жирных кислот. Такое повторное использование жирных кислот частично протекает в жировой ткани, а трансэтерификация происходит перед выходом в кровяное русло. Частично это происходит в цикле, охватывающем весь организм, — свободные жирные кислоты транспортируются в печень, превращаются там в триацилглицерины, снова экспортируются в кровь (транспорт липидов в крови обсуждается в разд. 21.4) и после высвобождения из триацилглицеринов с помощью внеклеточной липопротеинлипазы опять включается в жировую ткань (рис. 21-20; см. также рис. 17-1). Поток веществ триацилглицеринового цикла между жировой тканью и печенью может быть не очень значительным в случае, когда доступно другое топливо и высвобождение жирных кислот из жировой ткани ограничено. Но, как отмечалось выше, относительное количество высвобождаемых жирных кислот, которые трансэтерифицируются, остается постоянными и при любых условиях метаболизма составляет примерно 75%. Следовательно, уровень свободных жирных кислот в крови отражает как скорость высвобождения жирных кислот, так и баланс между синтезом и распадом триацилглицеринов в жировой ткани и в печени.
Рис. 21-20. Триацилглицериновый цикл. У млекопитающих при истощении организма молекулы триацилглицерина разрушаются и ресинтезируются в триацилглицериновом цикле. Некоторые жирные кислоты, высвобождаемые путем липолиза триацилглицеринов жировой ткани, попадают в кровоток, и их остатки используются в ресинтезе триацилглицеринов. Жирные кислоты крови служат для получения энергии (например, в мышцах) или же поступают в печень для синтеза триацилглицеринов. Триацилглицерины, образующиеся в печени, транспортируются кровью обратно в жировую ткань, где под действием внеклеточной липопротеин-липазы высвобождаются жирные кислоты, которые в адипоцитах реэтерифицируются с образованием триацилглицеринов.
Когда требуется мобилизация жирных кислот на энергетические потребности, гормоны глюкагон и адреналин стимулируют их высвобождение из жировой ткани (см. рис. 17-3, 17-12). Одновременно эти гормональные сигналы уменьшают скорость гликолиза и увеличивают скорость глюконеогенеза в печени (производя глюкозу для мозга; подробно об этом см. в гл. 23). Высвобождаемые жирные кислоты захватываются разными тканями, в том числе мышцами, где они окисляются, производя энергию. Основные количества жирных кислот, поглощенных печенью, не окисляются, а повторно используются с образованием триацилглицеринов и возвращаются в жировую ткань.
Зачем нужен этот явно холостой триацилглицериновый цикл (холостые циклы обсуждаются в гл. 15), не совсем понятно. Однако по мере того, как мы больше узнаем об обеспечении триацилглицеринового цикла за счет метаболизма и о координированной регуляции в двух разных органах, открываются и возможности его дальнейшего изучения. Например, триацилглицериновый цикл (в котором жирные кислоты скорее всего вновь превращаются в триацилглицерины, а окисляются как топливные молекулы) может при голодании дополнительно производить энергетический резерв в кровяном русле, который при чрезвычайных обстоятельствах можно гораздо быстрее мобилизовать, а не сохранять в виде триацилглицерина.
Постоянный кругооборот триацилглицеринов в жировой ткани при истощении вызывает еще один вопрос. Что служит источником глицерин-3-фосфата, необходимого для этого процесса? Как отмечалось выше, гликолиз в этих условиях подавляется действием глюкагона или адреналина, поэтому дигидроксиацетонфосфат мало доступен, а глицерин, высвобождаемый в процессе липолиза, не может прямо превращаться в глицерин-3-фосфат в жировой ткани, так как там недостаточно глицеринкиназы (рис. 21-17). Как же производится достаточное количество глицерин-3-фосфата? Ответ кроется в метаболическом пути, открытом более чем три десятилетия тому назад. До недавних пор этому уделялось мало внимания. Этот путь близко связан с триацилглицериновым циклом и, в более широком смысле, с балансом между метаболизмом жирных кислот и метаболизмом углеводов.
Жировая ткань генерирует глицерин-3-фосфат путем глицеронеогенеза
Глицеронеогенез — укороченный путь глюко- неогенеза от пирувата до дигидроксиацетон- фосфата (см. рис. 14-16), после чего происходит превращение дигидроксиацетонфосфата в глицерин-3-фосфат с помощью цитозольной связанной с NAD глицерин-3-фосфатдегидрогеназы (рис. 21-21). Глицерин-3-фосфат используется далее в синтезе триацилглицеринов. Глицеронеогенез был открыт в 1960-х гг. Леа Решеф, Ричардом Хансоном и Джоном Баллардом, а также одновременно Элеазаром Шафриром и его сотрудниками, которые были заинтригованы присутствием двух ферментов глюконеогенеза пируваткарбоксилазы и фосфоенолпируват (ФЕП)-карбоксикиназы в жировой ткани, где глюкоза не синтезируется. После длительного периода невнимания к столь странному факту интерес к этому метаболическому пути возобновился, при это удалось выявить связь между глицеронеогенезом и поздним диабетом II типа.
Рис. 21-21. Глицеронеогенез. Этот метаболический путь является по существу сокращенной версией глюконеогенеза от пирувата до дигидроксиацетонфосфата, после чего происходит превращение последнего в глицерин-3-фосфат, который используется для синтеза триацилглицеринов.
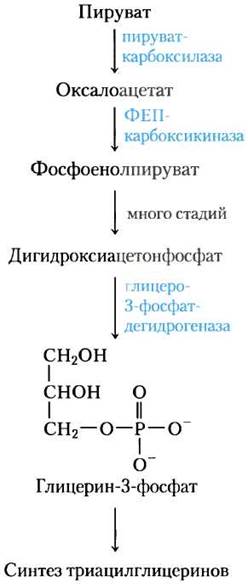
У глицеронеогенеза множество функций. В жировой ткани глицеронеогенез, сопряженный с переэтерификацией жирных кислот, контролирует скорость высвобождения жирных кислот в кровь. В буром жире этот метаболический путь может регулировать скорость, с которой жирные кислоты доставляются в митохондрии для использования в термогенезе (см. рис. 19-34). А у голодающих людей глицеронеогенез в одной только печени обеспечивает синтез глицерин-3-фосфата в количестве, достаточном для того, чтобы до 65% жирных кислот заново этерифицировались с образованием триацилглицеринов.
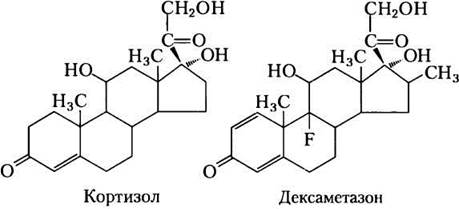
Прохождение по триацилглицериновому циклу между печенью и жировой тканью контролируется в большой степени ФЕП-карбоксилазой, которая ограничивает скорости и глюконеогенеза, и глицеронеогенеза. Глюкокортикоидные гормоны, такие как кортизол (природный стероид, происходящий от холестерина; см. рис. 21-45) и дексаметазон (синтетический глюкокортикоид), регулируют уровни ФЕП-карбоксикиназы в печени и поэтому и в жировой ткани. Действуя через глюкокортикоидный рецептор, эти стероидные гормоны увеличивают экспрессию гена, кодирующего ФЕП-карбоксикиназу в печени, усиливая тем самым глюконеогенез и глицеронеогенез (рис. 21-22).
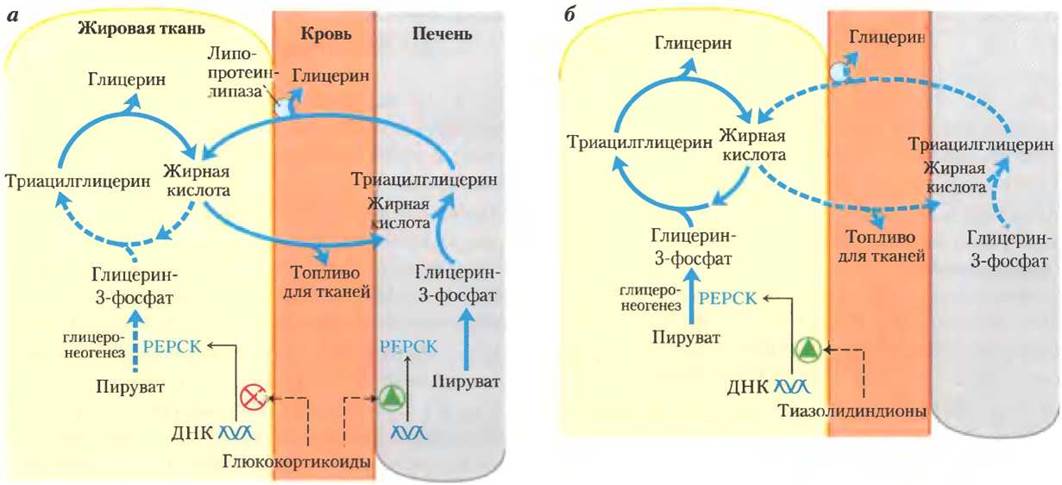
Стимуляция глицеронеогенеза приводит к увеличению синтеза триацилглицеринов в печени и их поступления в кровь. В то же самое время глюкокортикоиды подавляют экспрессию гена, кодирующего ФЕП-карбоксикиназу в жировой ткани. Это приводит к ослаблению глицеронеогенеза в жировой ткани; в результате уменьшается повторное использование жирных кислот, и в кровь высвобождается большее их количество. Таким образом, глицеронеогенез согласованно регулируется в печени и жировой ткани, что влияет на липидный метаболизм противоположным образом: более низкая скорость глицеронеогенеза в жировой ткани ведет к большему высвобождению жирных кислот (не допуская их повторного использования), в то время как повышенная скорость этого процесса в печени вызывает более производительный их синтез и экспорт триацилглицеринов. Суммарный результат заключается в увеличении потока через триацилглицериновый цикл. Когда действие глюкокортикоидов снимается, поток через цикл уменьшается по мере того, как экспрессия ФЕП-карбоксикиназы увеличивается в жировой ткани и уменьшается в печени.
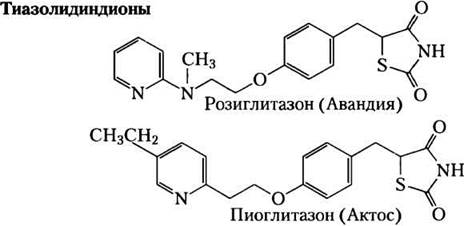
Рис. 21-22. Регуляция глицеронеогенеза. а — глюкокортикоидные гормоны стимулируют глицеронеогенез и глюконеогенез в печени, в то же время подавляя глицеронеогенез в жировой ткани (посредством реципрокной регуляции экспрессии гена ФЕП-карбоксикиназы (РЕРСК) в двух тканях); в результате увеличивается поток через триацилглицериновый цикл. Глицерин, образовавшийся при распаде триацилглицеринов в жировой ткани, выделяется в кровь и транспортируется в печень, где он с помощью глицеринкиназы превращается главным образом в глюкозу, хотя частично конвертируется в глицерин-3-фосфат. б — класс лекарств, называемых тиазолидиндионами, применяется в настоящее время для лечения диабета II типа. При этом заболевании высокий уровень жирных кислот в крови препятствует усвоению глюкозы в мышцах и вызывает резистентность к инсулину. Тиазолидиндионы активируют ядерные рецепторы (с помощью пролифератора пероксисомы — y(РРАКy)), что индуцирует активность ФЕП-карбоксикиназы. Терапевтический эффект обусловлен тем, что тиазолидиндионы увеличивают скорость глицеронеогенеза, усиливая тем самым повторный синтез триацилглицеринов в жировой ткани и уменьшая количество свободных жирных кислот в крови.
Тиазолидиндионы применяют при диабете II типа для увеличения глицеронеогенеза
Недавно привлеченное к глицеронеогене- зу внимание отчасти обусловлено связью между этим метаболическим путем и диабетом. Высокий уровень свободных жирных кислот в крови мешает усвоению глюкозы в мышцах и вызывает индиферентность к инсулину, что приводит к диабету II типа. Оказалось, что лекарства нового поколениятиазолидиндионы понижают уровень жирных кислот в крови и увеличивают чувствительность к инсулину. Тиазолидиндионы связываются с ядерными рецепторами этого гормона (активируется пролифератором пероксисомы — y(РРАRy)) и активируют его, индуцируя ФЕП-карбоксикиназу в жировой ткани (рис. 21-22); повышенная активность ФЕП- карбоксикиназы затем приводит к усиленному синтезу предшественников глицеронеогенеза. Таким образом, терапевтический эффект тиазолидиндионов, по крайней мере частично, обусловлен увеличением глицеронеогенеза, что в свою очередь усиливает повторный синтез триацил-глицеринов в жировой ткани и уменьшает высвобождение свободных жирных кислот из жировой ткани в кровь. Преимущества приема одного из таких препаратов розиглитазона (Авандия), к сожалению, несколько уменьшаются в связи с повышением риска инфаркта миокарда. Причины такого побочного эффекта пока неясны, и изучение действия препарата продолжается. ■
Краткое содержание раздела 21.2 Биосинтез триацилглицеринов
■ Триацилглицерины образуются при взаимодействии двух молекул ацил-СоА жирных кислот с глицерин-3-фосфатом с выделением фосфатидной кислоты; этот продукт дефосфорилируется, давая диацилглицерин, который затем ацилируется третьей молекулой ацил- СоА с образованием триацилглицеринов.
■ Синтез и деградация триацилглицеринов регулируются гормонами.
■ Путем мобилизации и повторного использования триацилглицеринов возникает триацилглицериновый цикл. Триацилглицерины вновь синтезируются из свободных жирных кислот и глицерин-3-фосфата даже в состоянии истощения организма. Дигидроксиаце- тонфосфат — предшественник глицерин-3- фосфата — производится из пирувата путем глицеронеогенеза.