ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
21. БИОСИНТЕЗ ЛИПИДОВ
21.3. Биосинтез мембранных фосфолипидов
В гл. 10 мы представили два главных класса мембранных фосфолипидов: глицерофосфолипиды и сфинголипиды. Можно сконструировать множество различных молекул фосфолипидов, комбинируя разные жирные кислоты и полярные головные группы (полярные «головки») с глицериновой или сфингозиновой основой (см. рис. 10-9, 10-13). Все пути биосинтеза следуют нескольким основным шаблонам. В целом, сборка фосфолипидов из основных предшественников требует (1) синтеза основополагающей (скелетной) молекулы (глицерин или сфингозин); (2) присоединения жирной кислоты (кислот) к скелету через сложноэфирную или амидную связь; (3) присоединения к скелету гидрофильной «головки» фосфодиэфирной связью; и, наконец, в некоторых случаях (4) изменения или замены полярной «головки» с образованием конечного продукта — фосфолипида.
В клетках эукариот синтез фосфолипидов происходит прежде всего на поверхности гладкого эндоплазматического ретикулума и на внутренней мембране митохондрий. Часть вновь синтезированных фосфолипидов остается в месте синтеза, но большинство предназначено для других отделов клетки. Процесс, при котором нерастворимые в воде фосфолипиды передвигаются от места синтеза к месту их последующего функционирования, не вполне понятен, но мы завершим этот раздел обсуждением некоторых механизмов, выясненных в последние годы.
Клетки используют две стратегии присоединения полярных «головок» фосфолипидов
Первые стадии синтеза глицерофосфолипи- дов те же, что при синтезе триацилглицеринов (рис. 21-17): два остатка жирной кислоты образуют сложноэфирные связи при атомах С-1 и С-2 L-глицерин-3-фосфата, давая фосфатидную кислоту. Обычно считают, что при С-1 — насыщенная жирная кислота, а при С-2 — ненасыщенная. Второй путь, приводящий к фосфатидной кислоте, — фосфорилирование диацилглицеринов специфической киназой.
Полярная «головка» глицерофосфолипидов присоединяется фосфодиэфирной связью, при образовании которой каждый из двух спиртовых гидроксилов (один на полярной «головке», а другой на С-3 глицерина) образует сложный эфир с фосфорной кислотой (рис. 21-23). Сначала один из гидроксилов активируется присоединением нуклеотидцитидиндифосфата (CDP). Затем при нуклеофильной атаке другим гидроксилом цити- динмонофосфат (СМР) замещается (рис. 21-24). CDP присоединяется либо к диацилглицерину, образуя активированную фосфатидную кислоту и CDP-диацилглицерин (стратегия 1), либо к гидроксилу «головки» (стратегия 2). Клетки эукариот используют обе стратегии, в то время как прокариоты используют только стратегию 1. Ведущая роль цитидиннуклеотидов в биосинтезе липидов была открыта Юджином Кеннеди в начале 1960-х гг.
Юджин П. Кеннеди

Рис. 21-23. Присоединение полярной «головки». Полярная «головка» в фосфолипиде присоединяет диацилглицерин фосфодиэфирной связью при конденсации фосфорной кислоты с двумя спиртовыми группами (две молекулы Н2O отщепляются).
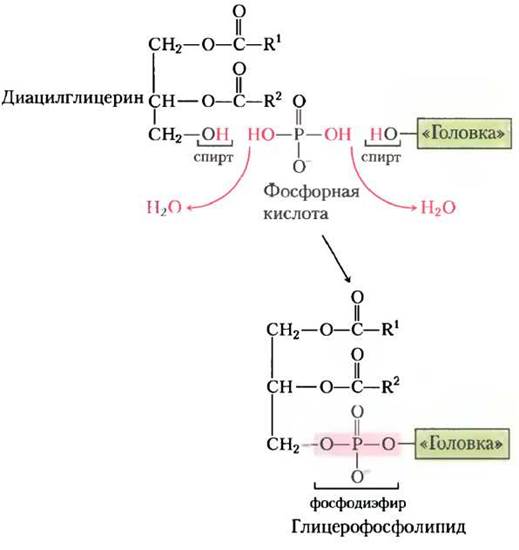
Рис. 21-24. Две главные стратегии образования фосфодиэфирной связи в фосфолипидах. В обеих стратегиях фосфатную группу для фосфодиэфирной связи предоставляет СDР.

Для синтеза фосфолипидов у Е. coli служат CDP-диацилглицерины
Первую стратегию присоединения полярной «головки» иллюстрирует синтез фосфатидилсерина, фосфатидилэтаноламина и фосфатидил- глицерина у Е. coli. Диацилглицерин активируется при конденсации фосфатидной кислоты цитидинтрифосфатом (СТР) с образованием CDP-диацилглицерина, при этом отщепляется пирофосфат (рис. 21-25). Замещение СМР путем нуклеофильной атаки гидроксильной группой серина или гидроксильной группой при С-1 глицерин-3-фосфата дает фосфатидилсерин или фосфатидилглицерин-3-фосфат соответственно. Продукт подвергается дальнейшему превращению путем расщепления фосфатного моноэфира (с высвобождением Рi), образуя фосфатидил-глицерин.
Фосфатидилсерин и фосфатидилглицерин могут служить предшественниками других мембранных липидов у бактерий (рис. 21-25). Декарбоксилирование серинового остатка фосфатидилсерина, катализируемое фосфатидилсериндекарбоксилазой, приводит к фосфатидил- этаноламину. У Е. coli конденсация двух молекул фосфатидилглицерина, сопровождаемая отщеплением глицерина, дает кардиолипин, в котором два диацилглицерина соединены через общую полярную «головку».
Эукариоты синтезируют анионные фосфолипиды из CDP-диацилглицеринов
У эукариот фосфатидилглицерин, кардиолипин и фосфатидилинозит (все анионные фосфолипиды; см. рис. 10-9, т. 1) синтезируются по той же стратегии, по которой осуществляется синтез фосфолипидов у бактерий. Фосфатидилглицерин образуется в точности так же, как у бактерий. Синтез кардиолипина у эукариот слегка отличается: фосфатидилглицерин конденсируется с CDP-диацилглицерином (рис. 21-26), а не с другой молекулой фосфатидилглицерина, как в случае Е. coli (рис. 21-25).
Фосфатидилинозит синтезируется путем конденсации CDP-диацилглицерина с инозитом (рис. 21-26). Специфические фосфатидилинозиткиназы затем превращают фосфатидилинозит в его фосфорилированные производные (см. рис. 10-17, т. 1). Фосфатидилинозит и его фосфорилированные продукты в плазматической мембране эукариот играют центральную роль в передаче сигналов (см. рис. 12-10,12-16, т. 1).
Рис. 21-25. Образование полярных «головок» фосфолипидов у Е. coli. Сначала при присоединении полярной «головки» (серин или глицерин-3-фосфат) образуется CDP-диацилглицериновый интермедиат (стратегия 1 на рис. 21-24). У всех фосфолипидов, кроме фосфатидил- серина, полярная «головка» подвергается дальнейшей модификации, как показано здесь. PG — фосфатидил- глицерин, PS — фосфатидилсерин.

Рис. 21-26. Синтез кардиолипина и фосфатидилинозита у эукариот. Эти глицерофосфолипиды синтезируются по стратегии 1 (рис. 21-24). Фосфатидилглицерин синтезируется так же, как у бактерий (см. рис. 21-25). РI — фосфатидилинозит.

У эукариот метаболические пути образования фосфатидилсерина, фосфатидилэтаноламина и фосфатидилхолина взаимосвязаны
Дрожжи, подобно бактериям, могут производить фосфатидилсерин путем конденсации CDP-диацилглицерина и серина, а также могут синтезировать фосфатидилэтаноламин из фосфатидилсерина по реакции, катализируемой фосфатидилсериндекарбоксилазой (рис. 21-27). В клетках млекопитающих альтернативным путем образования фосфатидилсерина являются обменные реакции полярной «головки», когда свободный серин замещает этаноламин. Фосфатидилэтаноламин может также превращаться вфосфатидилхолин (лецитин) путем присоединения трех метальных групп к аминогруппе; донором метальных групп для всех трех реакций метилирования служит S-аденозилметионин (см. рис. 18-18). Это основные пути получения фосфатидилэтаноламина и фосфатидилхолина в клетках эукариот.
Рис. 21-27. Главный метаболический путь от фосфатидилсерина к фосфатидилэтаноламину и фосфатидилхолину у всех эукариот. А (AdoMet — S-аденозилметионин; adoHcy — S-аденозилгокоцистеин.

У млекопитающих фосфатидилсерин синтезируется не из CDP-диацилглицерина — он получается из фосфатидилэтаноламина в обменной реакции (рис. 21-28, а). Синтез фосфатидилэтаноламина и фосфатидилхолина у млекопитающих происходит по стратегии 2 (рис. 21-24): фосфорилирование и активация головной группы, после чего следует конденсация с диацилглицерином. Например, холин вновь используется («реутилизируется») благодаря фосфорилированию и последующему превращению в CDP-холин путем конденсации с СТР. Диацилглицерин вытесняет СМР из CDP-холина, продуцируя фосфатидилхолин (рис. 21-28, б). Аналогичный метаболический путь реутилизации превращает этаноламин, полученный с пищей, в фосфатидилэтаноламин. Фосфатидил-холин образуется в печени также при метилировании фосфатидилэтаноламина (с помощью 8-аденозилметионина, как было описано выше), но во всех других тканях — только при конденсации диацилглицерина и СDР-холина. Метаболические пути образования фосфатидилхолина и фосфатидилэтаноламина у разных организмов обобщены на рис. 21-29.
Рис. 21-28. Пути синтеза фосфатидилсерина и фосфатидил- холина у млекопитающих, а — фосфатидилсерин синтезируется в обменной Са2+-зависимой реакции, катализируемой фосфатидилсеринсинтазой 1 (РSS2) или фосфатидилсерин- синтазой 2 (РSS2). Фермент первого типа использует в качестве субстрата фосфатидилэтаноламин или фосфатидилхолин. Метаболические пути у бактерий и дрожжей соответствуют рис. 21-27. б — та же стратегия, что продемонстрирована для синтеза фосфатидилхолина (стратегия 2 на рис. 21-24), используется и для усвоения этаноламина в синтезе фосфатидил- этаноламина.

Пока не до конца понятно, каково влияние липидного состава на функции мембран, однако установлено, что этот фактор может оказывать серьезные эффекты. Исследователи получили плодовых мушек с мутациями в гене, который кодирует этаноламинкиназу (аналогична холинкиназе; рис. 21-28, б). Недостаток этого фермента выключает один из путей синтеза фосфатидилэтаноламина, уменьшая таким образом количество этого липида в клеточных мембранах. У мушек с такой мутацией (легко стрес- сируемый генотип) наблюдается временный паралич после электрической стимуляции или механического шока, хотя эти воздействия на дикий тип не влияют.
Рис. 21-29. Общая схема путей синтеза основных фосфолипидов. У организмов различных классов метаболические пути синтеза фосфолипидов различаются. Метаболические пути млекопитающих выделены желтым цветом, а те, что используются бактериями и дрожжами, выделены розовым. Оранжевым обозначены зоны перекрывания путей. У млекопитающих фосфатидилэтаноламин и фосфатидилхолин синтезируются из диацилглицеринов и подходящей группы СDР-производного «головки». Превращение фосфатидилэтаноламина в фосфатидилхолин у млекопитающих происходит исключительно в печени. Пути синтеза фосфатидилсерина у организмов различных классов подробно проиллюстрированы на рис. 21-27 и 21-28.

Синтез плазмалогенов требует образования связанного простой эфирной связью жирного спирта
Метаболический путь биосинтеза эфирных липидов, в том числе плазмалогенов и фактора активации тромбоцитов (см. рис. 10-10, т. 1), включает замещение этерифицированной жирноацильной группы на длинноцепочечный спирт с образованием простой эфирной связи (рис. 21-30). За этим следует присоединение головной группы по механизму, очень похожему на механизм образования обычных фосфолипидов со сложноэфирной связью. Наконец, характерная двойная связь в плазмалогенах (выделена голубым на рис. 21-30) вводится действием оксидазы со смешанной функцией, сходной с оксидазой десатурации жирных кислот (рис. 21-13). Пероксисомы являются главным участком синтеза плазмалогенов.
Рис. 21-30. Синтез эфирных липидов и плазмалогенов. Вновь образуемая простая эфирная связь выделена розовым цветом. Интермедиат 1-алкил-2-ацилглицерин- 3-фосфат — простой эфир фосфатидной кислоты. Механизмы присоединения полярных «головок» к эфирным липидам в целом те же, что и для их аналогов со сложноэфирной связью. Характерная двойная связь в плазмалогенах (выделена голубым) вводится на конечной стадии с помощью системы оксидазы со смешанной функцией, сходной с показанной на рис. 21-13.

В синтезах сфинголипидов и глицерофосфолипидов некоторые предшественники и некоторые механизмы общие
Биосинтез сфинголипидов происходит в четыре стадии: (1) синтез 18-углеродного амина сфинганина из пальмитоил-СоА и серина; (2) присоединение жирной кислоты через амидную связь с образованием N-ацилсфинганина; (3) десатурация сфинганиновой части с образованием N-ацилсфингозина (церамида); и (4) присоединение «головки» с образованием сфинголипида цереброзида или сфингомиелина (рис. 21-31). Первые стадии происходят в эндоплазматическом ретикулуме, а прикрепление «головки» (стадия 4) — в аппарате Гольджи.
Рис. 21-31. Биосинтез сфинголипидов. Конденсация пальмитоил-СоА и серина (с образованием β-кетосфинганина), сопровождаемая восстановлением с помощью NADРН, дает сфинганин, который затем ацилируется с образованием N-ацилсфинганина (церамида). У животных двойная связь (выделена розовым) образуется действием оксидазы со смешанной функцией, а в конце присоединяется полярная «головка»: фосфатидилхолин — при образовании сфингомиелина; глюкоза — при образовании цереброзида.
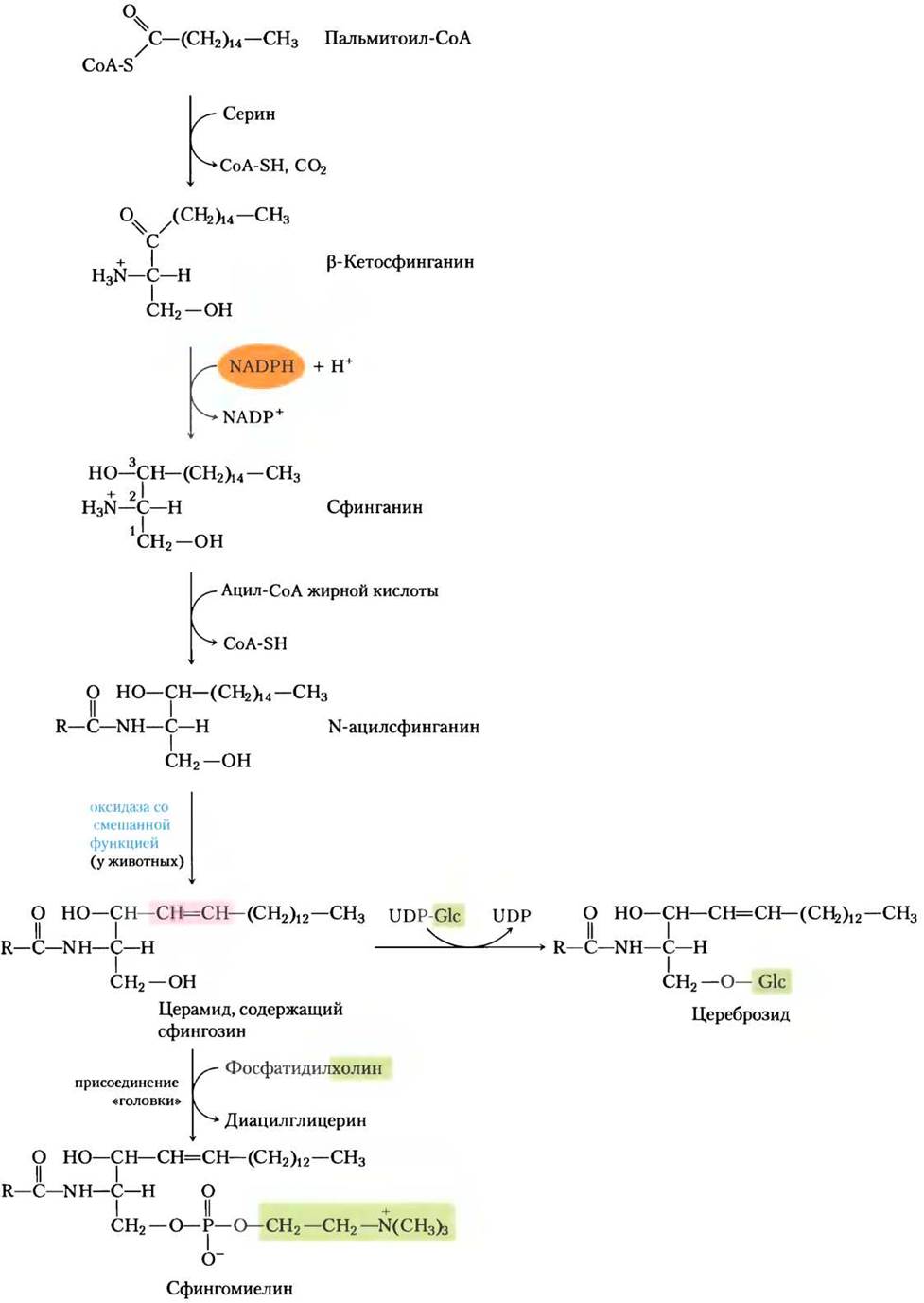
Этот метаболический путь имеет несколько особенностей, как и пути, ведущие к синтезу глицерофосфолипидов: восстанавливающую способность, обеспечивает NАDРН, а жирные кислоты вводятся в виде активированных СоА- производных. При образовании цереброзида сахара вводятся в виде активированных нуклеотидных производных. Выявлено несколько новых аспектов присоединения полярной «головки» при синтезе сфинголипидов. Скорее всего, фосфатидилхолин, а не СDР-холин служит донором фосфохолина при синтезе сфингомиелина.
В гликолипидах, цереброзидах и ганглиозидах (см. рис. 10-12, т. 1) сахар «головки» связывается непосредственно с гидроксилом при С-1 сфингозина, причем более вероятно, что образуется гликозидная связь, чем фосфодиэфирная. Донором сахара выступает UDР-сахар (UDР-глюкоза или UDР-галактоза).
Полярные липиды локализуются в специальных клеточных мембранах
После синтеза на гладком эндоплазматическом ретикулуме (ЭР) полярные липиды, в том числе глицерофосфолипиды, сфинголипиды и гликолипиды, включаются в специфические клеточные мембраны в определенных соотношениях по непонятным до сих пор механизмам. Мембранные липиды нерастворимы в воде, так что они не могут просто диффундировать от места их синтеза (ЭР) к месту внедрения в мембрану. Они поступают в мембранные пузырьки, которые отпочковываются от комплекса Гольджи, затем перемещаются и сливаются с мембраной-мишенью (см. рис. 11-22, т. 1). Нельзя сказать, что все детали этих метаболических путей полностью известны, хотя многое уже прояснилось. Белок с молекулярной массой 68 кДа, названный CERT (от англ. ceramide transport), переносит церамид от эндоплазматического ретикулума к аппарату Гольджи.
Цитозольные белки также связывают фосфолипиды и стерины и переносят их между клеточными мембранами, благодаря всем этим механизмам мембраны разных органелл имеют характерный для них липидный состав (см. рис. 11-2, т. 1).
Краткое содержание раздела 21.3 Биосинтез мембранных фосфолипидов
■ Диацилглицерины — главные предшественники глицерофосфолипидов.
■ У бактерий фосфатидилсерин образуется путем конденсации серина с СDР-диацилглицерином; при декарбоксилировании фосфатидилсерина получается фосфатидилэтаноламин. Фосфатидилглицерин образуется при конденсации СDР-диацил глицерина с глицерин-3-фосфатом, после чего следует отщепление фосфата от сложноэфирной связи.
■ У дрожжей пути синтеза фосфатидилсерина, фосфатидилэтаноламина и фосфатидилглицерина похожи на пути у бактерий; фосфатидилхолин образуется путем метилирования фосфатидилэтаноламина.
■ В клетках млекопитающих существуют некоторые пути, сходные с бактериальными, но пути синтеза фосфатидилхолина и фосфатидилэтаноламина до некоторой степени отличаются. Спирт головной группы (холин или этаноламин) активируется в виде СDР-производного, затем конденсируется с диацилглицерином. Фосфатидилсерин получается только из фосфатидилэтаноламина.
■ Синтез плазмалогенов включает образование характерной для них двойной связи с помощью оксидазы со смешанной функцией. Головные группы сфинголипидов присоединяются посредством специфических механизмов.
■ Фосфолипиды перемещаются к местам их назначения внутри клетки в виде транспортных везикул или с помощью специфических белков.