ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
21. БИОСИНТЕЗ ЛИПИДОВ
21.4. Биосинтез холестерина, стероидов и изопреноидов
Без сомнения, холестерин — наиболее известный широкой публике липид; он пользуется дурной славой из-за высокой корреляции между повышенным уровнем холестерина в крови и частотой сердечно-сосудистых заболеваний человека. Меньшее внимание привлечено к решающей роли холестерина как компонента клеточных мембран и как предшественника стероидных гормонов и желчных кислот. Холестерин необходим многим животным, в том числе человеку, но его наличие в пище млекопитающих необязательно — клетки организма сами могут синтезировать его из простых предшественников.
Структура этого 27-углеродного соединения дает основание предположить сложный путь его биосинтеза, однако все его углеродные атомы предоставлены единственным предшественником — ацетатом. Изопреновые блоки — самые главные интермедиаты на пути от ацетата до холестерина, они являются предшественниками многих природных липидов, и механизмы, по которым полимеризуются изопреновые блоки, похожи во всех метаболических путях.
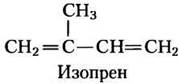
Начнем с рассмотрения главных стадий на пути биосинтеза холестерина из ацетата, затем обсудим транспорт холестерина по кровотоку, поглощение его клетками, нормальную регуляцию синтеза холестерина и регуляцию при нарушениях его захвата или транспорта. Затем мы рассмотрим другие вещества, которые происходят от холестерина, такие как желчные кислоты и стероидные гормоны. Наконец, описание биосинтетических путей образования многих соединений — производных изопреновых блоков, в которых есть общие ранние стадии с синтезом холестерина, проиллюстрирует необычайную универсальность изопреноидной конденсации в биосинтезе.
Холестерин производится из ацетил-СоА в четыре стадии
Холестерин, подобно длинноцепочечным жирным кислотам, производится из ацетил-СоА, но схема сборки совершенно иная. В первых опытах в корм животных добавляли ацетат, меченный 14С либо по метильному, либо по карбоксильному атому углерода. На основе распределения метки в холестерине, выделенном из двух групп животных (рис. 21-32), были описаны ферментативные стадии биосинтеза холестерина.
Рис. 21-32. Источник углеродных атомов холестерина. Выявлено в ходе экспериментов с использованием радиоактивного ацетата с меткой по метильному углероду (черный цвет) или углероду карбоксила (красный). В конденсированной структуре кольца обозначены буквами от А до D.
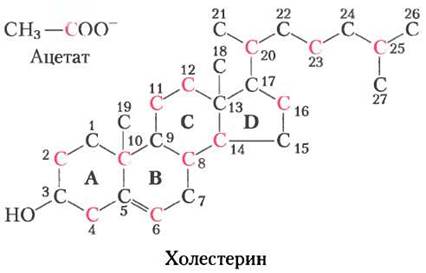
Синтез происходит в четыре стадии, как показано на рис. 21-33: (1) конденсация трех ацетатных остатков с образованием шестиуглеродного интермедиата мевалоната; (2) превращение мевалоната в активированные изопреновые блоки; (3) полимеризация шести пятиуглеродных изопреновых единиц с образованием 30-углеродного линейного сквалена; (4) циклизация сквалена с образованием четырех колец стероидного ядра, после чего следует серия изменений (окисление, удаление или миграция метальных групп) с образованием холестерина.
Рис. 21-33. Обобщенная картина биосинтеза холестерина. Четыре стадии синтеза обсуждаются в тексте. Изопреновые блоки в сквалене отмечены красными штриховыми линиями.
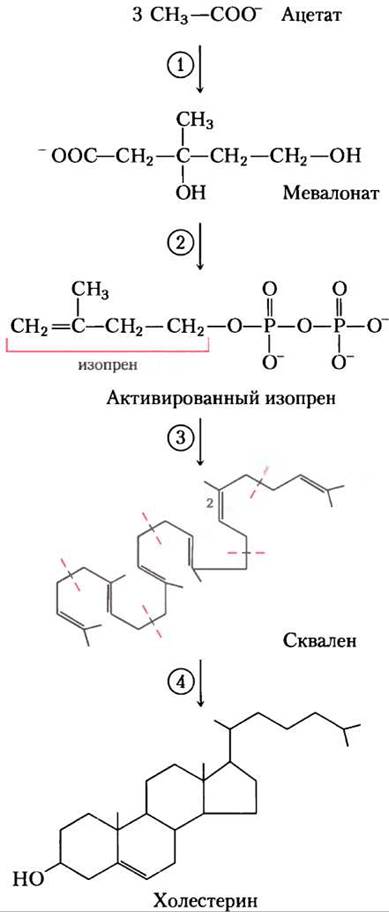
Стадия (1). Синтез мевалоната из ацетата. Первая стадия биосинтеза холестерина приводит к образованию промежуточного продукта мевалоната (рис. 21-34). Две молекулы ацетил-СоА конденсируются, давая ацетоацетил-СоА, который конденсируется с третьей молекулой ацетил-СоА с образованием шестиуглеродного соединения β-гидрокси-β-метилглутарил-СоА (НМG-СоА). Эти две первые реакции катализируются тиолазой и НМG-СоА-синтазой соответственно. Цитозольная НМG-СоА-синтаза этого метаболического пути отличается от митохондриального изофермента, который катализирует синтез НМG-СоА при образовании кетоновых тел (см. рис. 17-18).
Рис. 21-34. Образование мевалоната из ацетил-СоА. Источник С-1 и С-2 мевалоната из ацетил-СоА выделен розовым цветом.
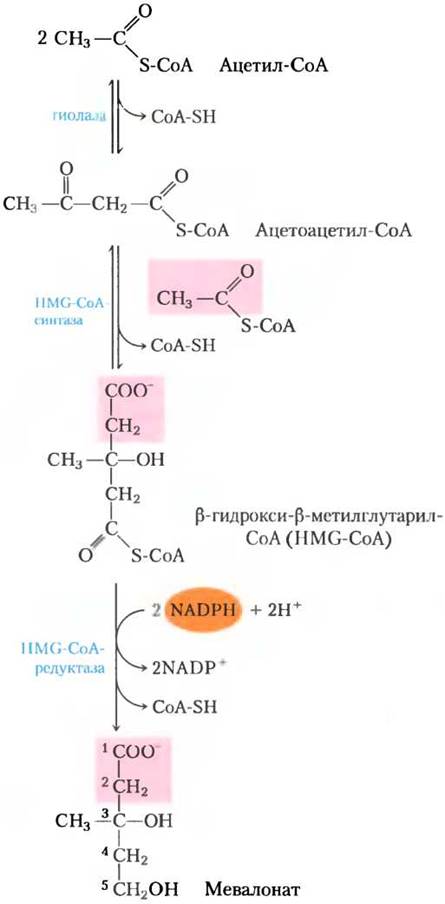
Третья реакция лимитирует скорость всего процесса. В ней происходит восстановление НМG-СоА до мевалоната, для которого каждая из двух молекул NАDРН предоставляет два электрона. HMG-СоА-редуктаза — интегральный мембранный белок гладкого ЭР; он служит, как мы увидим далее, главным пунктом регуляции метаболического пути образования холестерина.
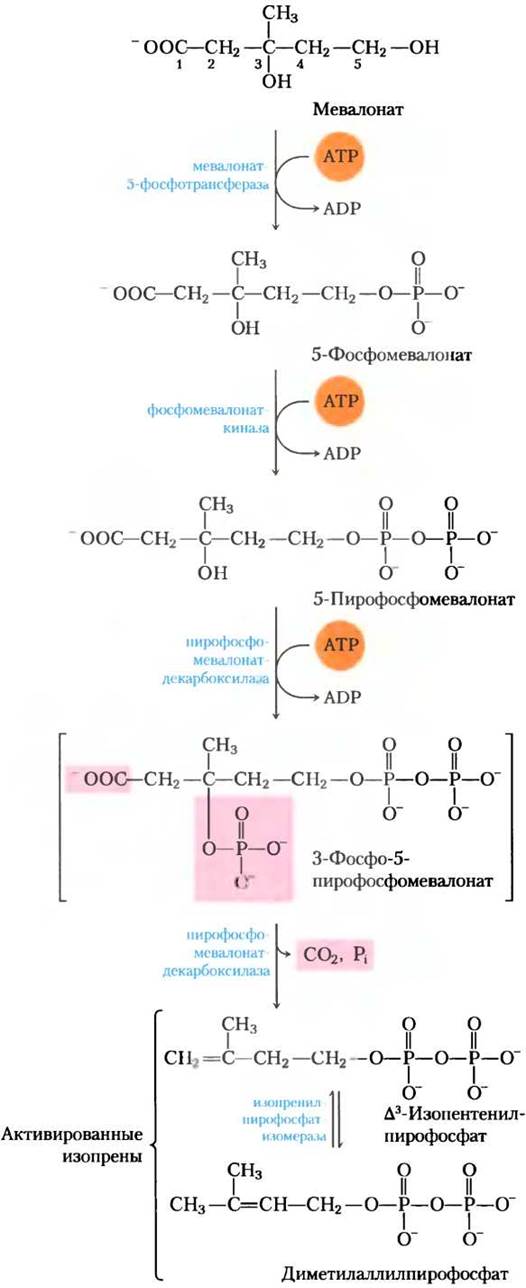
Стадия (2). Превращение мевалоната в два активированных изопрена. На следующей стадии синтеза холестерина с молекул АТР на мевалонат переносятся три фосфатные группы (рис. 21-35). Фосфат, связанный с гидроксильной группой при С-3 мевалоната в интермедиате 3-фосфо-5- пирофосфомевалонате, является хорошей уходящей группой; на следующей стадии уходят оба этих фосфата и прилежащая карбоксильная группа, образуя двойную связь в пятиуглеродном продукте ∆3-изопентенилпирофосфате. Это первый из двух активированных изопренов — главных участников синтеза холестерина. Изомеризация ∆3-изопентенилпирофосфата дает второй активированный изопрен диметилаллилпирофосфат. Синтез изопентенилпирофосфата в цитоплазме растительных клеток происходит по описанному здесь пути. Однако хлоропласты растений и многие бактерии используют независимый от мевалоната путь. Этот альтернативный путь не встречается у животных, поэтому он привлекателен при создании новых антибиотиков.
Рис. 21-35. Превращение мевалоната в активированные изопреновые блоки. Шесть активированных единиц объединяются, образуя сквален (см. рис. 21-36). Уходящие группы 3-фосфо-5-пирофосфомевалоната выделены розовым. В квадратных скобках — гипотетический интермедиат.
Стадия (3). Конденсация шести активированных изопреновых единиц с образованием сквалена. Изопентенилпирофосфат и диметилаллилпирофосфат претерпевают теперь конденсацию «голова к хвосту», при которой одна пирофосфатная группа перемещается и образуется 10-углеродная цепь — геранилпирофосфат (рис. 21-36). (Пирофосфат присоединяется к «голове».) Геранилпирофосфат подвергается следующей конденсации «голова к хвосту» с изопентенилпирофосфатом, при этом образуется 15-углеродный интермедиат фарнезилпирофосфат. Наконец, две молекулы фарнезилпирофосфата соединяются «голова к голове», обе фосфатные группы удаляются — образуется сквален.
Рис. 21-36. Образование сквалена. Структура сквалена, содержащая 30 атомов углерода, возникает при последовательных конденсациях, активированных изопреновых (пятиуглеродных) блоков.
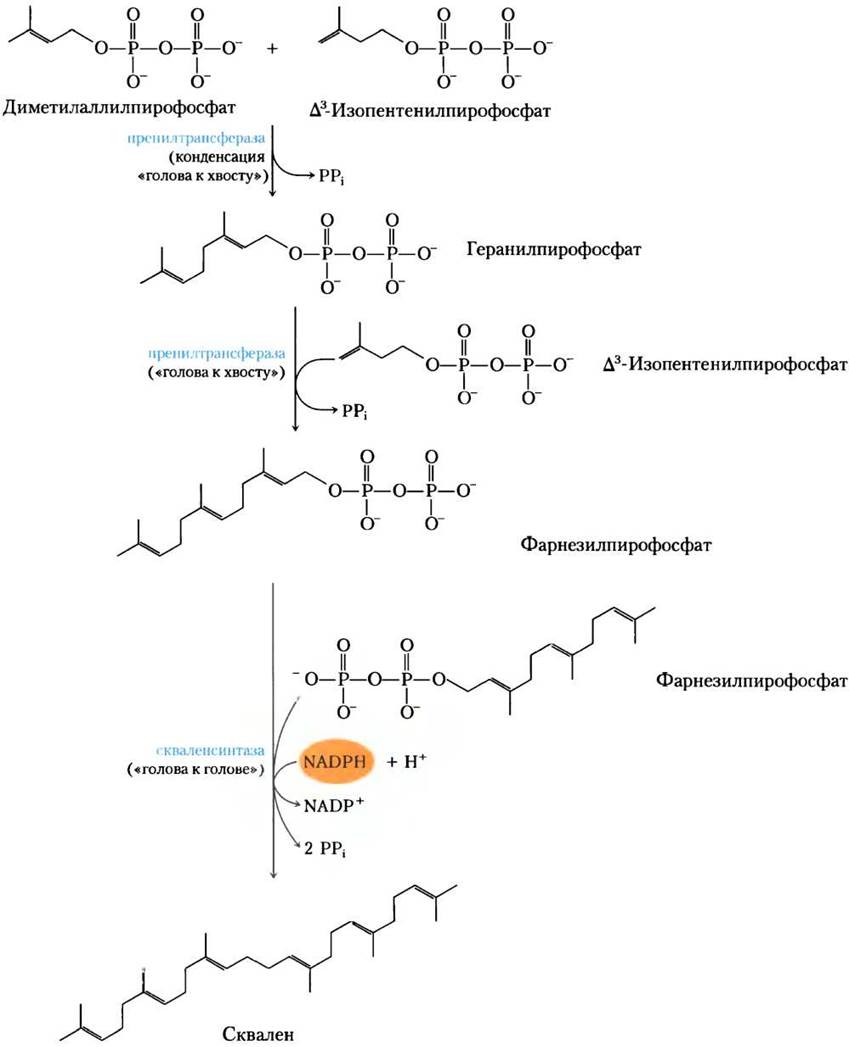
Общепринятые названия этих промежуточных продуктов происходят от названий тех источников, откуда они были впервые выделены. Гераниол, компонент розового масла, имеет аромат герани, а фарнезол, найденный в цветах акации Фарнеза, — аромат ландыша. Многие природные запахи растительного происхождения принадлежат соединениям, построенным из изопреновых блоков. Сквален, впервые выделенный из печени акулы (вида Squalus), состоит из 30 атомов углерода: 24 атома в главной цепи и шесть атомов в метальных заместителях.
Стадия (4). Превращение сквалена в четыре кольца стероидного ядра. На рис. 21-37 ясно видно, что у сквалена цепочечная структура, а у стеринов — циклическая. Все стерины имеют четыре конденсированных кольца, которые образуют стероидное ядро, и все они — спирты с гидроксильной группой при атоме С-3; отсюда английское название sterol. При действии скваленмонооксигеназы к концу цепи сквалена добавляется один атом кислорода из O2 и образуется эпоксид. Этот фермент представляет собой еще одну оксидазу со смешанной функцией (доп. 21-1); NADPH восстанавливает другой кислородный атом из O2 до Н2O. Двойные связи продукта сквален-2,3-эпоксида расположены таким образом, что замечательно согласованная реакция может превратить цепочечный сквален- эпоксид в циклическую структуру. В животных клетках эта циклизация приводит к образованию ланостерина, который содержит четыре кольца, характерные для стероидного ядра. В итоге ланостерин превращается в холестерин посредством серии примерно из 20 реакций, которая включает миграцию одних метальных групп и удаление других. Описание этого удивительного пути биосинтеза, одного из самых сложных среди известных, было сделано Конрадом Блохом, Феодором Линеном, Джоном Корнфортом и Джорджем Попьяком в конце 1950-х гг.
Рис. 21-37. Замыкание кольца превращает линейный сквален в конденсированное стероидное ядро. Первая стадия катализируется оксидазой со смешанной функцией (монооксигеназой), косубстрат которой — NADPH. Продукт — эпоксид, который на следующей стадии циклизуется с образованием стероидного ядра. Конечный продукт этих реакций в животных клетках — холестерин; у других организмов образуются слегка отличные от него стерины.
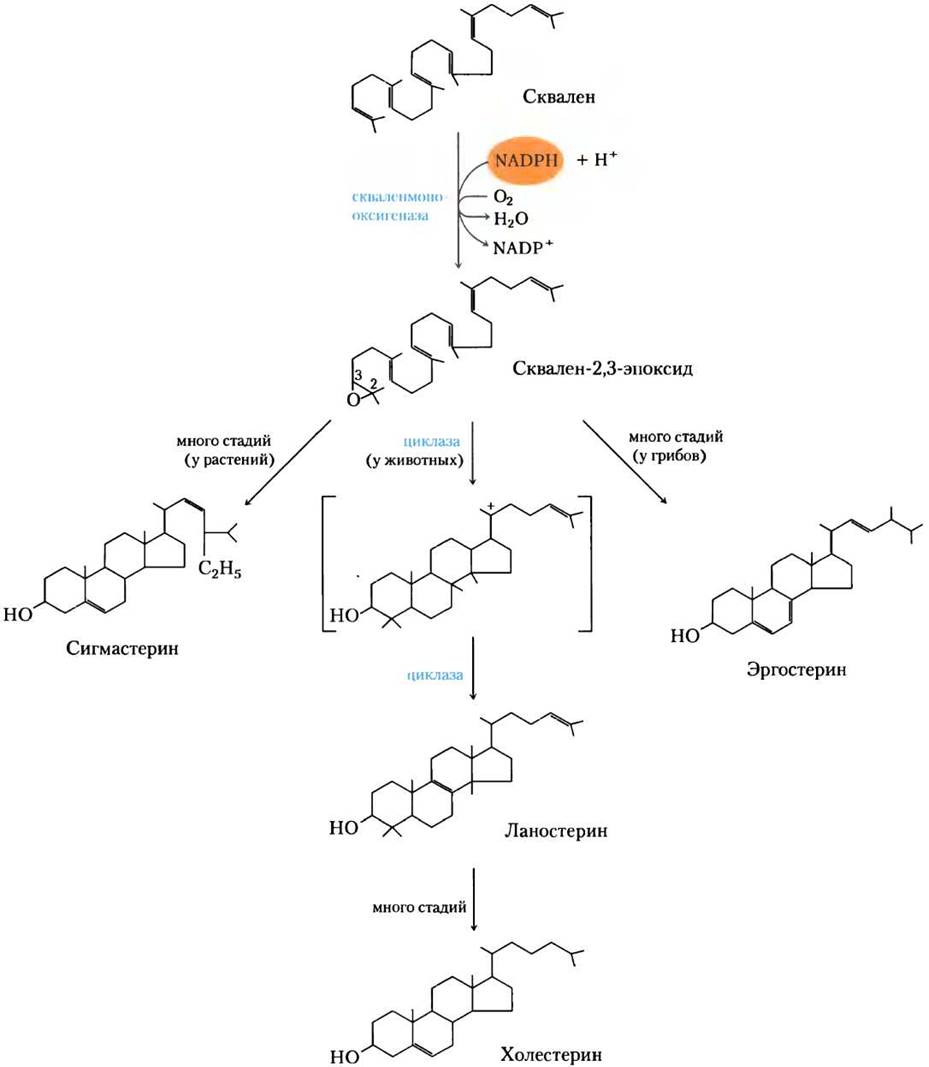

Холестерин — стерин, характерный для животных клеток; растения, грибы и протисты производят другие очень похожие стерины.
Они используют тот же самый путь синтеза до сквален-2,3-эпоксида, но затем пути слегка расходятся, при этом образуются другие стерины, такие как сигмастерин у многих растений и эргостерин у грибов (рис. 21-37).
Пример 21-1 Энергетические затраты при синтезе сквалена
Каковы энергетические затраты (выраженные в числе молекул АТР) на синтез одной молекулы сквалена?
Решение. При синтезе сквалена из ацетил-СоА АТР затрачивается лишь на той стадии, когда мевалонат превращается в активированный изопреновый предшественник сквалена. Для построения молекулы сквалена нужно шесть активированных молекул изопрена, а для получения каждой активированной молекулы требуется три молекулы АТР. Итого, на синтез одной молекулы сквалена затрачивается 18 молекул АТР.
Соединения холестерина в организме
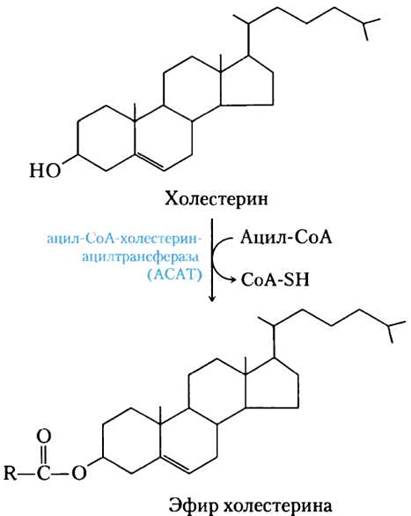
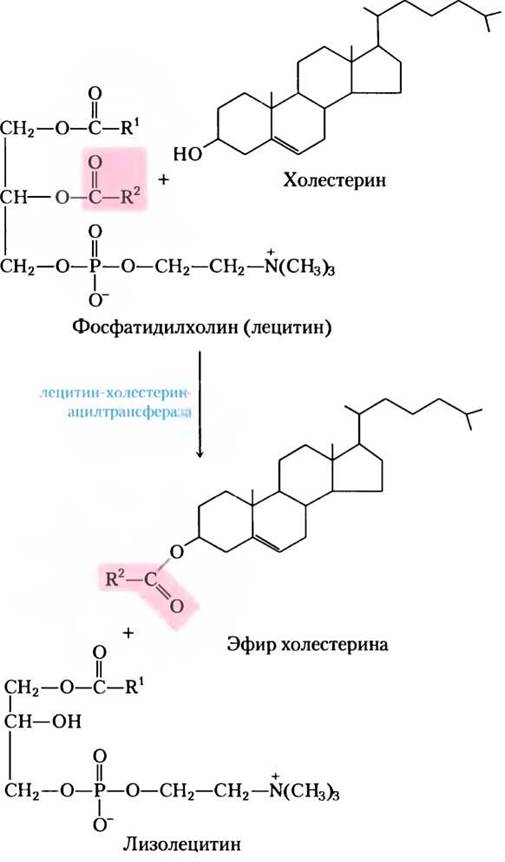
У позвоночных большие количества холестерина синтезируются в печени. Некоторая часть синтезированного там холестерина включается в мембраны гепатоцитов, но в основном он экспортируется в виде одной из трех своих форм: билиарного (желчного) холестерина, желчных кислот или эфиров холестерина. Желчные кислоты и их соли — гидрофильные производные холестерина, которые синтезируются в печени и способствуют перевариванию липидов (см. рис. 17-1). Эфиры холестерина образуются в печени при действии ацил-СоА-холестерин- ацилтрансферазы (АСАТ). Этот фермент катализирует перенос остатка жирной кислоты от кофермента А к гидроксильной группе холестерина (рис. 21-38), превращая холестерин в более гидрофобную форму. Эфиры холестерина в секретируемых липопротеиновых частицах транспортируются в другие ткани, использующие холестерин, или хранятся в печени.
Рис. 21-38. Синтез эфиров холестерина. Этерификация превращает холестерин в еще более гидрофобную форму для хранения и транспорта.
Холестерин необходим всем тканям растущего организма животных для синтеза мембран, а некоторые органы (например, надпочечники и половые железы) используют холестерин в качестве предшественника стероидных гормонов (об этом речь пойдет ниже). Холестерин также является предшественником витамина D (см. рис. 10-20, т. 1).
Холестерин и другие липиды переносят липопротеины плазмы крови
Холестерин и эфиры холестерина, подобно триацилглицеринам и фосфолипидам, практически нерастворимы в воде, тем не менее они должны перемещаться от ткани, в которой были синтезированы, к тканям, где они будут сохраняться или потребляться. Они переносятся кровотоком в виде липопротеинов плазмы крови — макромолекулярных комплексов специфических белков- переносчиков (аполипопротеинов) с фосфолипидами, холестерином, эфирами холестерина и триацилглицеринами, присутствующими в этих комплексах в различной комбинации.
Аполипопротеины («апо» обозначает сам белок без липида) соединяются с липидами, образуя несколько фракций липопротеиновых частиц — сферических комплексов с гидрофобными липидами в центре и гидрофильными аминокислотными цепями на поверхности (рис. 21-39, а). При различных комбинациях липидов и белков образуются частицы разной плотности — от хиломикронов до липопротеинов высокой плотности. Эти частицы можно разделить ультрацентрифугированием (табл. 21-1) и визуально наблюдать с помощью электронной микроскопии (рис. 21-39, б). Каждая фракция липопротеинов выполняет специфическую функцию, которая определяется местом синтеза, составом липидов и содержанием аполипопротеина. В плазме крови человека обнаружены по крайней мере 10 различных аполипопротеинов (табл. 21-2), различающихся по размеру, реакциям со специфическими антителами и характерному распределению в липопротеинах разных классов. Эти белковые компоненты работают как сигнальные вещества, направляющие липопротеины к специфическим тканям или активирующие ферменты, которые действуют на липопротеины.
Таблица 21-1. Липопротеины плазмы крови человека
Состав (массовая доля, %) |
||||||
Липопротеины |
Плотность (г/мл) |
Белок |
Фосфолипиды |
Свободный холестерин |
Эфиры холестерина |
Триацилглицерины |
Хиломикроны |
<1,006 |
2 |
9 |
1 |
3 |
85 |
ЛПОНП |
0,95-1,006 |
10 |
18 |
7 |
12 |
50 |
ЛПНП |
1,006-1,063 |
23 |
20 |
8 |
37 |
10 |
ЛПВП |
1,063-1,210 |
55 |
24 |
2 |
15 |
4 |
Рис. 21-39. Липопротеины, а — структура липопротеина низкой плотности (ЛПНП). Аполипопротеин В-100 (ароВ-100) — это одна из самых длинных известных молекул, в которой 4636 аминокислотных остатков образуют одну полипептидную цепь (Мr = 513 000). В частице ЛПНП имеется ядро приблизительно из 1500 молекул эфиров холестерина, вокруг ядра — оболочка из 500 молекул холестерина, 800 молекул фосфолипидов и одной молекулы ароВ-100. б — четыре класса липопротеинов, видимые с помощью электронного микроскопа (после проявления негатива). По часовой стрелке, начиная с верхнего левого рисунка: хиломикроны — диаметром от 50 до 200 нм; ЛПOНП — от 28 до 70 нм; ЛПВП — от 8 до 11 нм; и ЛПНП — от 20 до 55 нм. Свойства липопротеинов даны в табл. 21-2.
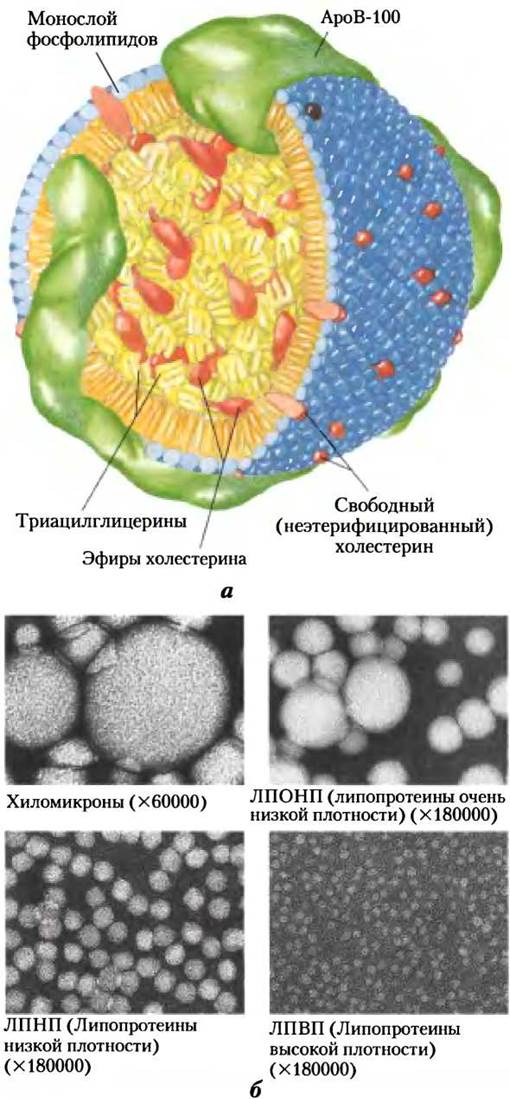
Хиломикроны, о которых шла речь в гл. 17, перемещают триацилглицерины пищи из кишечника в другие ткани. Это самые крупные липопротеины, они имеют наименьшую плотность и высокое относительное содержание триацилглицеринов (см. рис. 17-2). Хиломикроны синтезируются в ЭР эпителиальных клеток, выстилающих тонкий кишечник, затем перемещаются по лимфатической системе и попадают в кровяное русло через левую подключичную вену. Аполипопротеины хиломикронов содержат ароВ-48 (уникальный для этого класса липопротеинов), ароЕ и ароС-II (табл. 21-2). АроС-II активирует липопротеинлипазу в капиллярах жировой ткани, сердца, скелетных мышц и лактирующей молочной железы, обеспечивая поступление свободных жирных кислот в эти ткани. Таким образом, хиломикроны переносят жирные кислоты пищи к тканям, где они будут потребляться или храниться как топливо (рис. 21 -40). Остатки хиломикронов (в основном освобожденные от триацилглицеринов, но еще содержащие холестерин, ароЕ и ароВ-48) транспортируются кровотоком к печени. В печени рецепторы связываются с ароЕ, содержащимся в остатках хиломикронов, и опосредуют их поглощение путем эндоцитоза. В гепатоцитах эти остатки высвобождают содержащийся в них холестерин и в лизосомах разрушаются.
Таблица 21-2. Аполипопротеины липопротеинов плазмы крови человека
Аполипопротеин |
Молекулярная масса |
Липопротеиновый комплекс |
Функция (если известна) |
АроА-I |
28 331 |
ЛПВП |
Активирует LСАТ; взаимодействует с АВС-транспортером |
АроА-II |
17 380 |
ЛПВП |
Ингибирует LСАТ |
АроА-IV |
44 000 |
Хиломикроны, ЛПВП |
Активирует LСАТ; транспорт холестерина/клиренс |
АроВ-48 |
240 000 |
Хиломикроны |
Транспорт холестерина/клиренс |
АроВ-100 |
513 000 |
ЛПОНП, ЛПНП |
Связывается с рецептором ЛПНП |
АроС-I |
7 000 |
ЛПОНП, ЛПВП |
|
АроС-II |
8 837 |
Хиломикроны, ЛПОНП, ЛПВП |
Активирует липопротеинлипазу |
АроС-III |
8 751 |
Хиломикроны, ЛПОНП, ЛПВП |
Ингибирует липопротеинлипазу |
АрoD |
32 500 |
ЛПВП |
|
АроЕ |
34 145 |
Хиломикроны, ЛПОНП, ЛПВП |
Запускает клиренс ЛПОНП и остатков хиломикронов |
Когда пища содержит больше жирных кислот, чем может в данный момент использоваться в качестве топлива, они превращаются в печени в триацилглицерины, которые со специфическими аполипопротеинами образуют фракцию липопротеинов очень низкой плотности (ЛПОНП). Избыточные углеводы в печени также могут превращаться в триацилглицерины и экспортироваться как ЛПОНП (рис. 21-40, а). Помимо триацилглицеринов, фракция ЛПОНП содержит некоторое количество холестерина и эфиров холестерина, а также ароВ-100, ароС-1, ароС-II, ароС III и ароЕ (табл. 21-2). Эти липопротеины тоже переносятся кровью от печени в мышечную и жировую ткани, где после активация липопротеинлипазы под действием аро-СII происходит высвобождение свободных жирных кислот из триацилглицеринов фракции ЛПОНП. Адипоциты захватывают свободные жирные кислоты, снова превращают их в триацилглицерины, которые хранятся в этих клетках в виде липидных вкраплений (капель); миоциты, напротив, сразу же окисляют жирные кислоты с целью получения энергии. Большинство остатков ЛПОНП выводится из циркуляции гепатоцитами. Их поглощение, подобно поглощению хиломикронов, опосредовано рецепторами и зависит от присутствия ароЕ в остатках ЛПОНП (в доп. 21-2 описана связь между ароЕ и болезнью Альцгеймера).
Рис. 21-40. Липопротеины и липидный транспорт, а — липиды переносятся кровотоком в виде липопротеинов, которые объединены в несколько фракций с разными функциями и различным составом белков и липидов (табл. 21-1, 21-2) и соответствует плотности этих фракций. Липиды пищи агрегируются в хиломикроны; большая часть содержащихся в них триацилглицеринов высвобождается липопротеинлипазой в жировую и мышечную ткани в капиллярах. Остатки хиломикронов (содержащие главным образом белок и холестерин) захватываются гепатоцитами. Эндогенные липиды и холестерин из печени доставляются в жировую и мышечную ткани в виде ЛПОНП. Выход липидов из ЛПОНП (наряду с потерей некоторых аполипопротеинов) постепенно превращает ЛПОНП в ЛПНП, которые доставляют холестерин во внепеченочные ткани или возвращают его в печень. Печень захватывает остатки ЛПОНП, ЛПНП и остатки хиломикронов путем опосредованного рецепторами эндоцитоза. Избыточный во внепеченочных тканях холестерин транспортируется обратно в печень в виде ЛПНП. В печени часть холестерина превращается в желчные соли. б — образцы плазмы крови, отобранные после голодания (слева) и после потребления пищи с высоким содержанием жира (справа). Хиломикроны, образовавшиеся при употреблении жирной пищи, придают плазме внешнее сходство с молоком.
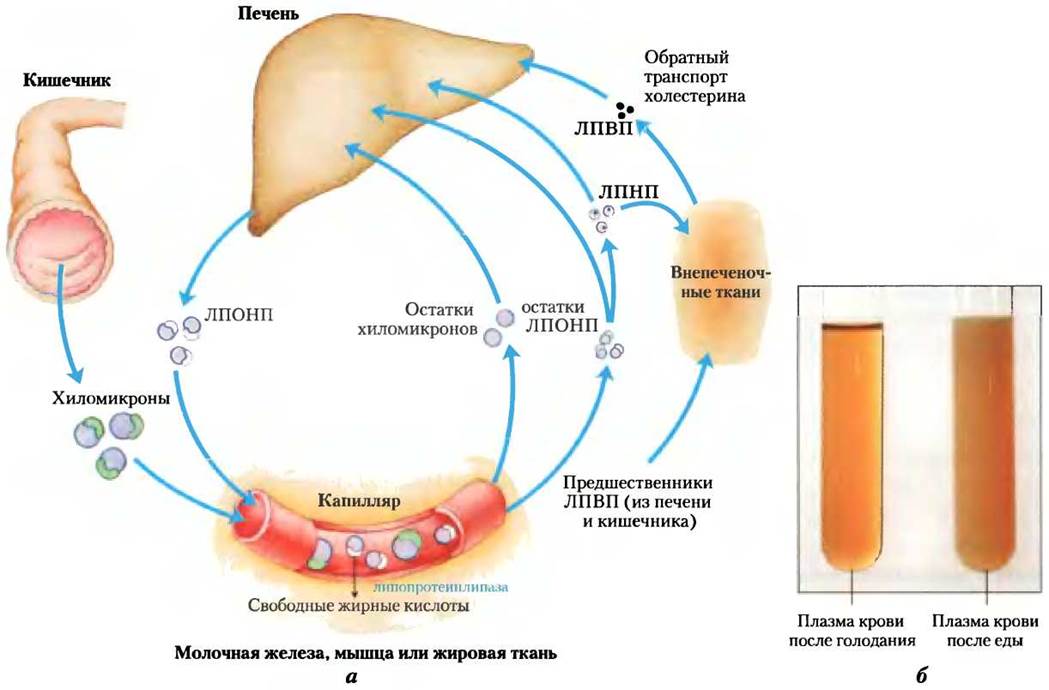
При потере триацилглицеринов часть ЛПОНП превращается в остатки ЛПОНП, называемые также липопротеинами промежуточной плотности (ЛППП); дальнейшее удаление триацилглицеринов из ЛПОНП дает липопротеины низкой плотности (ЛПНП) (табл. 21-1). Фракция ЛПНП, очень богатая холестерином и эфирами холестерина, а также содержащая ароВ-100, переносит холестерин во внепеченочные ткани, которые несут на своих плазматических мембранах специфические рецепторы, узнающие ароВ-100. Эти рецепторы опосредуют поглощение холестерина и эфиров холестерина (как описано ниже).
Дополнение 21-2. Аллели ароЕ определяет частоту возникновения болезни Альцгеймера
В человеческой популяции существуют три известных варианта (три аллеля) гена, кодирующего аполипопротеин Е. Из аллелей ароЕ у человека наиболее распространен аллель АРОЕЗ (около 78%); аллели АРОЕ4 и АРОЕ2 составляют 15 и 7% соответственно. Аллель АРОЕ4 особенно характерен для людей, страдающих болезнью Альцгеймера, и эта связь позволяет прогнозировать возникновение болезни с высокой вероятностью. У людей, унаследовавших АРОЕ4, высокий риск заболеть поздней болезнью Альцгеймера. Люди, гомозиготные по АРОЕ4, имеют в 16 раз большую вероятность развития болезни; средний возраст тех, кто заболевает, около 70 лет. Для людей, которые наследуют две копии АРОЕЗ, напротив, средний возраст возникновения болезни Альцгеймера превышает 90 лет.
Молекулярная основа связи между ароЕ4 и болезнью Альцгеймера пока неизвестна. Кроме того, до сих пор непонятно, как ароЕ4 может влиять на рост амилоидных тяжей, которые являются, по-видимому, первопричиной болезни Альцгеймера (см. рис. 4-31, т. 1). Предположения фокусируются на возможной роли ароЕ в стабилизации структуры цитоскелета нейронов. Белки ароЕ2 и ароЕЗ связываются с рядом белков, ассоциированных с микротрубочками нейронов, в то время как ароЕ4 не связывается. Это может ускорять гибель нейронов. Каким бы этот механизм ни оказался, данные наблюдения дают надежду на расширение нашего понимания биологических функций аполипопротеинов.
Четвертый тип липопротеинов — липопротеины высокой плотности (ЛПВП); эта фракция образуется в печени и тонком кишечнике в виде маленьких богатых белком частиц, содержащих относительно мало холестерина и совсем не содержащих эфиров холестерина (рис. 21-40). В состав фракции ЛПВП входят ароА-I, ароС-I, ароС-II и другие аполипопротеины (табл. 21-2), а также лецитин-холестерин-ацилтрансфераза (LCАТ), которая катализирует образование эфиров холестерина из лецитина (фосфатидилхолина) и холестерина (рис. 21-41). LСАТ на поверхности вновь образующихся частиц ЛПВП превращает холестерин и фосфатидилхолин хиломикрона и остатков ЛПОНП в эфиры холестерина, которые начинают формировать ядро, трансформируя вновь образующиеся дисковидные частицы ЛПВП в зрелые сферические частицы ЛПВП. Этот богатый холестерином липопротеин затем возвращается в печень, где холестерин «выгружается»; некоторая часть этого холестерина превращается в желчные соли.
Рис. 21-41. Реакция, катализируемая лецитин-холестерин-ацилтрансферазой (LСАТ). Этот фермент присутствует на поверхности частиц ЛПВП и активируется ароА-1 (компонентом фракции ЛПВП). Эфиры холестерина накапливаются внутри вновь образующихся частиц ЛПВП, превращая их в зрелый ЛПВП.
ЛПВП могут поглощаться в печени путем опосредованного рецепторами эндоцитоза, но по крайней мере некоторая часть холестерина из ЛПВП доставляется в другие ткани по другим механизмам. Частицы ЛПВП могут связываться с рецепторными белками SR-BI на плазматической мембране клеток печени и в стероидогенной ткани, такой как надпочечники. Эти рецепторы опосредуют не эндоцитоз, а частичный и избирательный перенос холестерина и других липидов фракции ЛПВП внутрь клетки. «Обедненная» фракция ЛПВП затем вновь попадает в кровяное русло, там она включает в себя новые порции липидов из хиломикронов и остатков ЛПОНП. Этот же ЛПВП также может захватывать холестерин, хранящийся во внепеченочных тканях, и переносить его в печень, осуществляя обратный транспорт холестерина (рис. 21-40). В одном из вариантов обратного транспорта взаимодействие образующегося ЛПВП с рецепторами SR-BI в богатых холестерином клетках инициирует пассивную диффузию холестерина от клеточной поверхности внутрь частиц ЛПВП, которые затем переносят холестерин обратно в печень. В другом варианте обратного транспорта в богатой холестерином клетке после расщепления ЛПВП ароА-I взаимодействует с активным транспортером — белком АВС. АроА-I (и предположительно ЛПВП) поглощается путем эндоцитоза, затем вновь секретируется, нагруженный холестерином, который переносится к печени.
Белок АВС1 входит в большое семейство переносчиков многих лекарств; эти переносчики иногда называются АВС-транспортерами, так как все они содержат АТР-связывающие кластеры (англ. ATP-binding cassettes); они имеют также два трансмембранных домена с шестью трансмембранными спиралями (см. гл. 11, т. 1). Эти белки активно переносят многие ионы, аминокислоты, витамины, стероидные гормоны и желчные соли через плазматические мембраны. Другой представитель этого семейства переносчиков — белок CFTR, который при кистозном фиброзе оказывается поврежденным (см. доп. 11-3, т. 1).
Эфиры холестерина попадают в клетку путем рецептор-опосредованного эндоцитоза
Каждая частица ЛПНП в кровяном русле содержит ароВ-100, который распознается специфическими поверхностными рецепторными белками-ЛПНП-рецепторами на мембране клеток, которым нужно захватить холестерин. Связывание ЛПНП с рецептором ЛПНП инициирует эндоцитоз, благодаря чему ЛПНП и его рецептор перемещаются в клетку внутри эндосомы (рис. 21-42). Эндосома в конце концов сливается с лизосомой, которая содержит ферменты, гидролизующие эфиры холестерина, высвобождая холестерин и жирные кислоты в цитозоль. АроВ-100 из ЛПНП также распадается с образованием аминокислот, которые выделяются в цитозоль, но рецептор ЛПНП избегает деградации и возвращается на клеточную поверхность, чтобы снова участвовать в поглощении ЛПНП. АроВ-100 присутствует и в ЛПОНП, но его рецептор-связывающий домен не способен связываться с рецептором ЛПНП; превращение ЛПОНП в ЛПНП делает доступным рецептор-связывающий домен в ароВ-100. Этот путь транспорта холестерина в крови и его опосредованный рецептором эндоцитоз в тканях-мишенях был изучен Майклом Брауном и Джозефом Голдштейном.
Майкл Браун и Джозеф Голдштейн

Рис. 21-42. Захват холестерина путем опосредованного рецепторами эндоцитоза.
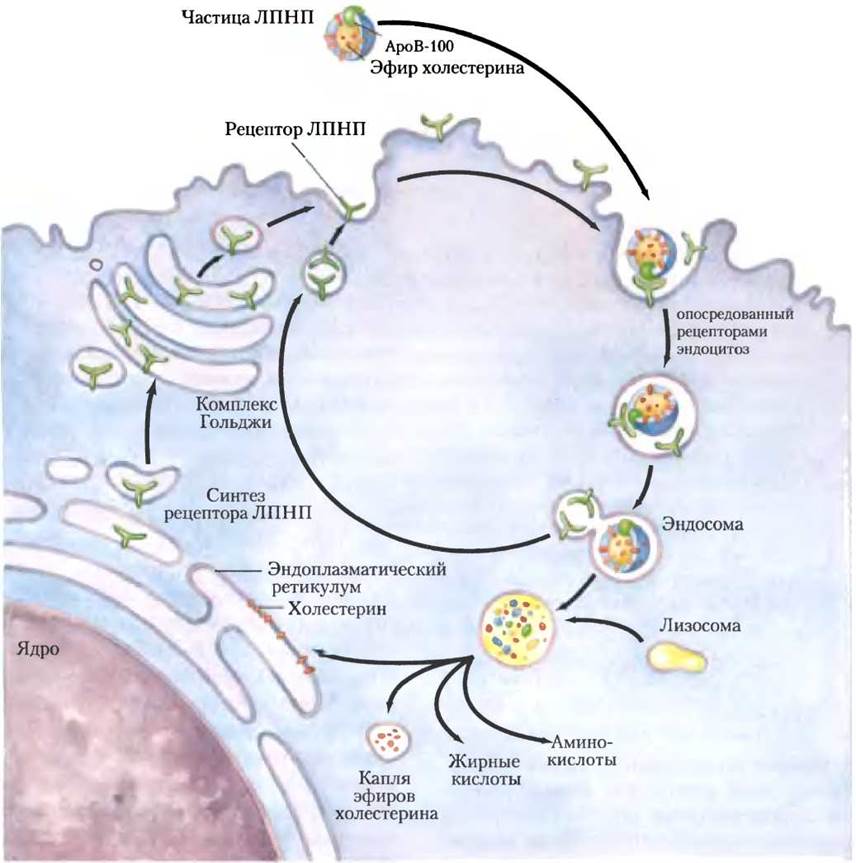
Холестерин, который попадает в клетки этим путем, может включаться в мембраны или повторно этерифицироваться под действием АСАТ (рис. 21-38) для хранения в цитозоле внутри липидных капель. Когда во фракции ЛПНП крови достаточно доступного холестерина, накопление избыточного внутриклеточного холестерина предотвращается путем уменьшения скорости его синтеза.
Рецептор ЛПНП связывается также с ароЕ и играет существенную роль в захвате печенью хиломикронов и остатков ЛПОНП. Однако, если рецепторы ЛПНП не доступны (как, например, у штамма мышей с отсутствующим геном рецептора ЛПНП), остатки ЛПОНП и хиломикроны все же поглощаются печенью, хотя ЛПНП не поглощается. Это указывает на наличие вспомогательной запасной системы для опосредованного рецепторами эндоцитоза остатков ЛПОНП и хиломикронов. Один из запасных рецепторов — это родственный рецепторам липопротеинов белок LRP (lipoprotein receptor-related protein), который связывается с ароЕ и с рядом других лигандов.
Несколько уровней регуляции биосинтеза холестерина
Синтез холестерина — сложный и энергетически дорогостоящий процесс, поэтому ясно, что организму выгодно иметь механизм регуляции биосинтеза холестерина, который пополняет его количество в дополнение к тому, что поступает с пищей. У млекопитающих производство холестерина регулируется внутриклеточной концентра
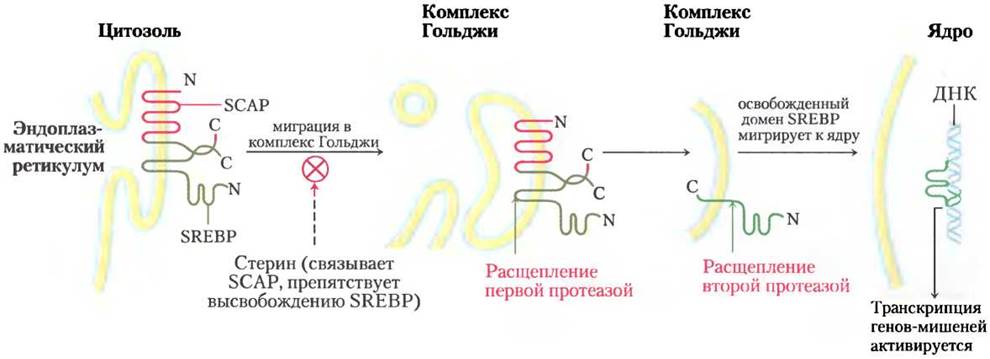
цией холестерина и гормонами глюкагоном и инсулином. Лимитирует скорость в метаболическом пути образования холестерина (главная точка регуляции) стадия превращения HMG-CoA в мевалонат (рис. 21-34). Эту реакцию катализирует HMG-CoA-редуктаза. Регуляция в ответ на изменение уровня холестерина опосредуется с помощью изящной системы регуляции транскрипции гена, кодирующего HMG-CoA-редуктазу. Этот ген вместе с более чем 20 другими генами, кодирующими ферменты, которые участвуют в поглощении и синтезе холестерина и ненасыщенных жирных кислот, контролируется небольшим семейством белков, называемых белками, взаимодействующими со стерол-регулируемым элементом образования белков (SREBP, sterol regulatory element binding proteins). После синтеза эти белки внедряются в эндоплазматический ретикулум. Единственный растворимый домен SREBP с концевой аминогруппой функционирует как активатор транскрипции с помощью механизмов, описанных в гл. 28 (т. 3). Однако этот домен не имеет доступа к ядру и не может принимать участие в активации гена, пока он остается в составе молекулы SREBP. Для того чтобы активировать транскрипцию гена HMG- CoA-редуктазы и других генов, транскрипционно активный домен отделяется от остальной части SREBP путем протеолитического расщепления. Когда уровень холестерина высокий, белки SREBP неактивны, закреплены на ЭР в комплексе с другим белком, называемым SCAP (SREBP — cleavage activating protein) (рис. 21-43). Именно SCAP связывает холестерин и ряд других стеринов, действуя как стериновый сенсор. Когда уровень стерина высокий, комплекс SCAP-SREBP, вероятно, взаимодействует с другим белком, что удерживает весь комплекс в ЭР. Когда уровень стеринов в клетке падает, конформационное изменение в SCAP приводит к утрате удерживающей активности, и комплекс SCAP-SREBP мигрирует внутри везикул в комплекс Гольджи. В комплексе Гольджи белки SREBP дважды расщепляются двумя разными протеазами, причем второе расщепление высвобождает в цитозоль аминоконцевой домен. Этот домен передвигается к ядру и активирует транскрипцию генов-мишеней. Домен белка SREBP с концевой аминогруппой имеет короткий период полужизни и быстро разлагается протеасомами (см. рис. 27-48, т. 3). Когда уровень стерина повышается в достаточной степени, протеолитическое высвобождение доменов белков SRЕВР с концевой аминогруппой снова блокируется, а протеасомная деградация существующих активных доменов приводит к быстрому отключению генов-мишеней.
Рис. 21-43. Активация SRЕВР. Белки SREBР, взаимодействующие со стерол-регулируемым элементом (зеленый цвет), сразу после синтеза внедряются в ЭР, образуя комплекс со SСАР (красный цвет). (N и С обозначают аминный и карбоксильный концы белков.) В связанном с SСАР состоянии белки SREВР неактивны. Когда уровень стерина уменьшается, комплекс SRЕВР- SСАР мигрирует к комплексу Гольджи, а белки SRЕВР последовательно отщепляются двумя разными протеазами. Освобожденный домен белка SRЕВР с концевой аминогруппой мигрирует к ядру, где он активирует транскрипцию стерол-регулируемых генов.
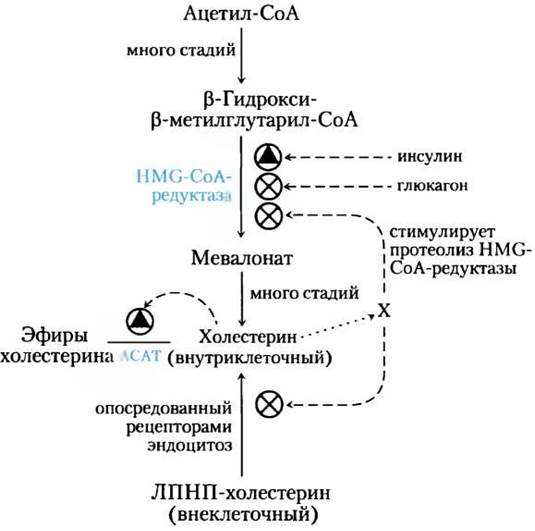
Синтез холестерина также регулируют несколько других механизмов (рис. 21-44). Гормональный контроль опосредуется ковалентной модификацией НМG-СоА-редуктазы. Этот фермент существует в фосфорилированной (неактивной) и дефосфорилированной (активной) формах. Глюкагон стимулирует фосфорилирование (инактивацию) фермента, а инсулин способствует дефосфорилированию, активируя фермент и благоприятствуя синтезу холестерина. Высокие внутриклеточные концентрации холестерина активируют АСАТ, что увеличивает этерификацию холестерина для депонирования. Наконец, высокий уровень клеточного холестерина подавляет транскрипцию гена, который кодирует рецептор ЛПНП, снижая продукцию этого рецептора и, следовательно, захват холестерина из крови.
Рис. 21-44. Регуляция уровня холестерина обеспечивает баланс между синтезом и поглощением холестерина из пищи. Глюкагон облегчает фосфорилирование (инактивацию) НМG-СоА-редуктазы; инсулин способствует дефосфорилированию (активации). X — неидентифицированные метаболиты холестерина, которые стимулируют протеолиз НМG-СоА-редуктазы.
Нерегулируемое выделение холестерина может приводить к серьезным болезням у человека. Когда в сумме количество синтезированного холестерина и холестерина, полученного с пищей, превышает количество, необходимое для сборки мембран, синтеза желчных солей и стероидов, могут появиться патологические скопления холестерина в кровеносных сосудах (атеросклеротические бляшки), приводящие к их закупорке (атеросклерозу). В промышленно развитых странах именно сердечная недостаточность, обусловленная закупоркой коронарных артерий, является главной причиной смертности населения. Развитие атеросклероза связывают с высоким уровнем холестерина крови и особенно с высоким уровнем холестерина, переносимого с фракцией ЛПНП; высокий уровень ЛПВП крови, наоборот, благоприятно сказывается на состоянии сосудов.
При наследственной гиперхолестеринемии (генетический дефект) уровень холестерина крови очень высокий — тяжелый атеросклероз развивается у этих людей уже в детстве. Из-за дефектного рецептора ЛПНП происходит недостаточное рецептор-опосредованное поглощение холестерина фракции ЛПНП. Как следствие, холестерин не удаляется из кровотока; он накапливается и вносит свой вклад в образование атеросклеротических бляшек. Синтез эндогенного холестерина продолжается, несмотря на избыточное содержание холестерина в крови, поскольку внеклеточный холестерин не может попасть в клетку, чтобы отрегулировать внутриклеточный синтез (рис. 21 -44). Для лечения больных наследственной гиперхолестеринемией и при других заболеваниях, связанных с повышенным уровнем сывороточного холестерина, используются препараты классов статинов. Некоторые из них получены из природных источников, а другие синтезированы фармацевтической промышленностью. Статины сходны с мевалонатом (доп. 21-3) и являются конкурентными ингибиторами НМС-СоА-редуктазы.
Дополнение 21-3. МЕДИЦИНА. Липидная гипотеза и создание статинов
Ишемическая болезнь сердца (ИБС) — основная причина смертности людей в развитых странах. Сужение коронарных артерий, несущих кровь к сердцу, происходит в результате образования жировых отложений, называемых атеросклеротическими бляшками; эти бляшки содержат холестерин, фибриллярные белки, кальций, сгустки тромбоцитов и фрагменты клеток. В XX в. велись активные дебаты по поводу связи между закупоркой артерий (атеросклерозом) и уровнем холестерина в крови. Эти дискуссии и активные исследования в этом направлении привели к созданию эффективных лекарственных препаратов, снижающих уровень холестерина.
В 1913 г. известный русский ученый, специалист в области экспериментальной патологии Н. Н. Аничков опубликовал работу, в которой продемонстрировал, что у кроликов, получавших богатую холестерином пищу, развиваются повреждения кровеносных сосудов, которые напоминают атеросклеротические бляшки в сосудах пожилых людей. Аничков проводил свои исследования на протяжении нескольких десятков лет и публиковал результаты в известных западных журналах. К сожалению, его данные не стали основой для модели развития атеросклероза у человека, поскольку в то время превалировала гипотеза, что данное заболевание является естественным результатом старения организма и его нельзя предотвратить. Однако постепенно накапливались доказательства связи между уровнем холестерина в сыворотке крови и развитием атеросклероза (липидная гипотеза), а в 1960-х гг. некоторые исследователи прямо заявили, что эту болезнь можно лечить с помощью лекарственных препаратов. Тем не менее противоположная точка зрения существовала вплоть до обнародования в 1984 г. результатов широкого исследования роли холестерина, проведенного Национальным институтом здоровья США (Coronary Primary Prevention Trial). Было продемонстрировано статистически достоверное снижение частоты инфарктов миокарда и инсультов при уменьшении уровня холестерина крови. В этом исследовании для снижения уровня холестерина использовали холестирамин — анионообменную смолу, связывающую желчные кислоты. Полученные результаты стимулировали поиск новых, более мощных терапевтических препаратов. Нужно сказать, что в научном мире сомнения в справедливости липидной гипотезы полностью исчезли только с появлением статинов в конце 1980-х — начале 1990-х гг.
Первый статин открыл Акира Эндо в компании Sankyo в Токио. Свою работу Эндо опубликовал в 1976 г., хотя проблемой метаболизма холестерина он занимался несколько лет. В 1971 г. он высказал предположение, что в изучавшихся в то время грибных продуцентах антибиотиков также могут содержаться ингибиторы синтеза холестерина. За несколько лет интенсивной работы он проанализировал более 6000 культур различных грибов, пока не пришел к положительному результату. Полученное соединение было названо компактином (рис. 1). Это вещество действительно снижало уровень холестерина в организме собак и обезьян. Данные исследования привлекли внимание Майкла Брауна и Джозефа Голдштейна из Юго-Западной медицинской школы Техасского университета. Браун и Голдштейн вместе с Эндо начали совместные исследования и подтвердили его данные. Серьезные успехи первых клинических испытаний привлекли фармацевтические компании к разработке этих новых лекарственных препаратов. В компании Merck группа под руководством Альфреда Альбертса и Роя Вагелоса предприняла новый скрининг культур грибов и в результате анализа всего 18 культур обнаружила еще один активный препарат. Новое вещество получило название ловастатина (рис. 1). Однако в это же время получило распространение мнение о том, что введение собакам высоких доз компактина приводит к развитию рака и поиск новых статинов в 1980-х гг. был приостановлен. Однако к тому моменту уже стали очевидны преимущества применения статинов для лечения пациентов с семейной гиперхолестеринемией. После многочисленных консультаций с мировыми экспертами и с Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA, США) компания Merck приступила к разработке ловастатина. Широкие исследования, проводившиеся на протяжении двух последующих десятилетий, не выявили канцерогенного действия ловастатина и появившихся после него препаратов нового поколения.
Рис. 1. Статины — ингибиторы НМG-СоА-редуктазы. Сравнение структуры мевалоната и четырех фармацевтических продуктов (статинов), ингибирующих действие НМG-СоА-редуктазы.
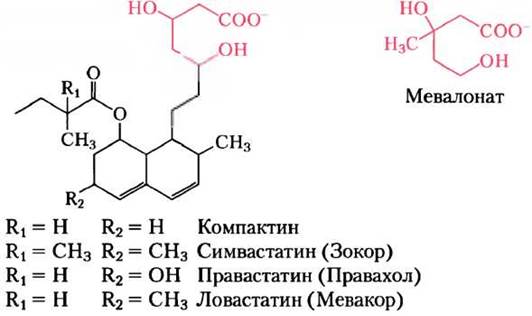
Статины ингибируют действие HMG-CoA- редуктазы, имитируя структуру мевалоната (рис. 1), и тем самым блокируют синтез холестерина. У пациентов с гиперхолестеринемией, вызванной дефектом одной копии гена рецептора ЛПНП, при приеме ловастатина уровень холестерина снижается на 30%. Препарат оказывается еще более эффективным в сочетании со специальными смолами, связывающими желчные кислоты и предотвращающими их обратное всасывание из кишечника.
В настоящее время для снижения уровня холестерина плазмы крови чаще всего используют именно статины. При приеме любых лекарств возникает вопрос об их нежелательном побочном действии. Однако в случае статинов многие побочные действия, напротив, являются позитивными. Эти препараты могут стимулировать кровоток, закрепить уже существующие атеросклеротические бляшки (так что они не отрываются от стенок сосудов и не мешают кровотоку), препятствовать агрегации тромбоцитов, а также ослабить воспалительные процессы в стенках сосудов. У пациентов, принимающих статины впервые, эти эффекты проявляются даже до того, как начнет снижаться уровень холестерина, и, возможно, связаны с ингибированием синтеза изопреноидов. Конечно, не всякое побочное действие статинов благотворно. У некоторых пациентов (обычно среди тех, которые принимают статины в сочетании с другими препаратами, снижающими уровень холестерина) могут возникать боли в мышцах и мышечная слабость, причем, иногда в довольно сильной форме. Зарегистрированы и другие, довольно многочисленные побочные проявления действия статинов, которые, к счастью, возникают достаточно редко. У подавляющего большинства пациентов прием статинов позволяет затормозить развитие сердечно-сосудистых заболеваний. Как и любые другие лекарственные препараты, статины следует применять только в соответствии с рекомендациями врача.

При наследственном отсутствии ЛПВП уровень холестерина очень низкий; при болезни Танжера холестерин практически не определяется. Оба генетических нарушения возникают в результате мутаций в белке АВС1. Лишенная холестерина фракция ЛПВП не может захватывать холестерин из клеток с недостатком белка АВС1, и обедненные холестерином клетки быстро удаляются из крови и разрушаются. И наследственное отсутствие ЛПВП, и болезнь Танжера встречаются очень редко (во всем мире известно менее 100 семей с болезнью Танжера), но эти болезни демонстрируют роль белка АВС1 в регуляции уровня ЛПВП плазмы крови. Поскольку низкий уровень ЛПВП плазмы коррелирует с высокой частотой поражения коронарных артерий, белок АВС1 может оказаться полезной мишенью для действия лекарств, предназначенных регулировать уровень ЛПВП. ■
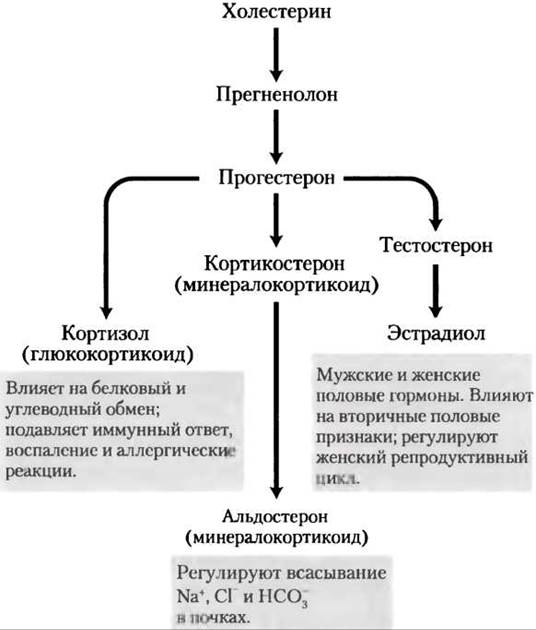
Стероидные гормоны образуются путем расщепления боковой цепи холестерина и его окисления
Человек получает все свои стероидные гормоны из холестерина (рис. 21-45). Два класса стероидных гормонов синтезируются в коре надпочечников: минералкортикоиды,которые регулируют всасывание неорганических ионов (Nа+, Сl- и НСO3-) в почках, и глюкокортикоиды, которые помогают регулировать глюконеогенез и уменьшают воспалительную реакцию. Половые гормоны производятся в половых клетках мужчин и женщин и в плаценте. Среди них прогестерон, который регулирует женский репродуктивный цикл, андрогены (например, тестостерон) и эстрогены (эстрадиол), которые влияют на развитие вторичных половых признаков у мужчин и женщин соответственно. Стероидные гормоны оказывают эффект при очень низких концентрациях и поэтому синтезируются в относительно малых количествах. По сравнению с желчными солями для продукции стероидных гормонов потребляется относительно мало холестерина.
Рис. 21-45. Некоторые стероидные гормоны образуются из холестерина. Структуры некоторых из этих соединений представлены на рис. 10-19, т. 1.
Синтез стероидных гормонов требует удаления нескольких или всех углеродных атомов, находящихся в «боковой цепи» при С-17 D-кольца холестерина. Удаление боковой цепи происходит в митохондриях стероидогенных тканей. Процесс удаления состоит из гидроксилирования двух прилежащих атомов углерода боковой цепи (С-20 и С-22), затем — расщепление связи между ними (рис. 21-46). Образование разных гормонов включает также введение атомов кислорода. Все реакции гидроксилирования и окисления при биосинтезе стероидов катализируются оксидазами со смешанной функцией (доп. 21-1), которые используют NАDРН, O2 и митохондриальный цитохром Р-450.
Рис. 21-46. Расщепление боковой цепи при синтезе стероидных гормонов. В данной системе оксидаз со смешанной функцией, которая окисляет прилегающие атомы углерода, цитохром Р-450 работает как переносчик электронов. В процессе участвуют также электронпереносящие белки адренодоксин и адренодоксин- редуктаза. Эта система расщепления боковых цепей обнаружена в митохондриях коры надпочечников, где происходит активное производство стероидов. Прегненолон является предшественником всех других стероидных гормонов (рис. 21-45).
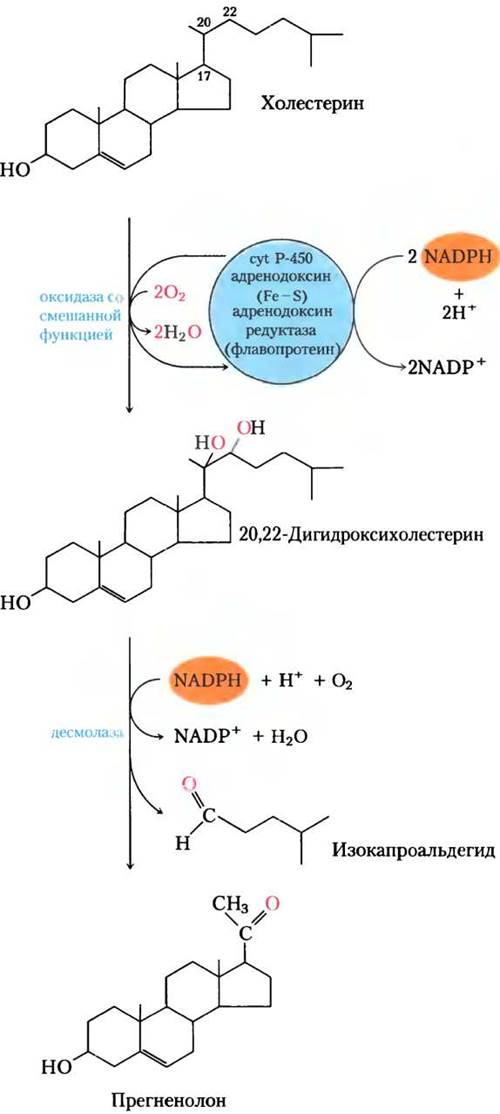
Промежуточные продукты биосинтеза холестерина участвуют во многих других метаболических путях
Дополнительно к своей роли в качестве интермедиата биосинтеза холестерина изопентенилпирофосфат служит активированным предшественником в синтезе огромного множества биомолекул, выполняющих разнообразные биологические функции (рис. 21-47). Сюда относятся витамины А, Е и К; растительные пигменты, такие как каротин и фитольная цепь хлорофилла; природный каучук; многие эфирные масла (например, душистая основа лимонного масла, эвкалипта, мускуса); ювенильный гормон насекомых, который регулирует метаморфоз; долихолы, которые служат липидорастворимыми переносчиками в сложном синтезе полисахаридов; убихинон и пластохинон — переносчики электронов в митохондриях и хлоропластах. Все эти молекулы по строению изопреноиды. В природе было найдено более 20 000 различных изопреноидов, и об открытии сотен новых сообщается каждый год.
Рис. 21-47. Общая картина биосинтеза изопреноидов. Структуры большинства представленных здесь конечных продуктов приведены в гл. 10 (т. 1).
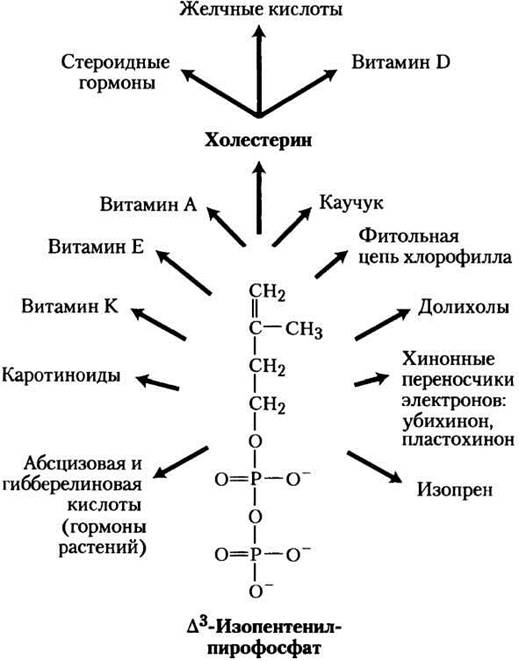
Пренилирование (ковалентное присоединение изопреноида; см. рис. 27-35) — общий механизм, посредством которого белки заякориваются на внутренней поверхности клеточных мембран млекопитающих (см. рис. 11-14). В некоторых белках связанный липид представлен 15-углеродной фарнезильной группой; в других — это 20-углеродная геранилгеранильная группа. Эти два типа липидов присоединяют разные ферменты. Возможно, что реакции пренилирования направляют белки к различным мембранам в зависимости от того, какой липид присоединяется. Пренилирование белка — это еще одна важная роль производных изопрена — участников холестеринового метаболического пути.
Краткое содержание раздела 21.4 Биосинтез холестерина, стероидов и изопреноидов
■ Холестерин образуется из ацетил-СоА в сложной последовательности реакций через такие интермедиаты как β-гидрокси-β-метилглутарил-СоА, мевалонат, два активированных изопрена диметилаллилпирофосфат и изопентенилпирофосфат. Конденсация изопреновых единиц дает нециклический сквален, который циклизуется с образованием конденсированной системы колец и боковой цепи стероида.
■ Синтез холестерина находится под гормональным контролем и, кроме того, ингибируется нарастающими концентрациями внутриклеточного холестерина, что происходит посредством ковалентной модификации и регуляции транскрипции.
■ Холестерин и эфиры холестерина переносятся кровью в виде липопротеинов плазмы. Фракция ЛПОНП переносит холестерин, эфиры холестерина и триацилглицерины от печени к другим тканям, где триацилглицерины расщепляются липопротеинлипазой и ЛПОНП превращается в ЛПНП. Обогащенная холестерином и эфирами холестерина фракция ЛПНП опосредованно захватывается рецепторами путем эндоцитоза, при этом аполипопротеин В-100 в ЛПНП распознается рецепторами плазматической мембраны. ЛПВП удаляют холестерин из крови, перенося его в печень. Условия питания или генетические дефекты метаболизма холестерина могут приводить к атеросклерозу и инфаркту миокарда.
■ Стероидные гормоны (глюкокортикоиды, минералокортикоиды и половые гормоны) образуются из холестерина путем изменения в боковой цепи и введения кислородных атомов в стероидную систему колец. Из мевалоната путем конденсации изопентенил- пирофосфата и диметилаллилпирофосфата производится наряду с холестерином много других изопреноидных соединений.
■ Пренилирование некоторых белков направляет их в места связывания с клеточными мембранами и имеет важное значение для их биологической активности.