ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
22. БИОСИНТЕЗ АМИНОКИСЛОТ, НУКЛЕОТИДОВ И РОДСТВЕННЫХ СОЕДИНЕНИЙ
22.2. Биосинтез аминокислот
Все аминокислоты образуются из интермедиатов гликолиза, цикла трикарбоновых кислот или пентозофосфатного пути (рис. 22-9). Атомы азота попадают в эти пути через глутамат или глутамин. Некоторые из этих путей довольно простые, а некоторые нет. Десять аминокислот образуются всего за одну или несколько стадий из общих
метаболитов-предшественников. Биосинтез других аминокислот, например, ароматических, более сложный.
Рис. 22-9. Обзор биосинтеза аминокислот. Предшественники углеродных скелетов молекул поступают из трех источников: гликолиз (показано розовым цветом), цикл трикарбоновых кислот (голубой) и пентозофосфатный путь (синий).
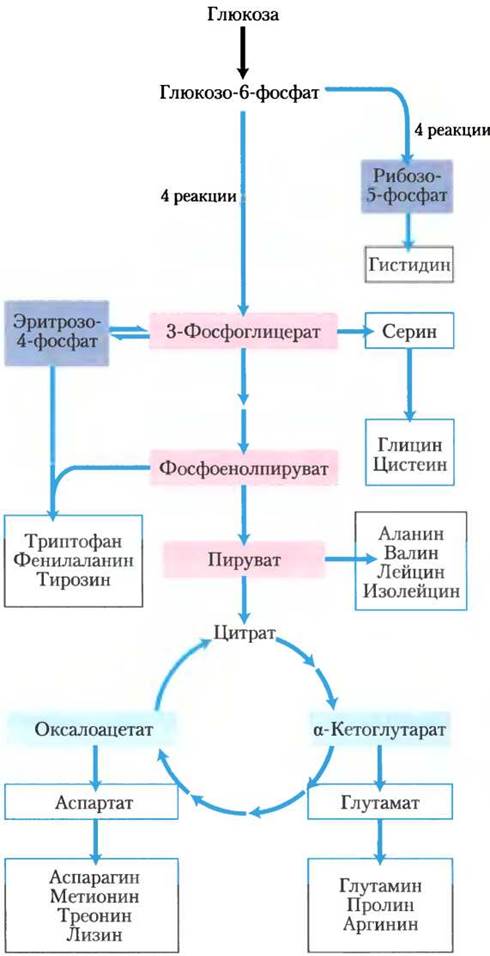
Организмы сильно различаются по способности синтезировать 20 аминокислот, входящих в состав белков. Большинство бактерий и растений умеют синтезировать их все, а млекопитающие могут синтезировать только около половины из 20 аминокислот — главным образом те аминокислоты, которые образуются простыми способами. Это так называемые заменимые аминокислоты — они необязательно должны присутствовать в пищевом рационе (см. табл. 18-1). Незаменимые аминокислоты непременно должны поступать вместе с пищей. Ниже представлены пути синтеза 20 аминокислот, которые осуществляют бактерии, если не оговорено другое.
При классификации этих биосинтетических путей полезно выделить шесть семейств аминокислот по их общим предшественникам (табл. 22-1). Вдобавок к шести предшественникам, существует примечательный интермедиат нескольких путей синтеза аминокислот и нуклеотидов — 5-фосфорибозил-1-пирофосфат (РКРР):

Таблица 22-1. Классификация аминокислот на основе их предшественников в метаболизме
α-Кетоглутарат |
Пируват |
Глутаминовая кислота |
Аланин |
Глутамин |
Валин* |
Пролин |
Лейцин* |
Аргинин |
Изолейцин* |
3-Фосфоглицерат |
Фосфоенолпируват |
Серин |
и эритрозо-4-фосфат |
Глицин |
Триптофан* |
Цистеин |
Фенилаланин* |
Оксалоацетат |
Тирозин** |
Аспарагиновая кислота |
Рибозо-5-фосфат |
Аспарагин |
Гистидин* |
Метионин* |
|
Треонин* |
|
Лизин* |
*Незаменимые аминокислоты.
**У млекопитающих синтезируется из фенилаланина.
Интермедиат PRPP образуется из рибозо-5- фосфата, который синтезируется в пентозофосфатном цикле (см. рис. 14-21) в реакции, катализируемой рибозофосфат-пирофосфокиназой:
Рибоза-5-фосфат + АТР —> 5-фосфорибозил-1-пирофосфат + АМР
Этот фермент аллостерически регулируется многими молекулами, для которых PRPP является предшественником.
α-Кетоглутарат — предшественник глутаминовой кислоты, глутамина, пролина и аргинина

Мы уже описывали биосинтез глутаминовой кислоты (глутамата) и глутамина. Пролин — циклическое производное глутаминовой кислоты (рис. 22-10). На первой стадии синтеза пролина АТР реагирует с y-карбоксильной группой глутамата, образуется ацилфосфат, который восстанавливается NADPH или NADH-до y-полуальдегида глутамата. Этот промежуточный продукт претерпевает быструю спонтанную циклизацию и последующее восстановление — образуется пролин.
Аргинин у животных синтезируется из глутамата через орнитин в цикле мочевины (гл. 18). Орнитин также может быть синтезирован через трансаминирование y-полуальдегида глутамата, но из-за спонтанной циклизации последнего, которая приводит к пролину, такая реакция не вносит заметного вклада в синтез орнитина. У бактерий есть путь синтеза орнитина (и аргинина) de novo, некоторые стадии которого совпадают с реакциями, приводящими к пролину, благодаря двум дополнительным стадиям; проблему спонтанной циклизации y-полуальдегида глутамата здесь удается решить (рис. 22-10). На первой стадии α-аминогруппа глутамата защищается аце
тилированием при участии ацетил-СоА. После стадии трансаминирования ацетильная группа удаляется с образованием орнитина.
Рис. 22-10. Биосинтез пролина и аргинина из глутаминовой кислоты у бактерий. Все пять углеродных атомов пролина происходят из глутаминовой кислоты. У многих организмов глутаматдегидрогеназа использует в качестве кофакторов NADH или NADPH. Это же характерно для других ферментов. При синтезе пролина у-полуальдегид претерпевает быструю обратимую циклизацию в ∆1-пирролин-5-карбоксилат (Р5C) — равновесие сдвинуто в сторону образования Р5С. При синтезе орнитина/ аргинина циклизация предотвращается путем ацетилирования α-аминогруппы глутамата. У некоторых бактерий нет аргиназы (и, следовательно, полного цикла мочевины), но они могут синтезировать аргинин из орнитина в реакциях, аналогичных тем, что протекают в цикле мочевины у млекопитающих, с интермедиатами цитруллином и аргининосукцинатом (см. рис. 18-10). Здесь и далее стрелками показано направление к конечному продукту независимо от обратимости отдельных стадий. Например, вторая реакция синтеза аргинина, катализируемая N-ацетилглутаматдегидрогеназой, химически схожа с глицеральдегид-3-фосфатдегидрогеназной реакцией при гликолизе (см. рис. 14-7) и легко обратима.

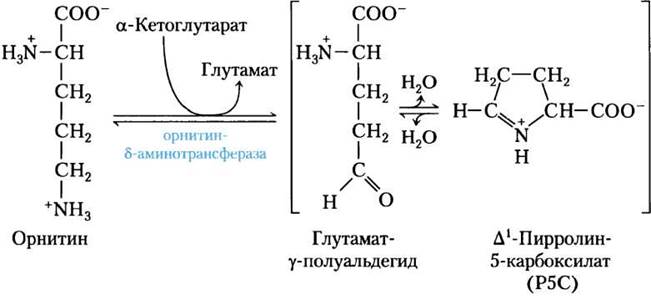
Пути синтеза пролина и аргинина у млекопитающих имеют некоторые отличия. Пролин может синтезироваться в пути, показанном на рис. 22-10, но также он может образоваться из аргинина, входящего в состав белков пищи, или белков собственных тканей. Аргиназа, фермент цикла мочевины, превращает аргинин в орнитин и мочевину (см. рис. 18-10, 18-26). Орнитин превращается в глутамат-y-полуальдегид ферментом орнитин-δ-аминотрансферазой (рис. 22-11). Полуальдегид циклизуется в ∆1- пирролин-5-карбоксилат, который затем превращается в пролин (рис. 22-10). Путь синтеза аргинина, показанный на рис. 22-10, у млекопитающих отсутствует. Когда аргинина, поступающего с пищей или при превращениях собственных белков, недостаточно, осуществляемая орнитин-δ-аминотрансферазой реакция протекает в направлении образования орнитина. Затем орнитин превращается в цитруллин и аргинин в цикле мочевины.
Рис. 22-11. Реакция, осуществляемая орнитин-δ-аминотрансферазой — одна из стадий в синтезе пролина у млекопитающих. Этот фермент находится в матриксе митохондрий большинства тканей. Хотя равновесие смещено в сторону образования Р5С, обратная реакция используется млекопитающими как единственный путь синтеза орнитина (и аргинина), когда аргинина недостаточно для синтеза белка.
Серин, глицин и цистеин — производные 3-фосфоглицерата

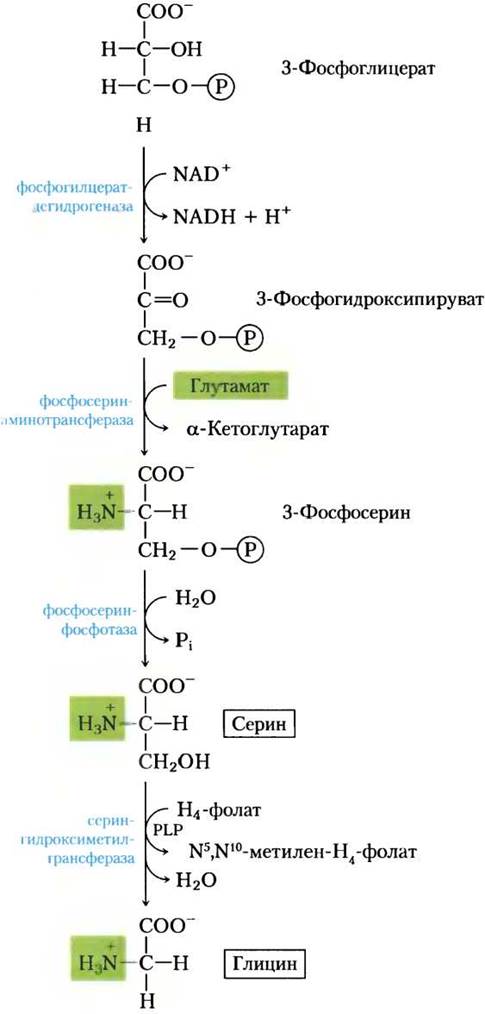
У всех организмов одинаковый основной путь биосинтеза серина (рис. 22-12). На первой стадии гидроксильная группа 3-фосфоглицерата окисляется дегидрогеназой (использующей NАD+) с образованием 3-фосфогидроксипирувата. Путем трансаминирования (перенос аминогруппы с глутамата) образуется 3-фосфосерин, который гидролизуется до свободного серина фосфосеринфосфатазой.
Серин (три атома углерода) служит предшественником глицина (два атома углерода) — образуется после удаления одного атома углерода серин-гидроксиметилтрансферазой(рис. 22-12).
Рис. 22-12. Биосинтез серина из 3-фосфоглицерата и глицина из серина у всех организмов. Глицин получается также из СO2 и NH4+ под действием глицинсинтазы с N5, N10-метилентетрагидрофолатом в качестве донора метильной группы (см. текст).
Тетрагидрофолат принимает β-углерод (С-3), который «строит» метиленовый мостик между N-5 и N-10 — в результате получается N5, N10- метилентетрагидрофолат (см. рис. 18-17). Суммарная реакция обратима и для нее требуется пиридоксальфосфат. В печени позвоночных глицин может образовываться по другой реакции, обратной той, что показана на рис. 18-20, в. Катализатором выступает глицинрасщепляющий фермент глицинсинтаза:
СO2 + NH4+ + N5, N10-метилентетрагидрофолат + NADH + Н+ —> глицин + тетрагидрофолат + NAD+
Растения и бактерии способны получать из сульфатов окружающей среды восстановленную серу, необходимую для синтеза цистеина (и метионина, синтез которого мы рассмотрим ниже); этот путь показан на рис. 22-13. Сульфат активируется в две стадии с образованием 3-фосфоаденозин-5'-фосфосульфата (PAPS), который, принимая восемь электронов, восстанавливается до сульфида. Сульфид затем используется для образования цистеина из серина — этот путь состоит из двух реакций. Млекопитающие синтезируют цистеин из двух аминокислот: метионин предоставляет атом серы, а серин — углеродный скелет. Метионин сначала превращается в S-аденозилметионин (см. рис. 18-18), который может отдать свою метильную группу любому из акцепторов и превратиться в S-аденозилгомоцистеин (adoHcy). Этот деметилированный продукт гидролизуется до свободного гомоцистеина, который вступает в реакцию с серином, катализируемую цистатионин-β-синтазой, образуя цистатионин (рис. 22-14). И, наконец, цистатионин-y-лиаза, фермент, использующий PLP, катализирует удаление аммония и расщепление цистатионина с образованием цистеина.
Рис. 22-13. Биосинтез цистеина из серина у бактерий и растений. Происхождение восстановленной серы показано справа.
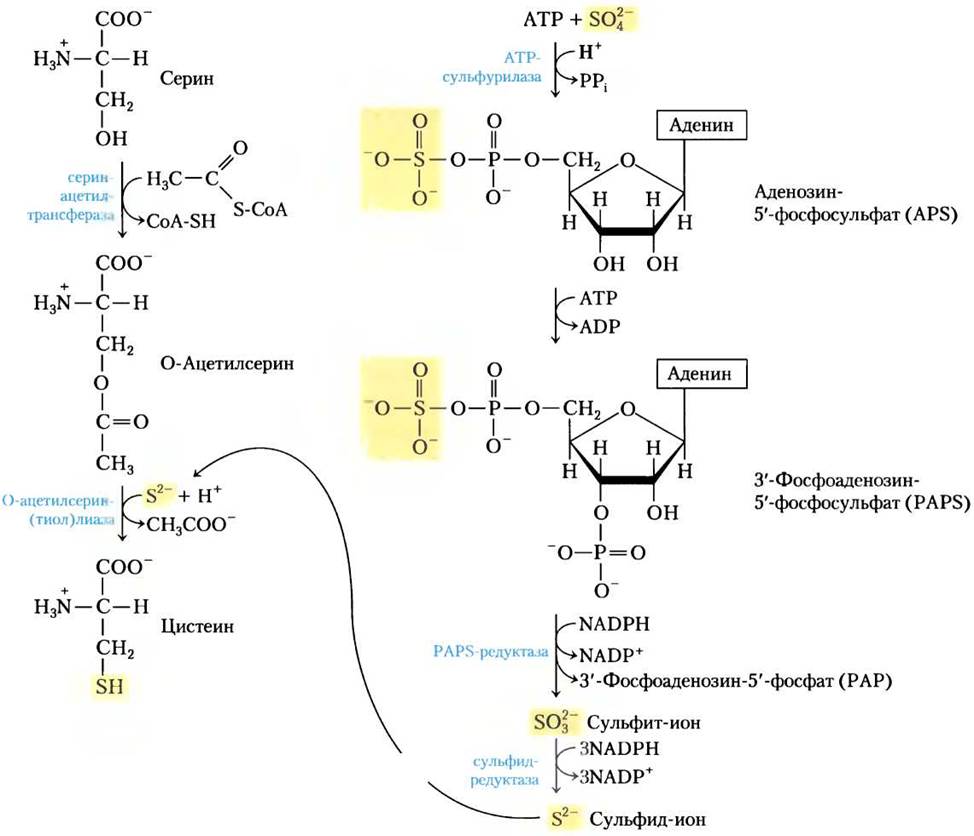
Рис. 22-14. Биосинтез цистеина из гомоцистеина и серина у млекопитающих. Гомоцистеин образуется из метионина, как описано в тексте.

На основе оксалоацетата и пирувата синтезируются три заменимые и шесть незаменимых аминокислот
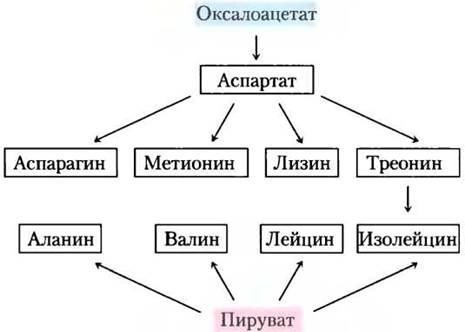
Аланин и аспарагиновая кислота синтезируются из пирувата и оксалоацетата (соответственно) путем трансаминирования (аминогруппа переносится с глутамата). Аспарагинвозникает путем амидирования аспартата — группу NН+4 предоставляет глутамин. Все это заменимые аминокислоты, их биосинтез происходит простыми путями и встречается у всех организмов.
По непонятным пока причинам опухолевые лимфоциты, обнаруживаемые при остром лимфобластном лейкозе (ОЛЛ) у детей, при росте опухоли расходуют аспарагин. При проведении химиотерапии больным с ОЛЛ дополнительно вводят бактериальную L-аспарагиназу, снижающую уровень аспарагина в плазме крови пациентов. При таком комбинированном лечении частота ремиссий у детей достигает 95% (применение одной только L-аспарагиназы позволяет достичь ремиссии в 40-60% случаев). Однако использование аспарагиназы сопряжено с некоторыми нежелательными побочными эффектами, и приблизительно у 10% пациентов после ремиссии вновь начинает развиваться заболевание, причем возникает опухоль, устойчивая к действию лекарственных препаратов. В настоящее время для лечения детей с ОЛЛ разрабатываются ингибиторы человеческой аспарагинсинтетазы. ■
Метионин, треонин, лизин, изолейцин, валин и лейцин — незаменимые аминокислоты. Пути их биосинтеза сложные и взаимосвязанные (рис. 22-15). У бактерий, грибов и растений пути биосинтеза могут существенно отличаться; для бактерий они представлены на рис. 22-15.
Рис. 22-15. Бактериальный синтез из оксалоацетата и пирувата шести незаменимых аминокислот: метионина, треонина, лизина, изолейцина, валина и лейцина. Здесь, как и в других многостадийных путях биосинтеза, ферменты (и реакции) обозначены номерами (см. список в рамке). Заметьте, что L, L-α, ε-диаминопимелат, продукт реакции (14), симметричен. Атомы углерода, полученные от молекулы пирувата, после этой стадии уже не отмечены, поскольку в результате последующих реакций они могут оказаться на любом конце молекулы лизина.
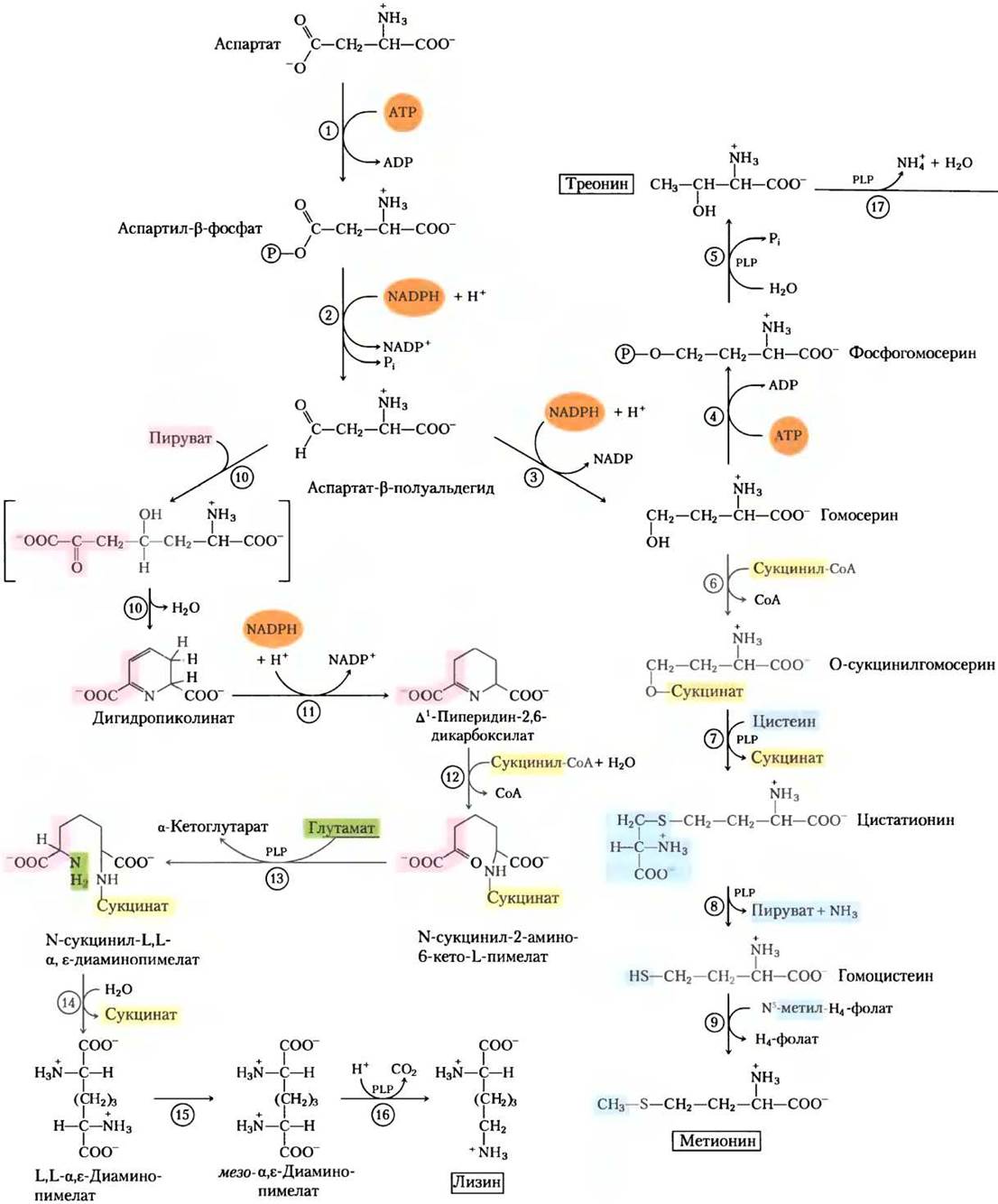
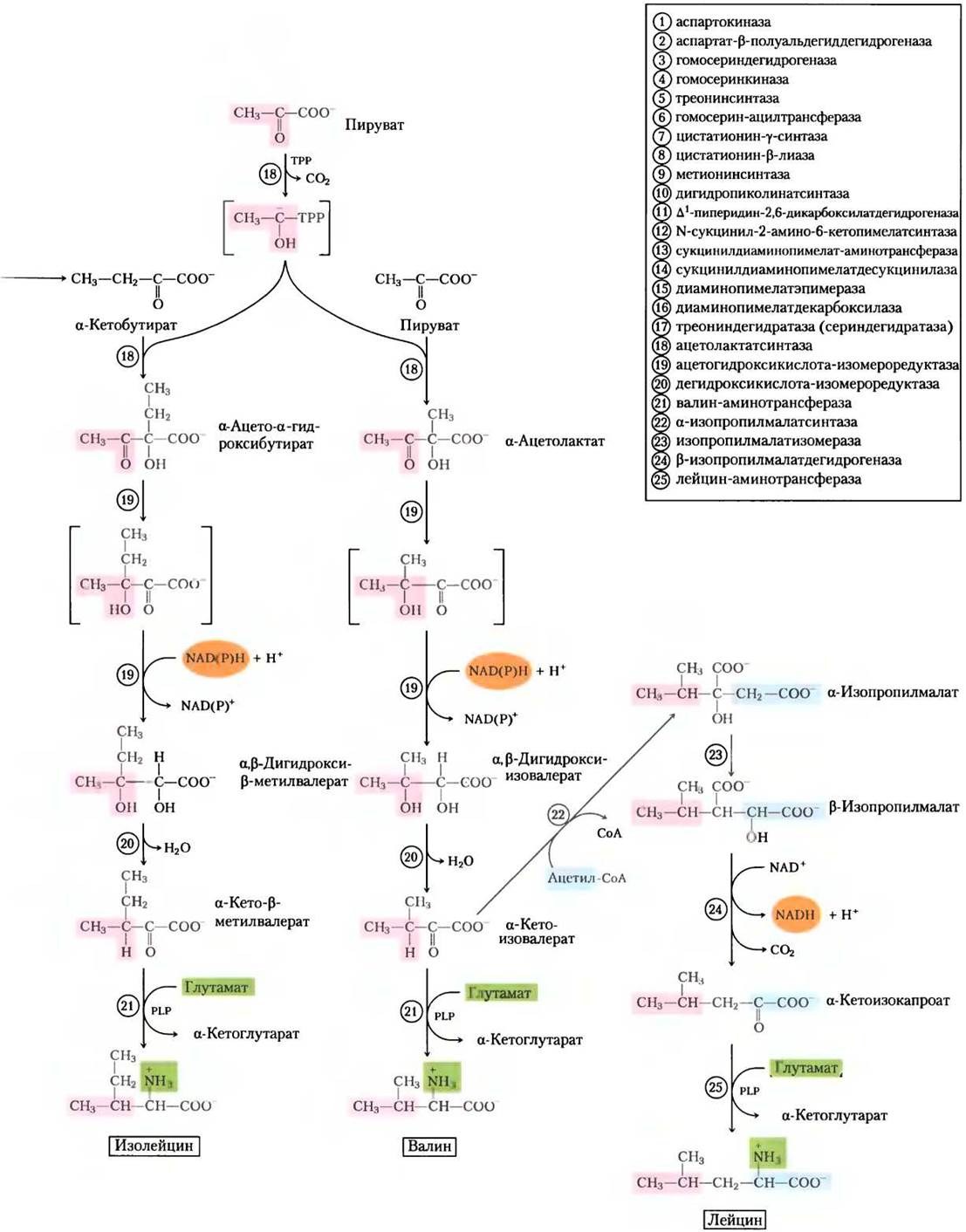
Аспарагиновая кислота служит предшественником метионина, треонина и лизина. Точками разветвления путей оказываются аспартат- β-полуальдегид, промежуточный продукт всех трех путей, и гомосерин, предшественник треонина и метионина. Треонин в свою очередь служит одним из предшественников изолейцина. Пути биосинтеза валина и изолейцина включают три общих фермента (рис. 22-15, реакции с (18) по (21)). Предшественник валина и изолейцина — пируват; этот путь начинается реакцией между молекулой пирувата (в форме гидроксиэтилтиаминпирофосфата, см. рис. 14-14) с другой молекулой пирувата (синтез валина) или молекулой α-кетобутирата (синтез изолейцина). а-Кетобутират образуется из треонина в реакции, требующей присутствия пиридоксальфосфата (рис. 22-15, реакция (17)). Четырехстадийный путь синтеза лейцина (реакции (22)-(25)) начинается с α-кетоизовалерата, промежуточного продукта при синтезе валина.
Хоризмат — ключевое соединение в синтезе триптофана, фенилаланина и тирозина
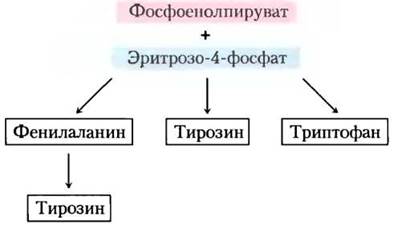
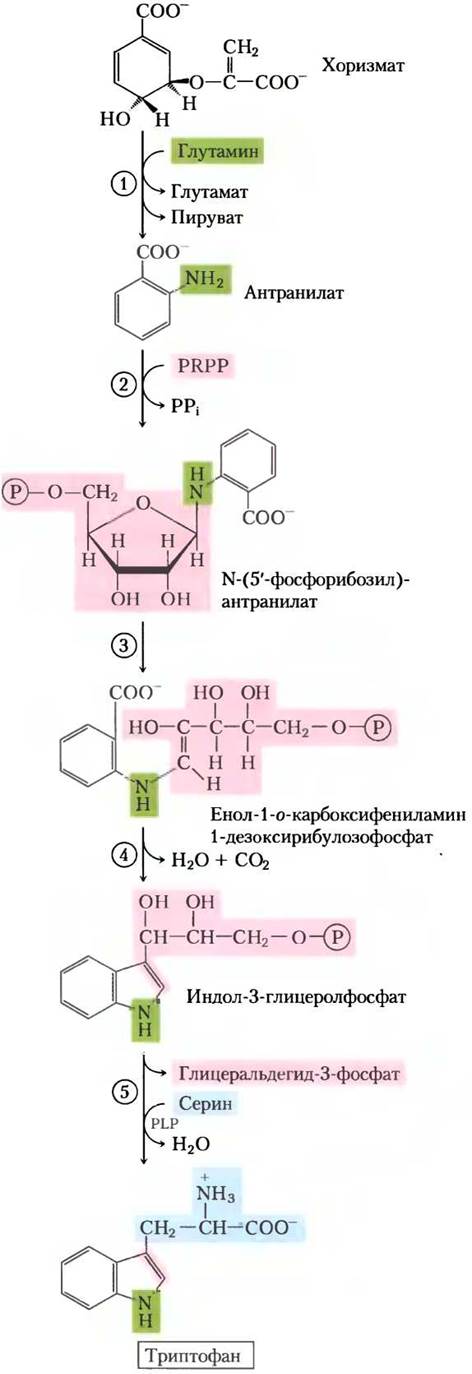
Ароматические кольца нелегко получить из окружающей среды, даже несмотря на то что бензольное кольцо очень устойчиво. Основной путь образования ароматических колец у бактерий, грибов и растений — это биосинтез триптофана, фенилаланина и тирозина. Все начинается с замыкания в кольцо алифатического предшественника, затем следует постадийное добавление двойных связей. В ходе первых четырех реакций образуется шикимат — молекула, содержащая семь атомов углерода, полученных от молекул эритрозо-4-фосфата и фосфоенолпирувата (рис. 22-16). Шикимат превращается в хоризмат в ходе трех реакций, где происходит добавление еще трех атомов углерода от новой молекулы фосфоенолпирувата. Хоризмат — первая точка разветвления путей, одна из ветвей ведет к триптофану, другая — к фенилаланину и тирозину
Рис. 22-16. Биосинтез хоризмата, промежуточного продукта биосинтеза ароматических аминокислот у бактерий и растений. Все атомы углерода происходят из молекул эритрозо- 4-фосфата (светло-сиреневый цвет) или фосфоенолпирувата (розовый цвет). Заметьте, что NAD+, необходимый в качестве кофактора реакции (2), остается неизменным, он может быть временно восстановлен до NАDН в ходе реакции с образованием окисленного промежуточного продукта. Реакция (6) конкурентно ингибируется глифосатом (-СOO-СН2-NH-СН2-РO32-), активным компонентом широко используемого гербицида раундапа. Этот гербицид относительно безопасен для млекопитающих, у которых нет подобного биосинтетического пути. Названия соединений хинат и шикимат даны по именам растений (хинное дерево и анисовый бадьян (шикими)), в которых было обнаружено накопление этих веществ.

При синтезе триптофана (рис. 22-17) хоризмат превращается в антранилат в реакции, где глутамин выступает донором атома азота, который далее включается в индольное кольцо. Затем антранилат конденсируется с 5-фосфорибозил- 1-пирофосфатом (РRРР). Индольное кольцо триптофана образуется из атомов углерода кольца и аминогруппы антранилата, а также углеродов из РRРР. Последнюю реакцию катализирует триптофансинтаза. Этот фермент имеет субъединичную структуру типа α2β2 и может диссоциировать на две а-субъединицы и одну β2-субъединицу, которые катализируют разные стадии суммарной реакции:
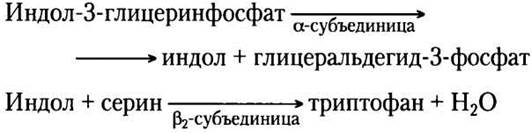
Рис. 22-17. Биосинтез триптофана из хоризмата у бактерий и растений. У Е. coli ферменты, катализирующие реакции (1) и (2), — субъединицы одного комплекса.

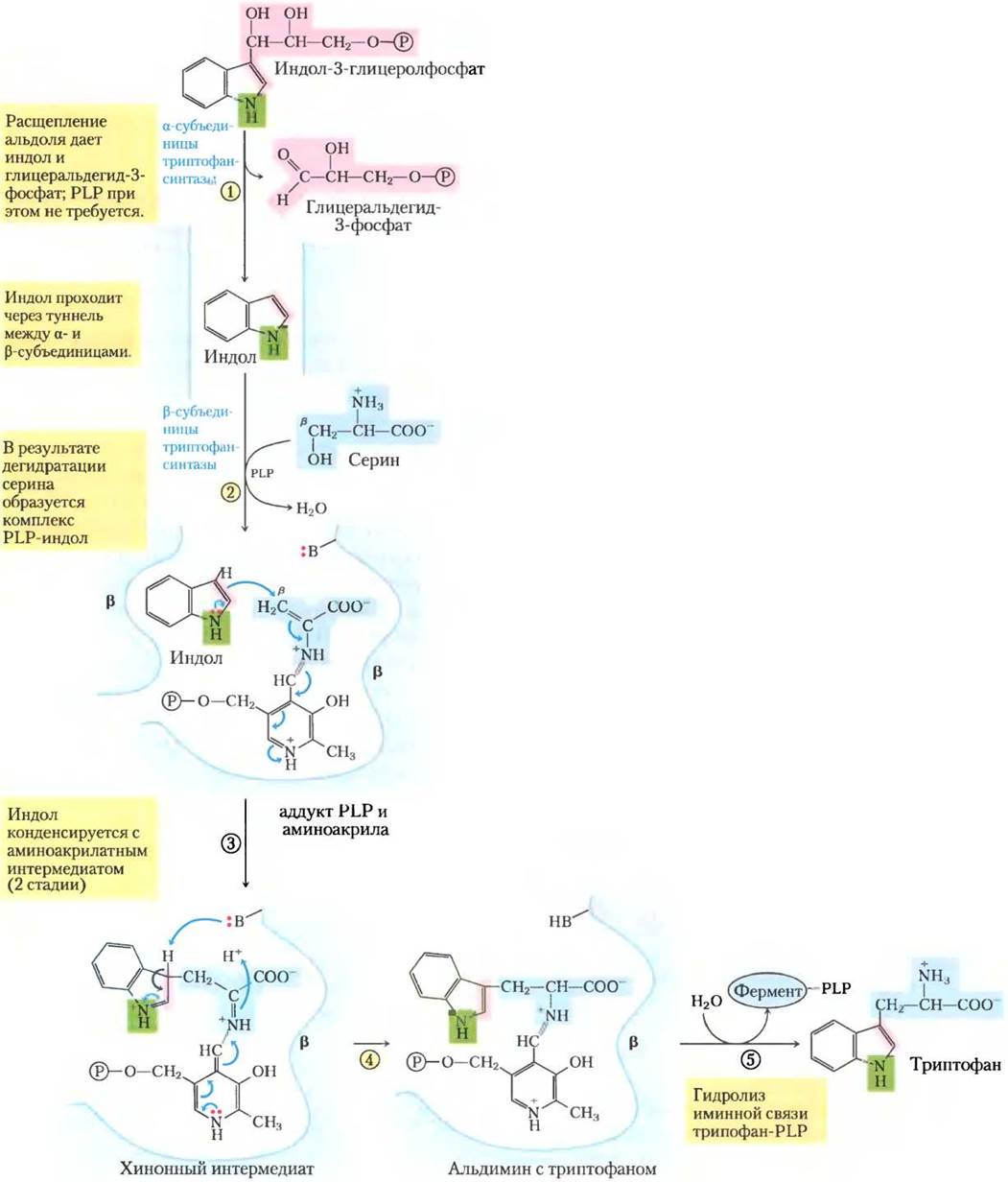
Во второй стадии используется пиридоксальфосфат (PLP) (рис. 22-18). Индол, образованный в первой стадии, не отщепляется ферментом, но вместо этого движется по каналу из активного центра α-субъединицы в активный центр β-субъединицы, где он конденсируется с интермедиатом — шиффовым основанием, образованным серином с PLP. Туннелирование интермедиата таким способом можно назвать особенностью всего пути от хоризмата до триптофана. Активные центры фермента, катализирующие разные стадии (иногда даже непоследовательные) пути образования триптофана, у некоторых видов грибов и бактерий расположены на отдельных полипептидах, но у других видов этих организмов эти стадии катализируются разными белками. Кроме того, для проявления некоторой ферментативной активности необходимо, чтобы ферменты были нековалентно связаны с другими ферментами этого пути. Становится ясно, что у прокариот и эукариот все ферменты пути входят в состав больших полиферментных комплексов. Такие комплексы чаще всего не сохраняются при выделении ферментов традиционными биохимическими методами, но доказательств существования полиферментных комплексов в этом и ряде других метаболических путей накапливается все больше (с. 187).
Рис. 22-18. Механизм реакции. Реакция, катализируемая триптофансинтазой. Эта ферментативная реакция включает несколько стадий с различными химическими перегруппировками. Эти облегченные благодаря участию PLP превращения происходят со стороны β-углерода (С-3) аминокислоты, что отличается от реакций, затрагивающих α-углерод (рассмотрены на рис. 18-6). β-Углерод серина соединяется с индольным циклом. Механизм триптофансинтазы
У растений и бактерий фенилаланин и тирозин синтезируются из хоризмата в последовательности реакций более сложной, чем для триптофана. Общий интермедиат — это префенат (рис. 22-19). В обоих случаях последняя стадия — трансаминирование с глутаматом.
Рис. 22-19. Биосинтез фенилаланина и тирозина из хоризмата в бактериях и растениях. Превращение хоризмата в префенат служит редким биологическим примером перегруппировки Кляйзена.

Животные могут образовать тирозин непосредственно из фенилаланина гидроксилированием атома С-4 фенильной группы фенилаланин- гидроксилазой; этот фермент также участвует в деградации фенилаланина (см. рис. 18-23,18-24). Тирозин считается условно незаменимой аминокислотой, так как может быть синтезирован из незаменимой аминокислоты фенилаланина.
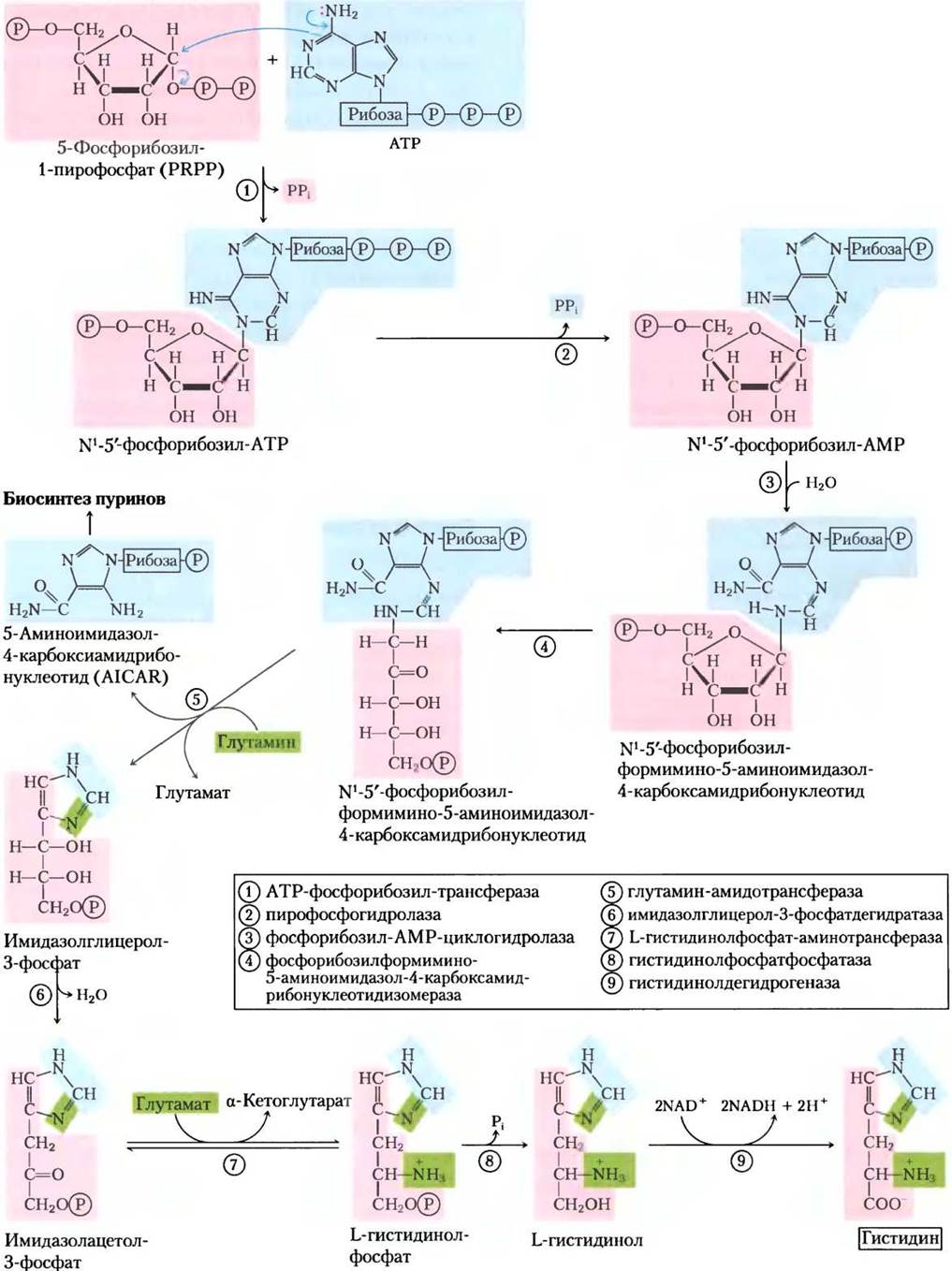
При биосинтезе гистидина используются предшественники пуринового биосинтеза
У всех растений и бактерий путь синтеза гистидина несколько отличается от биосинтетических путей других аминокислот. Гистидин образуется из трех предшественников (рис. 22-20): из PRPP берется пять атомов углерода, из пуринового кольца АТР — атомы азота и углерода и из глутамина — второй атом азота кольца. Ключевые стадии: конденсация АТР и PRPP, в которой N-1 пуринового кольца связывается с активированным углеродом С-1 рибозы в PRPP (стадия (1) на рис. 22-20); размыкание пуринового кольца, что обеспечивает образование связи между N-1 аденина и С-2 рибозы (стадия (3)); образование имидазольного кольца в реакции, для которой поступление азота обеспечивает глутамин (стадия (5)). Использование АТР в качестве метаболита, а не в качестве высокоэнергетического кофактора довольно необычно, но нерасточительно, потому что координируется биосинтезом пуринов. Остаток молекулы АТР после преобразований при атомах N-1 и С-2 называется 5-аминоимидазол-4- карбоксамидрибонуклеотидом (AICAR от англ. 5-aminoimidazole-4-carboxamide ribonucleotide), он служит интермедиатом в биосинтезе пуринов (см. рис. 22-33) и быстро регенерирует АТР.
Рис. 22-20. Биосинтез гистидина у бактерий и растений. Атомы, поступившие от PRPP и АТР, выделены красным и голубым полем соответственно. Два атома азота гистамина происходят из глутамина и глутамата (зеленое). Обратите внимание, что после стадии (5) остается производное ATP (AICAR), которое служит интермедиатом биосинтеза пуринов (см. рис. 22-33, стадия (9)), поэтому АТР быстро регенерируется.
Биосинтез аминокислот регулируется аллостерически
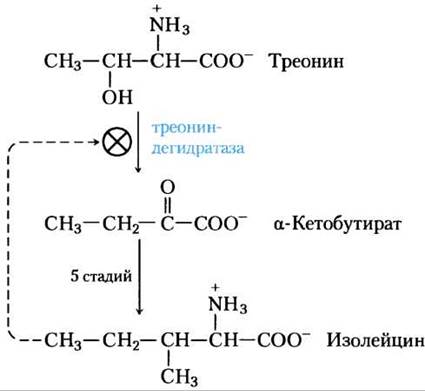
Как подробно обсуждалось в гл. 15, метаболический поток часто связан с активностью многих ферментов, действующих на данном метаболическом пути. В случае синтеза аминокислот регуляция метаболизма частично достигается путем ингибирования первой стадии конечным продуктом всего метаболического пути. Первая стадия обычно необратима и катализируется аллостерическим ферментом, который играет важную роль в регуляции общей скорости этого метаболического пути. Например, на рис. 22-21 показана аллостерическая регуляция синтеза изолейцина из треонина (см. рис. 22-15). Конечный продукт изолейцин — аллостерический ингибитор первой стадии этой цепи реакций. У бактерий такая аллостерическая модуляция аминокислотного синтеза обеспечивает мгновенную адаптацию к потребностям клетки.
Рис. 22-21. Аллостерическая регуляция биосинтеза изолейцина. Первая реакция в цепочке от треонина до изолейцина ингибируется конечным продуктом пути, изолейцином. Этот пример аллостерического ингибирования по принципу отрицательной обратной связи был открыт одним из первых. Стадии от α-кетобутирата до изолейцина соответствуют реакциям от (18) до (21) на рис. 22-15 (пять стадий, так как реакция (19) идет в две стадии).
Аллостерическая регуляция может быть значительно более сложной. В качестве примера рассмотрим удивительный набор аллостерических регуляторов глутаминсинтетазы Е. coli (рис. 22-6). Шесть продуктов, образованных из глутамина, обеспечивают отрицательную обратную связь, ингибируя этот фермент, и суммарный эффект этих и других модуляторов не просто аддитивный. Такая регуляция называется кооперативным ингибированием.
Другие механизмы также вносят свой вклад в регуляцию биосинтеза аминокислот. Для синтеза белков 20 аминокислот должны образовываться в организме в нужном соотношении, поэтому в клетках существуют способы контроля не только скорости синтеза каждой аминокислоты, но также согласованности их накопления. Согласованность относительных количеств особенно хорошо можно наблюдать в быстро растущих бактериальных клетках. На рис. 22-22 показано, как клетки Е. coli контролируют синтез лизина, метионина, треонина и изолейцина — аминокислот, образованных из аспартата. Очевидны некоторые важные ингибирующие связи. Стадия образования аспартил-β-фосфата из аспартата катализируется тремя изозимами, каждый из них независимо контролируется различными модуляторами. Многообразие ферментов предотвращает выключение ключевых стадий единственным конечным продуктом биосинтеза, ведь могут потребоваться другие продукты этого пути. В цепочках реакций от аспартат- β-полуальдегида до гомосерина и от треонина до α-кетобутирата (подробно на рис. 22-15) стадии катализируются двумя независимо контролируемыми изозимами. Один изозим, обеспечивающий превращение аспартата в аспартил-β-фосфат, аллостерически ингибируется двумя различными модуляторами, лизином и изолейцином, чье действие сильнее, чем просто аддитивно — еще один пример кооперативного ингибирования. Цепочка реакций от аспартата до изолейцина подвергается множественной перекрестной регуляции по механизму отрицательной обратной связи; например, изолейцин ингибирует превращение треонина в α-кетобутират (как описано выше), а треонин ингибирует свое собственное образование в трех местах: из гомосерина, из аспартат-β- полуальдегида и из аспартата (стадии (4),(3) и (1) на рис. 22-15). Такой всеобъемлющий регуляторный механизм называется последовательным ингибированием с отрицательной обратной связью.
Рис. 22-22. Взаимные ингибирующие регуляторные механизмы биосинтеза некоторых аминокислот, образующихся из аспартата, в метаболизме Е. coli. Три фермента (А, В, С) имеют по два или по три изозима, показанные с помощью нижних индексов. В каждом случае один изозим (А2, B1или С2) не имеет аллостерической регуляции; эти изозимы регулируются уровнем своего синтеза (гл. 28, т. 3). Синтез изозимов А2 и B1 подавляется при высоком уровне метионина, а синтез изозима С2 подавляется при высоком уровне С2. Ферменты: А — аспартокиназа; В — гомосериндегидрогеназа; С — треониндегидратаза.

Похожие фрагменты встречаются в путях, ведущих к образованию ароматических аминокислот. В начале пути к общему интермедиату хоризмату первая стадия катализируется ферментом 2-кето-3-деокси-D-арабиногептулозонат-7- фосфатсинтазой (DАНР от англ. 2-кеto-3-(dеоху- D-arabinoheptulosonate 7-phosphate) (стадия (1) на рис. 22-16). У большинства микроорганизмов и растений есть три изозима DАНР-синтазы. Один из этих изозимов аллостерически ингибируется (по механизму отрицательной обратной связи) фенилаланином, другой — тирозином, а третий — триптофаном. Такая работа помогает всему пути отвечать на потребности клетки в одной или более ароматических аминокислот. После разветвления путей от хоризмата существует и дополнительная регуляция. Например, ферменты, катализирующие первые две стадии в синтезе триптофана, аллостерически ингибируются триптофаном.
Краткое содержание раздела 22.2 Биосинтез аминокислот
■ Растения и бактерии синтезируют все 20 протеиногенных аминокислот. Млекопитающие могут синтезировать только около половины этих аминокислот; остальные же аминокислоты должны поступать вместе с пищей (незаменимые аминокислоты).
■ Из заменимых аминокислот глутамат получается восстановительным аминированием α-кетоглутарата и служит в качестве предшественника глутамина, пролина и аргинина. Аланин и аспартат (и аспарагин) образуются в реакции трансаминирования из пирувата и оксалоацетата соответственно. Углеродный скелет серина происходит из 3-фосфоглицерата. Серин является предшественником глицина; β-углеродный атом серина переносится на тетрагидрофолат. У микроорганизмов цистеин образуется из серина и сульфида, полученного восстановлением природного сульфата. Млекопитающие синтезируют цистеин из метионина и серина в последовательности реакций, требующих участия S-аденозилметионина и цистатионина.
■ Из незаменимых аминокислот ароматические аминокислоты (фенилаланин, тирозин и триптофан) образуются через пути, в которых хоризмат — ключевая точка ветвления. Предшественником триптофана и гистидина служит фосфорибозилпирофосфат. Путь синтеза гистидина пересекается с синтезом пуринов. Тирозин также может быть получен гидроксилированием фенилаланина (поэтому это условно незаменимая аминокислота). Пути синтеза других незаменимых аминокислот более сложные.
■ Пути биосинтеза аминокислот аллостерически регулируются конечными продуктами; регуляторный фермент часто находится в начале пути. Регуляция различных синтетических путей происходит координировано.