ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
22. БИОСИНТЕЗ АМИНОКИСЛОТ, НУКЛЕОТИДОВ И РОДСТВЕННЫХ СОЕДИНЕНИЙ
22.3. Производные аминокислот
Помимо того, что из аминокислот построены белки, они служат предшественниками многих специализированных биомолекул, включая гормоны, коферменты, нуклеотиды, алкалоиды, полимеры клеточной стенки, порфирины, антибиотики, пигменты и нейромедиаторы. В этом разделе описаны пути, ведущие к некоторым из этих производных аминокислот.
Глицин — предшественник порфиринов
Биосинтез порфиринов, для которых главным предшественником служит глицин, будет нашим первым примером, так как порфириновое ядро играет ключевую роль при построении гема таких важных белков, как гемоглобин и цитохромы. Порфирины образуются из четырех молекул монопиррольного производного порфобилиногена, который образуется из двух молекул δ-аминолевулината. Существуют два пути, ведущие к δ-аминолевулинату. У высших эукариот (рис. 22-23, а) глицин взаимодействует на первой стадии с сукцинил-СоА с образованием α-амино-β-кетоадипата, который затем декар- боксилируется до δ-аминолевулината. У растений, водорослей и большинства бактерий δ-аминолевулинат образуется из глутамата (рис. 22-23, б). Глутамат сначала превращается в глутамил-тРНКGlu (см. гл. 27, т. 3, о транспортных РНК), который восстанавливается под действием NАDРН до глутамат-1-полуальдегида и полуальдегид отщепляется от тРНК. Превращение глутамат-1-полуальдегида в δ-аминолевулинат осуществляет аминотрансфераза.
Рис. 22-23. Биосинтез δ-аминолевулината. а — у большинства животных, включая млекопитающих, δ-аминолевулинат синтезируется из глицина и сукцинил-СоА. Атомы, полученные от глицина, показаны красным, б — у бактерий и растений предшественником δ-аминолевулината служит глутамат.
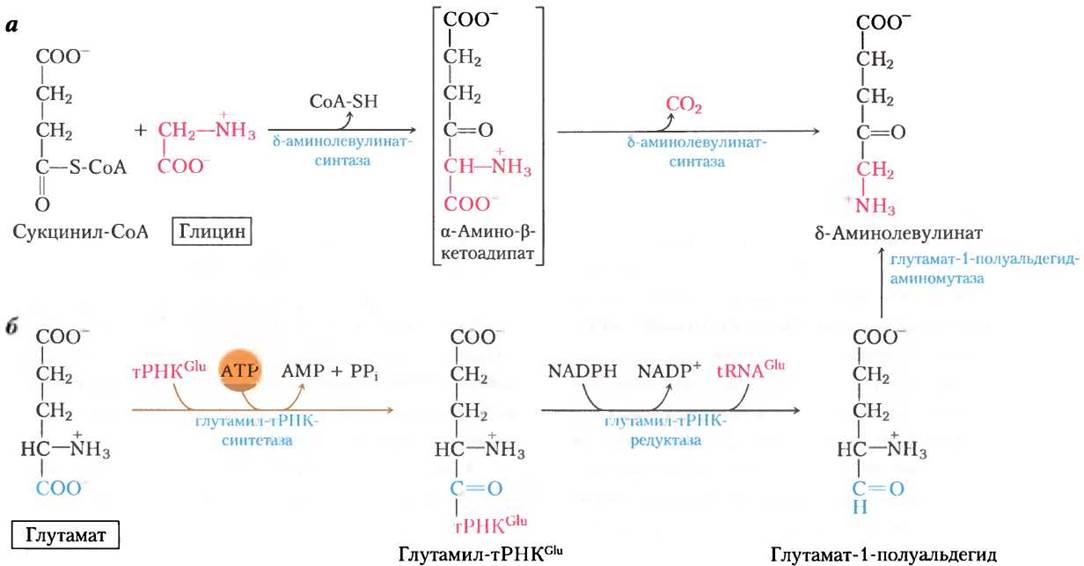
Рис. 22-24. Биосинтез гема из δ-аминолевулината. Ас — ацетил (-СН2СОО-); Рr — пропионил (-СН2СН2СOO-).
Дополнение 22-2. МЕДИЦИНА. Биохимия у королей и вампиров
Порфирии — группа генетических болезней, при которых из-за дефектов ферментов биосинтетического пути от глицина до порфиринов в эритроцитах, жидкостях организма и печени накапливаются специфические предшественники порфирина. Наиболее частая форма этой болезни — острая перемежающая порфирия. Большинство людей с этой болезнью гетерозиготные, и обычно у них нет никаких симптомов, потому что одна копия нормального гена обеспечивает необходимый уровень ферментативной активности. Однако определенный режим питания или условия окружающей среды (что еще плохо изучено) могут вызывать накопление δ-аминолевулината и порфобилиногена, что ведет к приступам острой боли в животе и нарушениям функций нервной системы. У короля Великобритании Георга III вовремя американской революции было несколько приступов очевидного сумасшествия, хотя во всех своих поступках он был вполне нормальным человеком. Симптомы болезни наводят на мысль, что Георг III страдал от острой перемежающей порфирии.
Одна из редких форм порфирии приводит к накоплению уропорфириногена I, предшественника протопорфирина. Это вещество окрашивает мочу в красный цвет, вызывает сильную флуоресценцию зубов в ультрафиолетовом свете и делает кожу болезненно чувствительной к солнечному свету. Многие из таких больных также страдают анемией, потому что у них синтезируется недостаточно гема. Это генетическое расстройство легло в основу мифов о вампирах в народных легендах.
Симптомы многих форм порфирий сейчас успешно контролируются изменением питания или добавлением в пищу гема или производных гема.

У всех организмов две молекулы δ-амино- левулината конденсируются с образованием порфобилиногена, и через ряд сложных ферментативных реакций четыре молекулы порфобилиногена соединяются вместе с образованием протопорфирина (рис. 22-24). После того как собран протопорфирин, в него включается атом железа
в реакции, катализируемой феррохелатазой. У высших эукариот биосинтез порфирина регулируется концентрацией гема, который служит ингибитором первых стадий синтетического пути по принципу отрицательной обратной связи. Генетические дефекты биосинтеза порфиринов могут вести к накоплению интермедиатов пути, что вызывает различные болезни человека, известные под общим названием порфирии (доп. 22-2).
Гем — источник желчных пигментов
Гем (порфириновая группа гемоглобина, содержащая железо), высвобождающийся при гибели эритроцитов в селезенке, распадается с образованием свободного Fе3+ и в итоге билирубина. Внимание к этому пути обусловлено окраской билирубина.
Первая реакция этого двухстадийного пути катализируется гем-оксигеназой (НО — от англ. heme oxygenase), превращающей гем в биливердин, молекула которого содержит четыре пиррольных цикла, соединенных в линейную цепочку (рис. 22-25). Другие продукты этой реакции — свободный ион железа Fe3+ и СО. Железо Fe3+ быстро связывается с ферритином. Монооксид углерода опасен для здоровья, поскольку связывается с гемоглобином (см. доп. 5-1, т. 1); из-за гем-оксигеназной активности, приводящей к образованию СО, около 1% гема организма связано с СО даже в отсутствие вредных условий в окружающей среде.
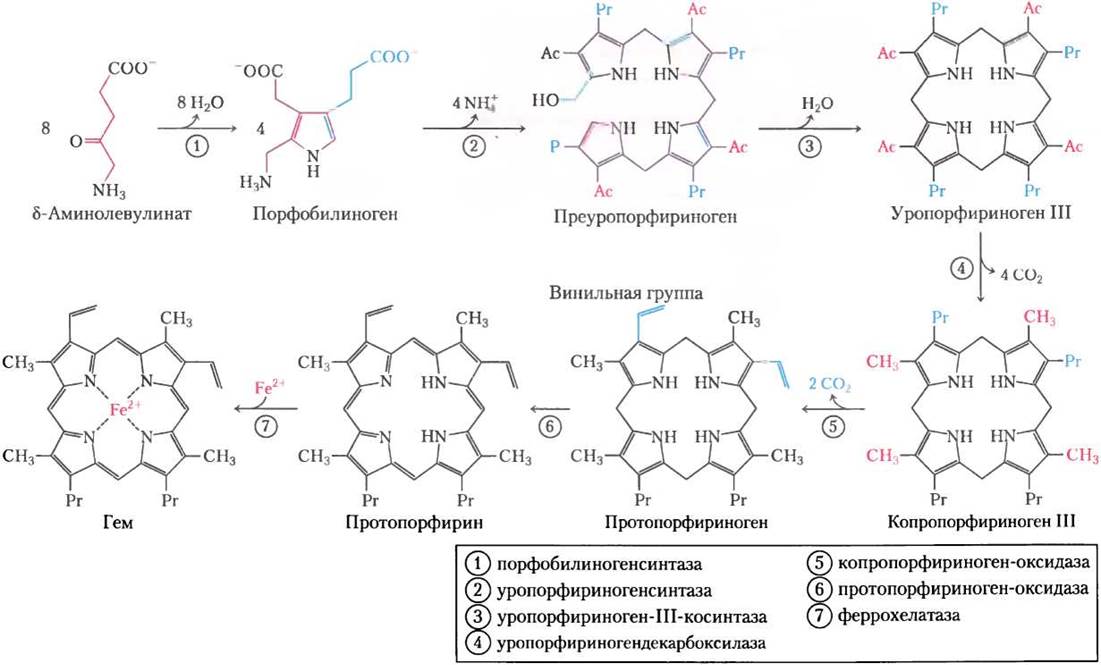
Рис. 22-25. Билирубин и продукты его распада. М — метил; V — винил; Рr — пропионил; Е — этил. Для простоты сравнения все структуры приведены в виде линейных цепочек из пиррольных колец, а не в реальной стереохимической конформации.
Биливердин превращается в билирубин на второй стадии, катализируемой биливердинредуктазой. Эта реакция всем хорошо знакома: при сильном ушибе синяк имеет черный и/или пурпурный цвет из-за гемоглобина, высвободившегося из поврежденных эритроцитов; со временем цвет становится зеленым из-за биливердина, а потом желтым из-за билирубина. Билирубин очень плохо растворим, поэтому он транспортируется кровотоком как комплекс с белком плазмы крови альбумином. В печени билирубин превращается в желчный пигмент билирубин- диглюкуронид. Это вещество достаточно растворимо в воде, чтобы секретироваться вместе с остальными компонентами желчи в тонкий кишечник, где бактериальные ферменты катализируют его превращение в другие продукты, главным образом в уробилиноген. Некоторые количества уробилиногена снова всасываются в кровь и транспортируются к почкам, где происходит превращение в уробилин — вещество, которое обеспечивает моче желтый цвет (рис. 22-25, левая ветвь). Уробилиноген, оставшийся в кишечнике, превращается (в другой реакции, осуществляемой микробами) в стеркобилин (рис. 22-25, правая ветвь пути), который придает коричневый цвет фекалиям.
Ухудшение работы печени или блокировка выделения желчи вызывает «утечку» билирубина из печени в кровь, что проявляется в пожелтении кожи и глазных яблок — желтуха. Анализ крови на билирубин делают при диагностике заболеваний печени. У новорожденных желтуха развивается потому, что у них еще не хватает глюкоронилбилирубинтрансферазы. Обычно с целью удаления избыточного билирубина младенцам назначают освещение флуоресцентной лампой, при этом происходят фотохимические реакции и билирубин превращается в более растворимые соединения, которые легче выводятся из организма.
Эти пути распада гема играют важную роль при защите клеток от окислительного повреждения, а также при регулировании определенных клеточных функций. Монооксид углерода СО, образованный в гем-оксигеназной реакции, токсичен при высоких концентрациях, но при очень низких концентрациях, достигаемых при деградации гема, он выполняет некоторые регуляторные и/или сигнальные функции. Он оказывает сосудорасширяющий эффект (но не такой мощный, как монооксид азота); об этом речь пойдет ниже. В небольших количествах СО также действует как регулятор при передаче нервных импульсов. Билирубин — часто встречающийся антиоксидант в тканях млекопитающих, именно он в основном определяет антиоксидантную активность плазмы. Эта защитная функция имеет особое значение в период развития мозга у новорожденных. Токсичность билирубина, проявляющаяся при желтухе, может быть вызвана его избытком по сравнению с альбумином плазмы, который связывает его.
Учитывая эти весьма различающиеся роли продуктов распада гема, путь его деградации жестко регулируется, главным образом на первой стадии. У человека обнаружены по крайней мере три формы изозима гем-оксигеназы (НО). НО-1 регулируется в высокой степени: экспрессия этого гена индуцируется в широком диапазоне различных стрессовых ситуаций (механическое воздействие, ангиогенез — неконтролируемое развитие кровеносных сосудов, гипоксия, гипероксия, тепловой шок, действие ультрафиолетового излучения, действие пероксида водорода и множество других метаболических повреждений). НО-2 найдена главным образом в мозге и яичках, где она экспрессируется непрерывно. Третий изозим, НО-3, недостаточно охарактеризован. ■
Аминокислоты — предшественники креатина и глутатиона
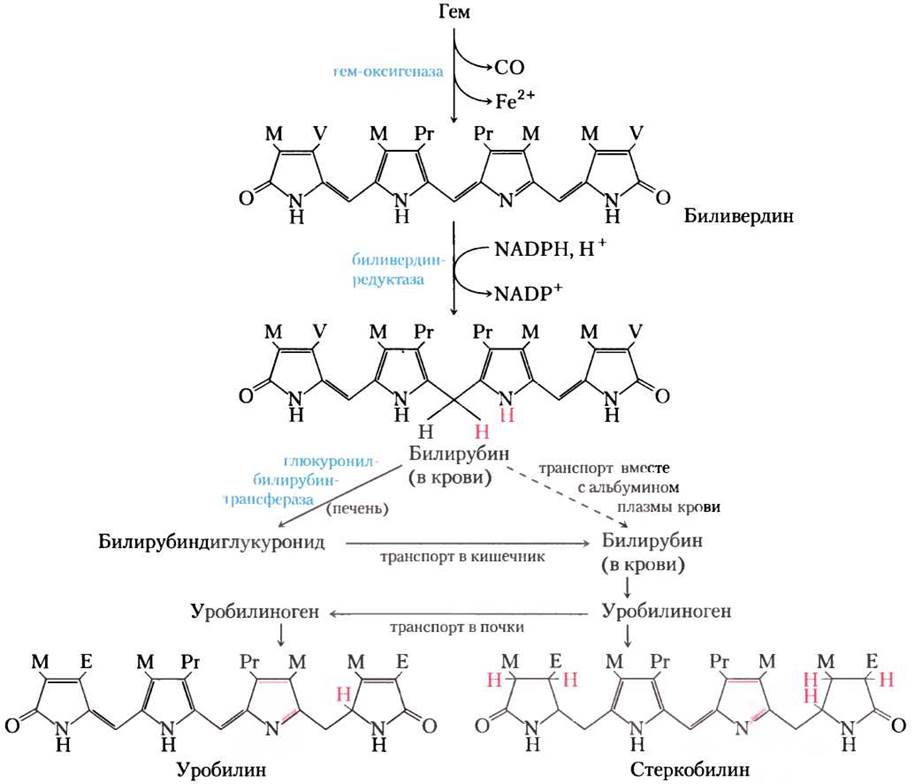
Фосфокреатин, образующийся из креатина, действует как важный энергетический буфер в скелетных мышцах (см. рис. 13-15). Креатин синтезируется из глицина и аргинина (рис. 22-26); метионин в виде S-аденозилметионина служит донором метильной группы.
Рис. 22-26. Биосинтез креатина и фосфокреатина. Креатин синтезируется из трех аминокислот: глицина, аргинина и метионина. Этот путь показывает, что аминокислоты могут быть предшественниками в биосинтезе и других азотсодержащих биомолекул.
Глутатион (GSH) присутствует в растениях, животных и некоторых бактериях, часто в высоких концентрациях, и считается окислительно-восстановительным буфером. Он синтезируется из глицина, глутамата и цистеина (рис. 22-27). y- Карбоксильная группа глутамата активируется АТР с образованием ацилфосфатного интермедиата, который затем атакуется α-аминогруппой цистеина. После этого следует вторая реакция конденсации, в которой α-карбоксильная группа цистеина активируется ацилфосфатом, что позволяет ей взаимодействовать с глицином. Окисленная форма глутатиона (GSSG), продуцируемая в случае его окислительно-восстановительной активности, содержит две молекулы глутатиона, соединенные дисульфидным мостиком.
Рис. 22-27. Метаболизм глутатиона, а — биосинтез глутатиона. б — восстановленная форма глутатиона.
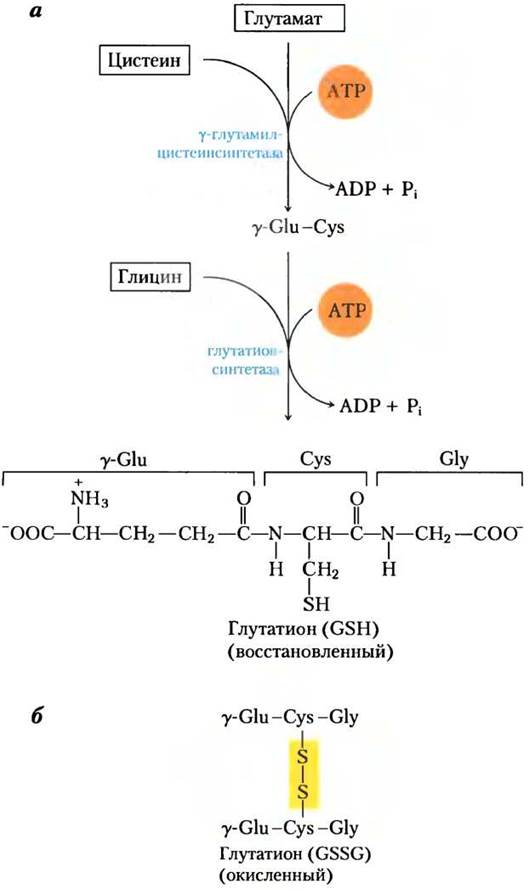
Возможно, глутатион позволяет поддерживать сульфгидрильные группы белков в восстановленном состоянии, а железо гема в двухвалентном состоянии (Fе2+) и служит восстанавливающим агентом для глутаредоксина при синтезе дезоксирибонуклеотидов (см. рис. 22-39). Его окислительно-восстановительные свойства также используются для удаления токсичных пероксидов, образованных при нормальном развитии при аэробных условиях:
2 GSН + R-О-О-Н —> GSSG + Н2O +R-ОН
Эта реакция катализируется глутатионпероксидазой, ферментом, который примечателен тем, что содержит атом селена (Sе), включенный в селеноцистеин (см. рис. 3-8, а) и необходимый для его активности.
D-Аминокислоты найдены главным образом у бактерий
В белках D-аминокислоты обычно не встречаются, однако они выполняют некоторые специальные функции в структуре бактериальной клеточной стенки и входят в состав пептидных антибиотиков. Бактериальный пептидогликан (см. рис. 20-31) содержит D-аланин и D-глутамат. D-Аминокислоты образуются из L-изомеров под действием рацемаз аминокислот, которые в качестве кофактора используют пиридоксальфосфат (см. рис. 18-6). Не вызывает сомнений, что в настоящее время рацемизация аминокислот имеет большое значение для метаболизма бактерий, поэтому ферменты, такие как аланинрацемаза, выступают первичными целями для действия фармацевтических агентов. Один из таких агентов, L-фтораланин, был проверен в качестве антибактериального лекарства. Другой, циклосерин, используется при лечении туберкулеза. К сожалению, эти ингибиторы также воздействуют на некоторые РLР-зависимые ферменты человека, поэтому они могут вызывать нежелательные побочные эффекты. ■
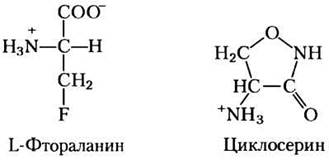
Ароматические аминокислоты — предшественники многих растительных веществ
У растений фенилаланин, тирозин и триптофан превращаются в ряд важных соединений. Лигнин — твердое высокомолекулярное соединение, он образуется из фенилаланина и тирозина, по распространенности в растительных тканях уступает только целлюлозе. Полимерная структура лигнина пока недостаточно изучена. Триптофан служит предшественником гормона роста растений индол-3-ацетата, или ауксина (рис. 22-28, а), который участвует в регуляции очень многих биологических процессов в растениях.
Рис. 22-28. Биосинтез двух характерных для растений веществ из аминокислот, а — индол-3-ацетат (ауксин) и б — циннамат (вещество, придающее вкус корице).
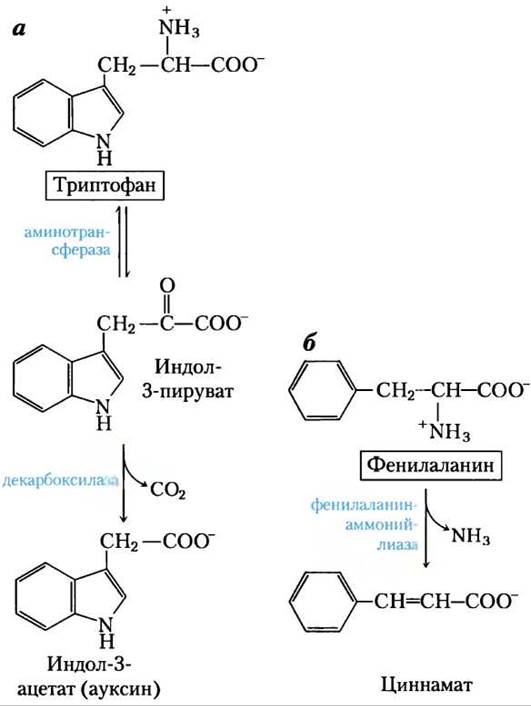
Из фенилаланина и тирозина также образуются много коммерчески значимых натуральных продуктов (природных соединений), включая танины, которые тормозят процессы окисления в винах; алкалоиды, такие как морфин, который оказывает мощное физиологическое действие на организм человека; алкалоиды содержатся также в приправах (корице, мускатном орехе, гвоздике, ванили, красном перце и других).
Биологические амины — продукты декарбоксилирования аминокислот
Многие важные нейромедиаторы представляют собой первичные или вторичные амины, получающиеся из аминокислот по довольно простому пути. Вдобавок некоторые полиамины, которые образуют комплексы с ДНК, синтезируются из аминокислоты орнитина, участника цикла мочевины. Реакция декарбоксилирования, общая для нескольких путей метаболизма, — это другой РLР-зависимый процесс (см. рис. 18-6).
Синтез некоторых нейромедиаторов показан на рис. 22-29. Из тирозина образуются вещества семейства катехоламинов: дофамин, норадреналин и адреналин. Помимо всего прочего, уровень катехоламинов коррелирует с изменением кровяного давления. Нервное расстройство болезнь Паркинсона вызывается уменьшенным производством дофамина, и обычно эту болезнь лечат, назначая L-дофа. Усиленное выделение дофамина в мозге может быть связано с такими физиологическими расстройствами, как шизофрения.
Рис. 22-29. Биосинтез некоторых нейромедиаторов из аминокислот. В каждом случае ключевая стадия одинакова — это РLР-зависимое декарбоксилирование (выделено розовым).
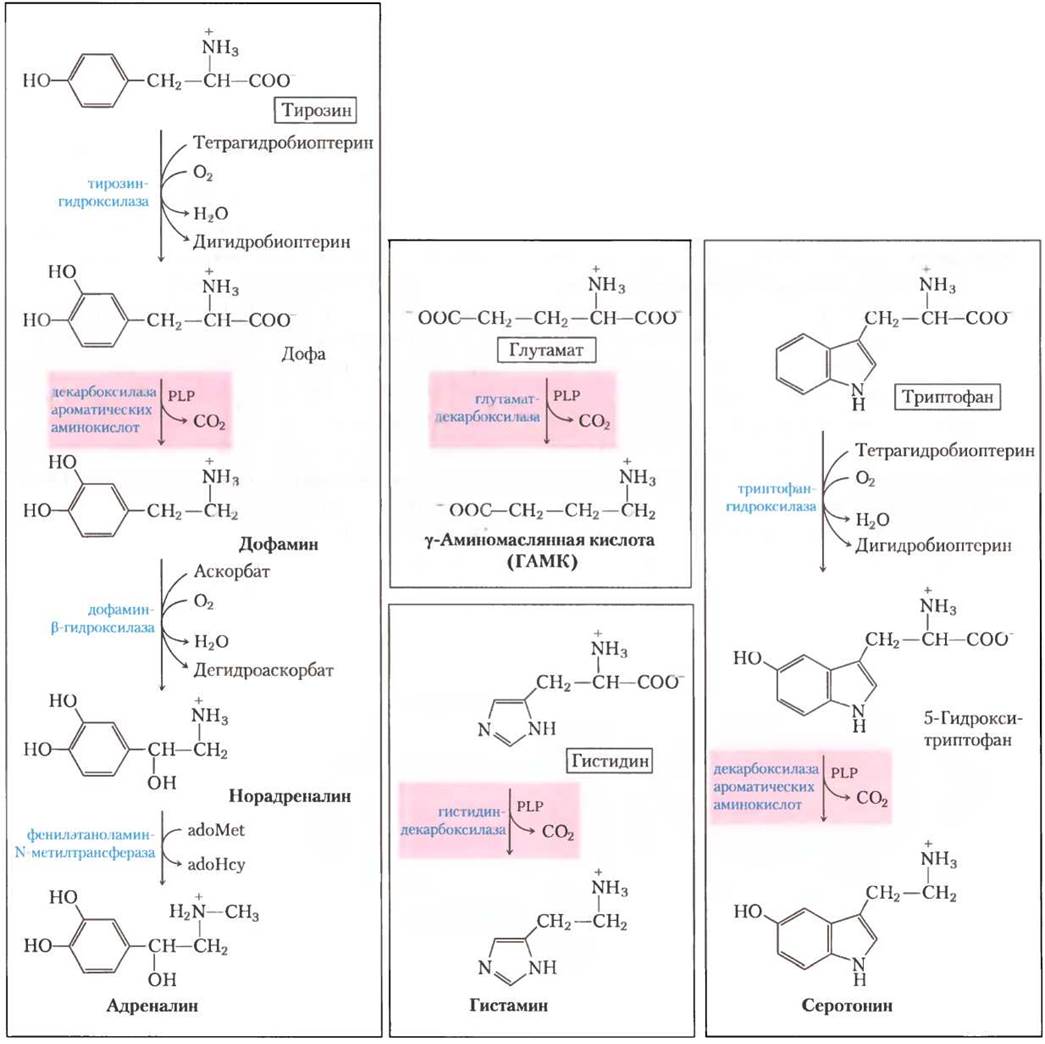
При декарбоксилировании глутамата образуется y-аминомаслянная кислота (ГАМК), тормозной медиатор. Недостаток этого вещества вызывает приступы эпилепсии. При лечении эпилепсии и гипертензии используются аналоги ГАМК Уровень ГАМК может быть также повышен при употреблении ингибиторов фермента, ответственного за деградацию ГАМК — ГАМК-аминотрансферазы. Другой важный нейромедиатор серотонин синтезируется в две стадии из триптофана.
Из гистидина при декарбоксилировании образуется гистамин, который оказывает мощное сосудорасширяющее действие в тканях животных. Гистамин высвобождается в больших количествах при аллергических реакциях, он также стимулирует секрецию кислоты в желудке. Ведется активная разработка антигистаминных препаратов широкого спектра действия, тем не менее все они так или иначе влияют на синтез или накопление гистамина. Известный пример антагониста гистаминового рецептора — циметидин(Тагамет), структурный аналог гистамина:
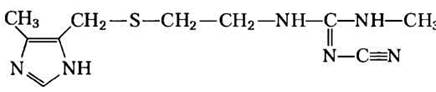
Его назначают при язве двенадцатиперстной кишки, чтобы ингибировать секрецию кислоты в желудке.
Дополнение 22-3. МЕДИЦИНА. Лечение африканской сонной болезни биохимическим «троянским конем»
Африканская сонная болезнь, или африканский трипаносомоз, вызывается простейшими (одноклеточными эукариотами) трипаносомами (рис. 1). Эта болезнь (и родственные болезни, вызываемые трипаносомами) имеет медицинское и экономическое значение во многих развивающихся странах. Совсем недавно это заболевание было практически неизлечимо. Вакцины неэффективны, потому что у этого паразита есть необычный механизм ускользания от иммунной системы хозяина.
Рис. 1. Trypanosoma brucei rhodesiense, одна из нескольких известных трипаносом, который вызывают африканскую сонную болезнь.
Клеточная стенка трипаносом покрыта единственным белком — антигеном, на который отвечает иммунная система. Но время от времени в процессе генетической рекомбинации (см. табл. 28-1, т. 3) некоторые клетки в популяции инфицирующей трипаносомы переключаются на синтез нового белка оболочки и уже не распознаются иммунной системой. Процесс «смены оболочки» может происходить сотни раз. В результате развивается хроническая циклическая инфекция: у зараженного человека наблюдается жар, который затихает, как только иммунная система отбивает первую инфекцию, затем трипаносомы с изменившейся оболочкой вызывают следующую инфекцию, и жар возвращается. Этот цикл может длиться неделями, и в итоге ослабленный больной погибает.
Некоторые современные подходы при лечении африканской сонной болезни основаны на понимании метаболизма и действия ферментов. По крайней мере в одном из способов лечения используются фармацевтические препараты, разработанные как инактиваторы, основанные на механизме работы фермента (суицидные инактиваторы, или необратимые ингибиторы; с. 298, т. 1). Уязвимой точкой метаболизма трипаносом является путь биосинтеза полиаминов. Быстроделящимся клеткам требуются в больших количествах полиамины спермин и спермидин, используемые при упаковке ДНК. Первая стадия их синтеза катализируется PLP-зависимым ферментом орнитинкарбоксилазой (см. рис. 22-30). В клетках млекопитающих орнитиндекарбоксилаза находится в постоянном обороте, т. е. фермент постоянно синтезируется и разрушается. Однако у некоторых трипаносом по не вполне понятным причинам фермент довольно стабилен и заменяется заново синтезированным довольно медленно. Ингибитор орнитиндекарбоксилазы, который надолго связывается с ферментом, слабо влияет на клетки человека, где инактивированный фермент быстро заместится новой молекулой, но сильно навредит клеткам паразита.
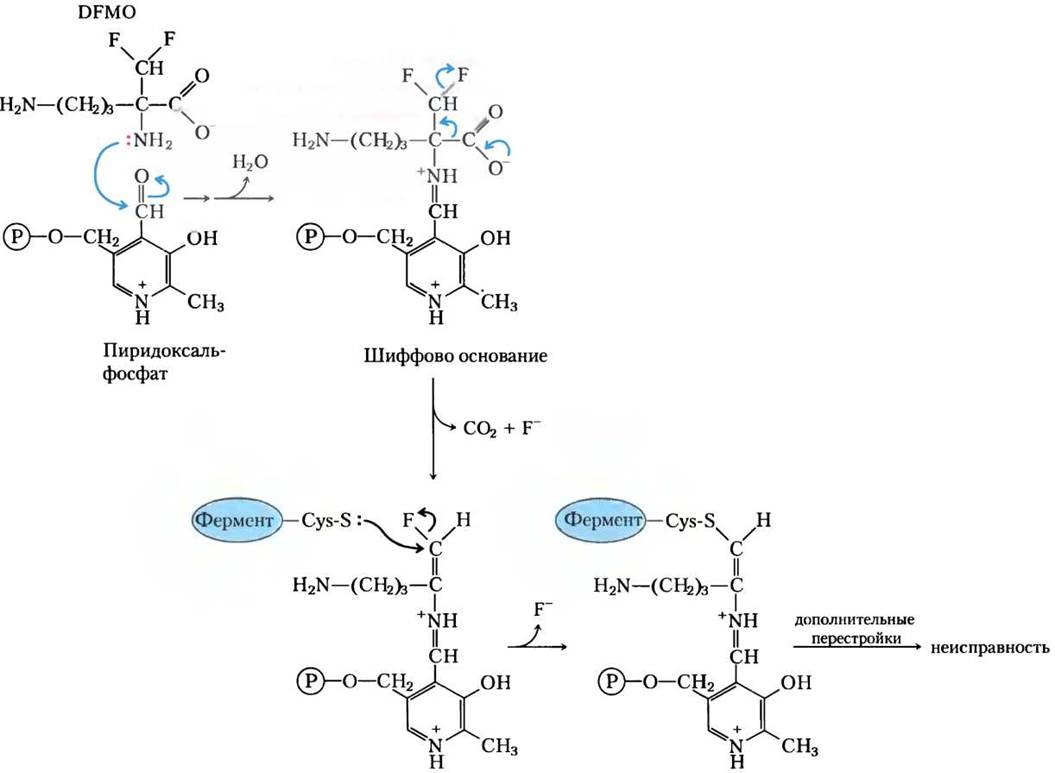
Первые несколько стадий орнитиндекарбоксилазной реакции показаны на рис. 2. При удалении СO2 поток электронов разворачивается в обратную сторону и образуется путресцин (см. рис. 22-30). На основе этого механизма было разработано несколько необратимых суицидных инактиваторов, один из которых дифторметилорнитин (ДФМО). ДФМО относительно инертный в растворе. Но, когда это вещество связывается с орнитиндекарбоксилазой, фермент быстро инактивируется (рис. 3). Ингибитор действует, вызывая альтернативный сток электронов в виде двух подходяще расположенных атомов фтора, которые служат великолепными «проводящими» группами. Вместо того, чтобы электронам перемещаться на циклическую структуру (PLP), реакция заканчивается замещением атома фтора. Атом серы остатка Cys в активном центре фермента затем образует ковалентный комплекс с высокореакционноспособным аддуктом PLP и ингибитора — абсолютно необратимая реакция. Таким образом, ингибитор использует собственный механизм ферментативной реакции для того, чтобы остановить процесс.
Рис. 2. Механизм орнитиндекарбоксилазной реакции.
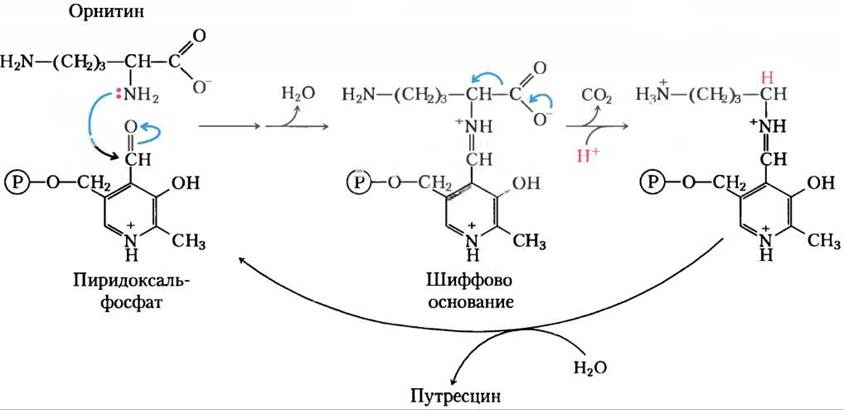
Рис. 3. Ингибирование орнитиндекарбоксилазы необратимым суицидным инактиватором ДФМО.
В клинических испытаниях ДФМО показал высокую эффективность против африканской сонной болезни и сейчас используется при лечении африканской сонной болезни, вызванной T. brucei gambiense. Подходы к терапии инфекций, подобные показанному здесь, обещают большие успехи в лечении широкого ряда заболеваний. Разработка препаратов, основанная на механизме ферментативной реакции и на строении ферментативного комплекса может дополнить традиционные методы проб и ошибок в развивающейся фармацевтике.
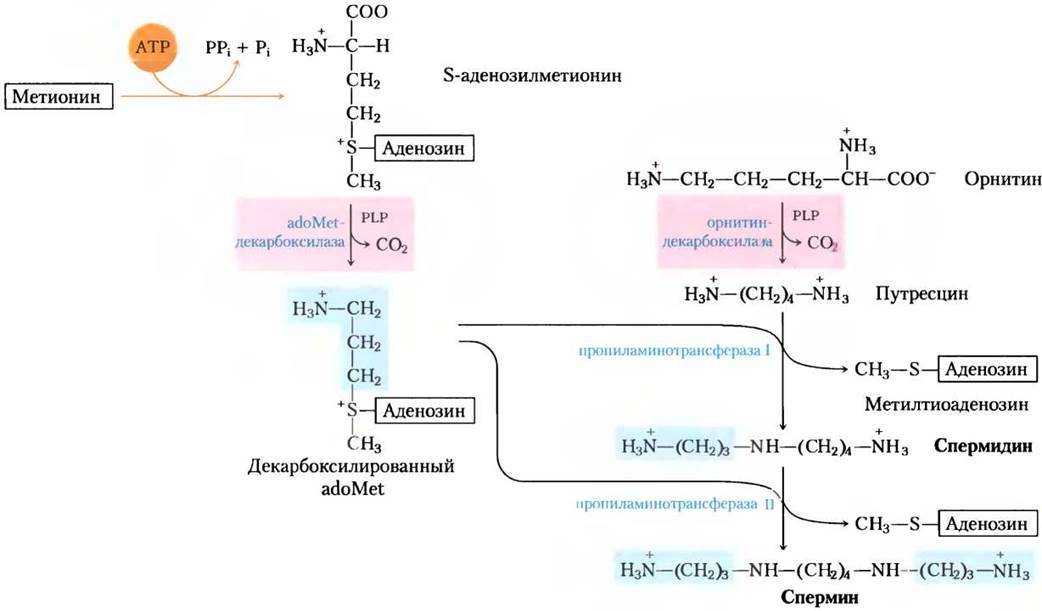
Полиамины, такие как спермин и спермидин, участвуют в упаковке ДНК. Они образуются из метионина и орнитина в пути, показанном на рис. 22-30. Первая стадия — декарбоксилирование орнитина, предшественника аргинина (рис. 22-10). Орнитиндекарбоксилаза, РLР-зависимый фермент, ингибируется некоторыми мощными лекарственными препаратами (доп. 22-3). ■
Рис. 22-30. Биосинтез спермидина и спермина. РLР-зависимые стадии декарбоксилирования выделены розовым. В этих реакциях S-аденозилметионин (в декарбоксилированной форме) служит источником пропиламиногрупп (выделено голубым).
Аргинин — предшественник оксида азота в биологическом синтезе
Удивительным открытием в середине 1980-х гг. было выяснение роли в живых организмах монооксида азота NO, ранее известного главным образом как компонент смога. Это газообразное вещество выполняет функцию важного биологического мессенджера. Монооксид азота легко диффундирует через мембраны, хотя из-за своей высокой реакционной способности расстояние, на которое NО может диффундировать, составляет всего ~ 1 мм от места его синтеза. У человека NО играет важную роль в ряде физиологических процессов, включая передачу нервного импульса, свертывание крови и контроль кровяного давления. Способ действия NО описан в гл. 12 (с. 628, т. 1).
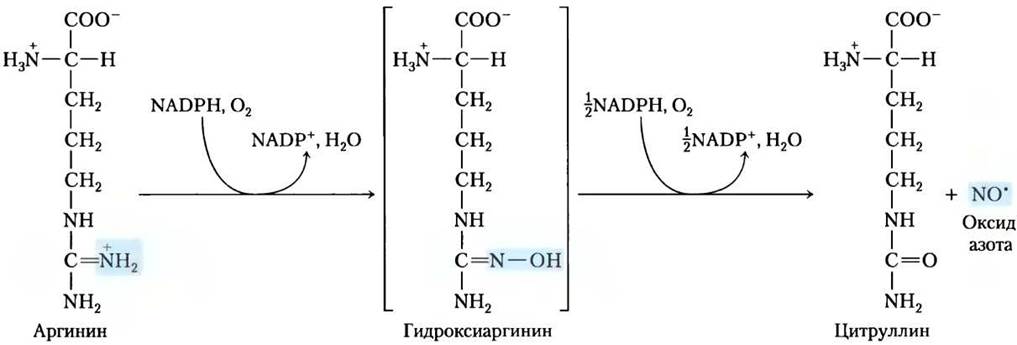
Монооксид азота синтезируется из аргинина в NАDРН-зависимой реакции, катализируемой синтазой оксида азота (рис. 22-31), димерная молекула которой структурно схожа с цитохром-Р-450-редуктазой (см. доп. 21-1). Реакция представляет собой окисление с участием пяти электронов. Каждая субъединица фермента связывает по одной молекуле каждого из четырех разных кофакторов: FМN, FРАD, тетрагидропте- рин и гемовое железо Fе3+. NO — нестабильная молекула и не может запасаться. Ее синтез стимулируется взаимодействием синтазы NO с Са2+- кальмодулином (см. рис. 12-21, т. 1).
Рис. 22-31. Биосинтез монооксида азота. Обе стадии катализируются синтазой оксида азота. Атом азота в молекуле NО поступает от гуанидиновой группы аргинина.
Краткое содержание раздела 22.3 Производные аминокислот
■ Большинство важных биомолекул образуется из аминокислот. Глицин является предшественником порфиринов. Деградация железосодержащего порфирина (гема) вызывает образование билирубина, который превращается в желчные пигменты, выполняющие ряд физиологических функций.
■ Энергетические буферы креатин и фосфокреатин синтезируются из глицина и аргинина. Глутатион, образующийся из трех разных аминокислот, служит важным восстанавливающим агентом в клетке.
■ Бактерии синтезируют D-аминокислоты из L-аминокислот в реакции рацемизации, осуществляющейся с использованием пиридоксальфосфата (PLP).
■ Ароматические аминокислоты служат источником многих специфических для растений веществ. При PLP-зависимом декарбоксилировании некоторых аминокислот образуются важные биологические амины, включая нейромедиаторы.
■ Аргинин играет роль предшественника оксида азота, биологического мессенджера.