ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
22. БИОСИНТЕЗ АМИНОКИСЛОТ, НУКЛЕОТИДОВ И РОДСТВЕННЫХ СОЕДИНЕНИЙ
22.4. Биосинтез и деградация нуклеотидов
Как было описано в гл. 8 (т. 1), нуклеотиды играют ряд важных ролей в клетке. Они служат предшественниками ДНК и РНК. Они необходимы при переносе энергии — в первую очередь АТР, а также в некоторой степени GTP. Они входят в состав кофакторов NAD, FAD, S-аденозилметионина и кофермента А и в активированные интермедиаты биосинтеза, такие как UDP-глюкоза и CDP-диацилглицерин. Некоторые нуклеотиды, например, сАМР и cGMP, представляют собой вторичные мессенджеры.
Получение нуклеотидов может идти двумя путями: синтез de novo и путь реутилизации. Синтез нуклеотидов de novo начинается с их метаболических предшественников: аминокислот, рибозо-5- фосфата, СО2 и NH3. При реутилизации повторно используются свободные основания и нуклеотиды, образованные при распаде нуклеиновых кислот. Оба пути биосинтеза важны для клеточного метаболизма и рассмотрены далее в этой главе.
Вероятно, синтез пуринов и пиримидинов de novo практически одинаков у всех живых организмов. Примечательно, что гуанин, аденин, тимин, цитидин и урацил не интермедиаты этого пути, т. е. не происходит синтез, а затем присоединение оснований к рибозе, как это можно было бы ожидать. Пуриновое кольцо «строится» непосредственно присоединением к рибозе одного или нескольких атомов один раз за весь цикл биосинтеза. Пиримидиновое кольцо синтезируется в виде оротата, который присоединяется к рибозофосфату, а затем превращается в общие пиримидиновые нуклеотиды, нужные для синтеза нуклеиновых аминокислот. Свободные основания не участвуют в синтезе de novo, они появляются как интермедиаты в некоторых путях реутилизации.
Некоторые важные предшественники участвуют в синтезе de novo и пуринов, и пиримидинов. Фосфорибозилпирофосфат (PRPP) важную роль в синтезе и тех и других, и в отличие от биосинтеза триптофана и гистидина в нуклеотиде в итоге остается молекула рибозы, как было показано ранее. При синтезе нуклеотидов главное — это аминокислота — глицин для пуринов, аспартат для пиримидинов. Глутамин опять служит самым важным источником аминогрупп — на пяти различных стадиях путей de novo. Аспартат также используется в качестве донора аминогруппы в двух реакциях при синтезе пуринов.
Две особенности синтеза нуклеотидов заслуживают внимания. Во-первых, ферменты в клетках представлены большими полиферментными комплексами, особенно те, которые участвуют в синтезе пуринов de novo, и об этом мы будем часто говорить при обсуждении метаболизма. Во- вторых, клеточный пул нуклеотидов (всех, кроме АТР) довольно невелик и составляет, вероятно, ~1% или менее нужного количества для синтеза клеточной ДНК. Поэтому клетки должны продолжать синтезировать нуклеотиды и во время образования нуклеиновых кислот, а в некоторых случаях синтез нуклеотидов может лимитировать скорость репликации ДНК и транскрипции. Из-за важности этих биологических процессов для делящейся клетки препараты, ингибирующие синтез нуклеотидов, получили заслуженное признание в современной медицине.
Мы рассмотрим здесь биосинтетические пути пуринов и пиримидинов и их регуляцию, образование дезоксинуклеотидов и распад пуринов и пиримидинов до мочевой кислоты и мочевины. Закончим наше обсуждение изучением химиотерапевтических агентов, которые влияют на синтез нуклеотидов.
Синтез нуклеотидов de novo начинается с PRPP
Два основных пуриновых нуклеотида, входящих в состав нуклеиновых кислот, аденозин-5'-монофосфат (АМР; аденилат) и гуанозин-5'-монофосфат (GMP; гуанилат) содержат пуриновые основания аденин и гуанин. На рис. 22-32 показано происхождение атомов углерода и азота в пуриновом кольце — установлено Джоном Бьюкененом на птицах в экспериментах с использованием изотопных меток. Детализированный путь биосинтеза пуринов был выявлен главным образом Бьюкененом и Дж. Робертом Гринбергом в 1950-х гг.
Джон Бьюкенен

Рис. 22-32. Происхождение атомов пуринового кольца. Данные были получены из экспериментов с предшественниками, содержащими радиоактивную метку 14С или 15N. Формиат — в виде N10-формилтетрагидрофолата.
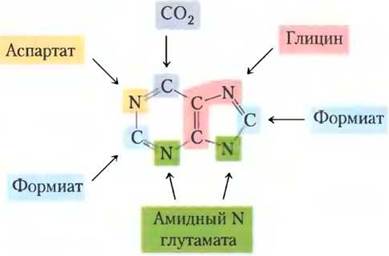
На первой стадии этого пути аминогруппа от глутамата присоединяется к С-1 атому РRРР (рис. 22-33). Образованный 5-фосфорибозиламин очень неустойчив, при pH 7,5 время полураспада 30 с. Затем на этой структуре достраивается пуриновое кольцо. Описанный здесь путь у всех организмов одинаков, кроме одной стадии, которая отличается у высших эукариот, как будет показано ниже.
Вторая стадия — это присоединение трех атомов глицина (рис. 22-33, стадия (2)). В этой реакции конденсации на активацию карбоксильной группы глицина (в виде ацилфосфата) тратится АТР. Затем к аминогруппе глицина добавляется формил от N10-формилтетрагидрофолата (стадия (3)), а от глутамина — атом азота (стадия (4)), после чего следует реакция дегидратации и замыкание цикла, ведущее к образованию пятичленного имидазольного кольца пуринового ядра, — и получается 5-аминоимидазолрибонуклеотид (AIR; стадия (5)).
Рис. 22-33. Синтез пуриновых нуклеотидов de novo: образование пуринового кольца инозината (IMP). Каждый новый поступивший в пуриновое кольцо атом показан цветом, соответствующим рис. 22-32. После стадии (2) R обозначает 5-фосфо-D-рибозильную группу, на которой строится пуриновое кольцо. Образование 5-фосфорибозиламина (стадия (1)) — первая стадия пути синтеза пурина. Обратите внимание, что продукт AICAR стадии (9) присутствует и в биосинтезе гистидина (см. рис. 22-20, стадия (5)). Для облегчения называния ферментов многим интермедиатам даны аббревиатуры. Стадия (6a) протекает у высших эукариот.
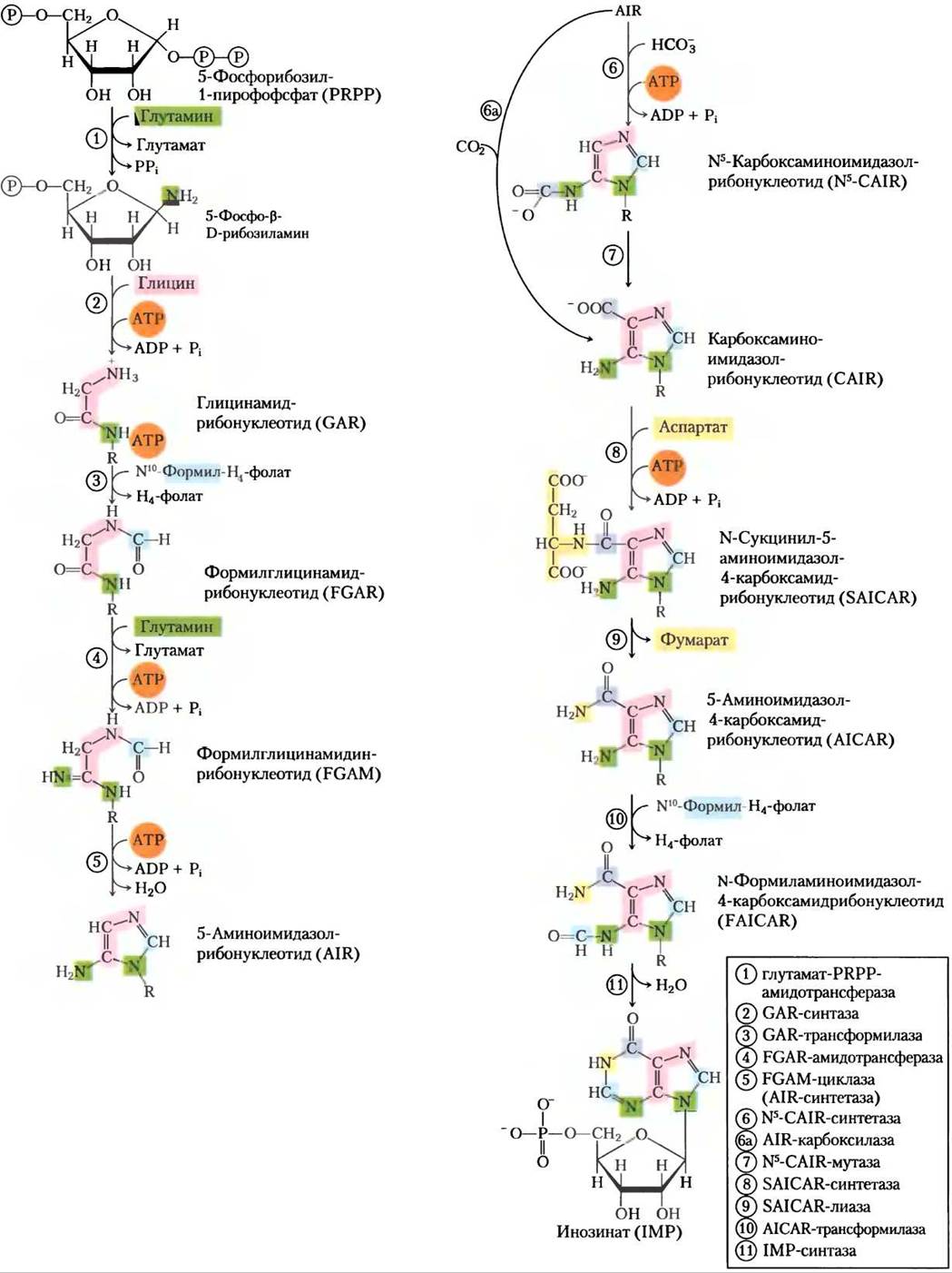
На этой стадии три из шести атомов, необходимых для построения второго кольца в пуриновой структуре, уже на своем месте. Для того чтобы закончить этот процесс, сначала присоединяется карбоксильная группа (стадия (6)). Это карбоксилирование несколько необычно, так как в реакции используется не биотин, а гидрокарбонат, присутствующий в водном окружении в достаточном количестве. При перегруппировке карбоксилат с внециклической аминогруппы переносится на четвертый атом имидазольного кольца (стадия (7)). Стадии (6) и (7) есть у бактерий и грибов. У высших эукариот, и у человека в том числе, 5-аминоимидазолнуклеотид, образованный на стадии (5), карбоксилируется непосредственно с образованием карбоксиаминоимидазолрибонуклеотида в одну, а не в две стадии (стадия (6a)). Фермент, катализирующий эту реакцию, называется карбоксилазой аминоими- дазолрибонуклеотида(АIR-карбоксилаза).
В двух последующих стадиях ((8) и (9)) аспартат служит донором аминогрупп: происходит образование амидной связи, которое сопровождается удалением углеродного скелета аспартата (в виде фумарата). Вспомните, что аспартат играет аналогичную роль на двух стадиях цикла мочевины (см. рис. 18-10). Последний атом углерода поступает от N10-формилтетрагидрофолата (стадия (10)), и замыкание второго цикла приводит к образованию второго смежного кольца пуринового ядра (стадия (11)). Так образуется первый интермедиат инозинат (IMP) с полностью готовым пуриновым кольцом.
Как в триптофановом и гистидиновом биосинтетических путях, ферменты, участвующие в синтезе IMP, в клетке организованы в огромный мультиферментный комплекс. Это снова подтверждается существованием отдельных полипептидов с несколькими функциями, в том числе они катализируют непоследовательные стадии данного пути. В эукариотических клетках, от дрожжей до плодовых мушек и кур, стадии (1), (3) и (5) (рис. 22-33) катализируются многофункциональным белком. Вдобавок многофункциональный белок катализирует стадии (10) и (11). У человека многофункциональный фермент совмещает активности AIR-синтазы и SAICAR-синтетазы (стадии (6a) и (8)). У бактерий эти активности представлены разными белками, но в их клетках может существовать огромный не- ковалентно связанный комплекс. Туннелирование интермедиатов реакций от одного фермента к другому, которое возможно благодаря существованию такого комплекса, вероятно, имеет особенно важное значение для неустойчивых интермедиатов, например, для 5-фосфорибозиламина.
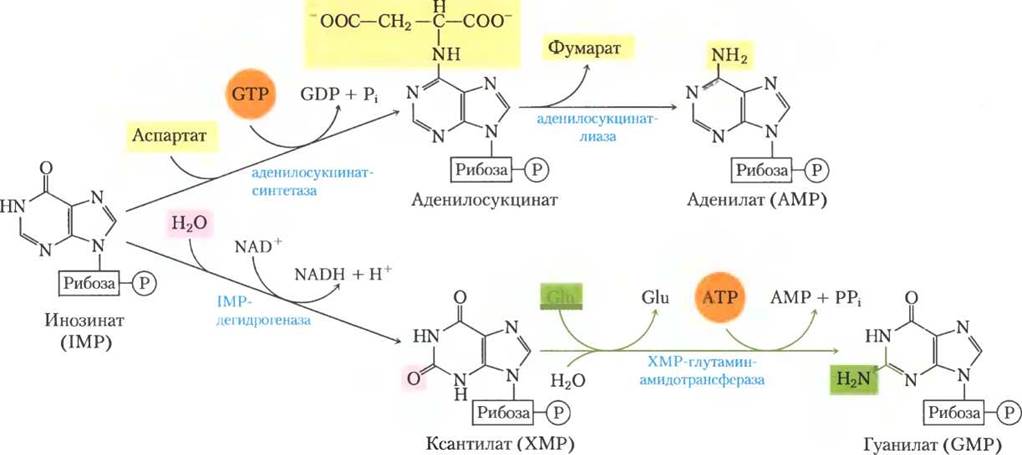
Для превращения инозината в аденилат необходимо внедрение аминогруппы, полученной от аспартата (рис. 22-34); это осуществляется в две стадии, похожие на те, что происходят при включении атома N-1 в пуриновое кольцо (рис. 22-33, стадии (8) и (9)). Главное отличие в том, что для синтеза аденозилсукцината как источник высокоэнергетического фосфата используется GTP, а не АТР. Гуанилат образуется при NАD+-зависимом окислении инозината, сопровождающимся добавлением аминогруппы, взятой с глутамина. На финальной стадии АТР расщепляется на АМР и PPi (рис. 22-34).
Рис. 22-34. Биосинтез АМР и GMP из IMP.
Биосинтез нуклеотидов регулируется по механизму отрицательной обратной связи
При регуляции общей скорости синтеза пуриновых нуклеотидов de novo и отношения скоростей образования двух конечных продуктов аденилата и гуанилата совместно действуют три главных управляющих механизма (рис. 22-35). Первый механизм регулирует первую реакцию, которая уникальна для синтеза пуринов, — перенос аминогруппы на РRРР с образованием 5-фосфорибозиламина. Эта реакция катализируется аллостерическим ферментом глутамин-РRРР-амидотрансферазой, которая ингибируется конечными продуктами IMP, АМР и GMP. В этом согласованном ингибировании АМР и GMP действуют совместно, усиливая эффект друг друга. Таким образом, какой бы продукт ни накапливался в избытке, АМР или GMP, первая стадия биосинтеза из PRPP всегда будет частично ингибироваться.
Рис. 22-35. Регуляция биосинтеза адениновых и гуаниновых нуклеотидов у Е. coli. Регуляция этих путей у других организмов отличается.
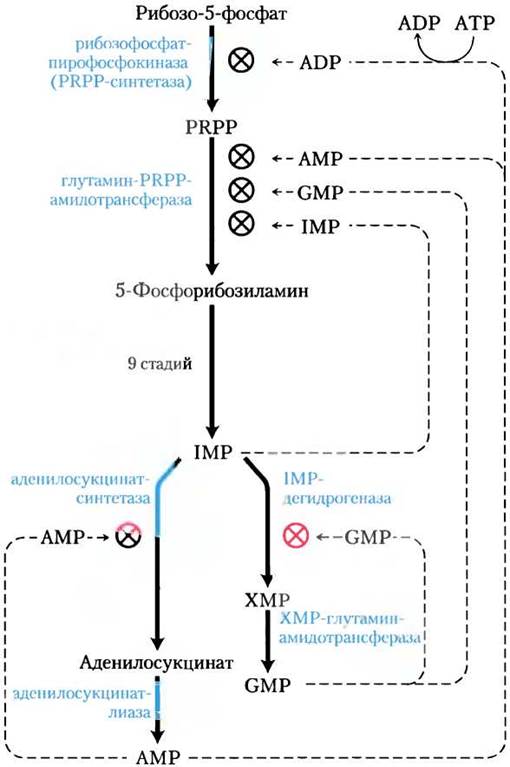
Второй контролирующий механизм, приводимый в действие на более поздней стадии, основан на том, что избыток GMP в клетке ингибирует образование ксантилата из инозината под действием IMP-дегидрогеназы без влияния на образование АМР (рис. 22-35). И наоборот, накопление аденилата ингибирует синтез аденозилсукцината аденозилсукцинатсинтетазой без воздействия на образование GMP. Работу третьего механизма обеспечивает то, что при превращении IMP в АМР необходим GTP (рис. 22-34), в то время как при превращении IMP в GMP требуется АТР — взаиморегуляция, которая поддерживает баланс при синтезе двух рибонуклеотидов.
Последний механизм контроля — это ингибирование синтеза PRPP аллостерической регуляцией рибозофосфатпирофосфокиназы. Этот фермент, помимо метаболитов других путей, которые начинаются с PRPP, ингибируется еще ADP и GDP.
Пиримидиновые нуклеотиды образуются из аспартата, PRPP и карбамоилфосфата
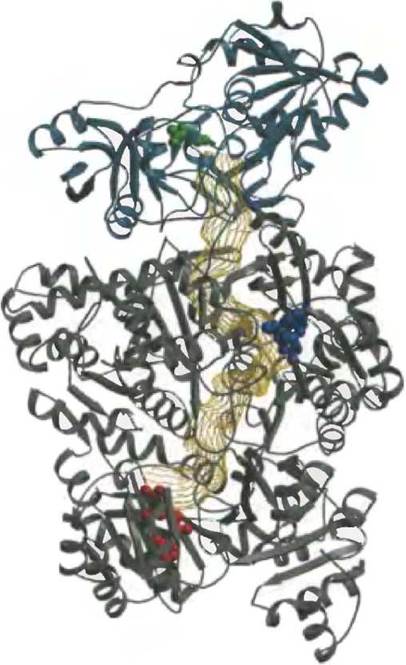
К обычным пиримидиновым нуклеотидам относятся цитидин-5'-монофосфат (СМР; цитидилат) и уридин-5'-монофосфат (UMP; уридилат), которые содержат пиримидины цитозин и урацил. Биосинтез пиримидиновых нуклеотидов de novo (рис. 22-36) несколько отличается от синтеза пуриновых нуклеотидов; шестичленное пиримидиновое кольцо сначала присоединяется к рибозо-5-фосфату. Для этой реакции необходим карбамоилфосфат, еще один интермедиат цикла мочевины (см. рис. 18-10). Однако, как мы отмечали в гл. 18, нужный для цикла мочевины карбамоилфосфат у животных синтезируется карбамоилфосфатсинтетазой I в митохондриях, в то время как карбамоилфосфат, участвующий в биосинтезе пиримидинов, образуется в цитозоле другой формой фермента, карбамоилфосфатсинтетазой II. У бактерий поток карбамоилфосфата и для синтеза аргинина, и для синтеза пиримидина обеспечивает один-единственный фермент. Бактериальный фермент имеет три различных активных центра, разделенные каналом длиной около 100 Á (рис. 22-37). Бактериальная карбамоилфосфатсинтетаза дает яркий пример туннелирования нестабильных интермедиатов реакции между активными центрами.
Рис. 22-36. Синтез пиримидиновых нуклеотидов de novo: биосинтез UTP и СТР через оротидилат. Пиримидин образуется из карбамоилфосфата и аспартата. Затем оротатфосфорилтрансфераза добавляет рибозо-5-фосфат к завершенному пиримидиновому кольцу. Первая стадия этого пути (здесь не показана; см. рис. 18-11, а) — синтез карбамоилфосфата из СО2 и NH+4, катализируемый у эукариот карбамоилфосфатсинтетазой II.
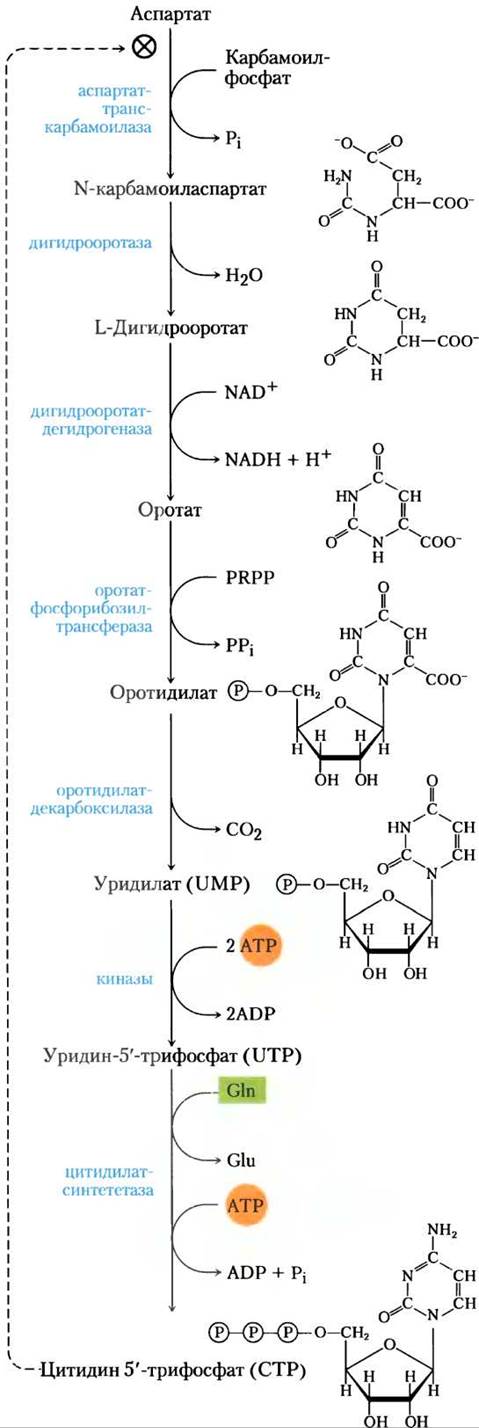
В первой реакции, принадлежащей пути биосинтеза пиримидинов, карбамоилфосфат взаимодействует с аспартатом с образованием N-карбамоиласпартата (рис. 22-36). Эта реакция катализируется аспартаттранскарбамоилазой. У бактерий эта стадия жестко регулируется, а бактериальная аспартаттранскарбамоилаза — один из наиболее тщательно изученных аллостерических ферментов (см. ниже). При удалении воды c N-карбамоиласпартата, которое катализирует дигидрооротаза, пиримидиновое кольцо замыкается с образованием L-дигидрооротата. Это соединение окисляется до пиримидинового производного оротата в реакции, где NAD+служит конечным акцептором электронов. У эукариот первые три фермента этого пути карбамоил- фосфатсинтаза II, аспартаттранскарбамоилаза и дигидрооротаза являются частью одного трехфункционального белка СAD. Это белок содержит три идентичные полипептидные цепи (Мr каждого полипептида 230 000), каждая цепь несет активные центры для всех трех реакций. Отсюда следует, что для этого пути могут быть довольно обычны большие мультиферментные комплексы.
Рис. 22-37. Туннелирование интермедиатов в бактериальной карбамоилфосфатсинтетазе (по PDB 1D 1 M6V). Реакция, катализируемая этим ферментом, показана на рис. 18-11, а. Большая и малая субъединицы окрашены серым и голубым соответственно; канал между активными центрами (длиной почти 100 Â) изображен в виде желтой сети. Молекула глутамина (зеленая) связывается с малой субъединицей, в глутамин-амидотрансферазной реакции от нее отщепляется амидный азот в виде NH4+. NH4+ входит в канал, который ведет ко второму активному центру, где NH4+ соединяется с гидрокарбонатом в АТР-зависимой реакции (связанный ADP показан синим). Затем карбамат опять попадает в канал, чтобы достигнуть третьего активного центра, где он фосфорилируется с образованием карбамоилфосфата (связанный ADP показан красным).
После образования оротата к нему присоединяется боковая цепь рибозо-5-фосфата, которую опять предоставляет РRРР (рис. 22-36). Получаемый при этом оротидилат затем декарбоксилиру- ется до уридилата, который фосфорилируется до UTP. СТР образуется из UTP под действием цитидилатсинтетазы через ацилфосфатный интермедиат (с потреблением одной молекулы АТР). Донором азота обычно служит глутамин, хотя во многих случаях цитидилатсинтетазы могут использовать непосредственно NH4+.
Биосинтез пиримидиновых нуклеотидов регулируется по механизму отрицательной обратной связи
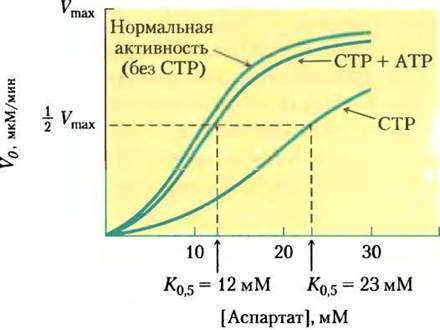
Регуляция скорости синтеза пиримидиновых нуклеотидов у бактерий происходит главным образом через аспартаттранскарбамоилазу, которая катализирует первую реакцию пути и ингибируется СТР, конечным продуктом этой цепочки реакций (рис. 22-36). Молекула бактериальной аспартаттранскарбамоилазы состоит из шести каталитических субъединиц (см. рис. 6-32, т. 1). Каталитические субъединицы связывают молекулы субстратов, а аллостерические субъединицы связывают аллостерический ингибитор СТР. Молекула аспартаттранскарбамоилазы, как и ее субъединицы, существует в двух различных конформациях — активной и неактивной. Когда СТР не связан с регуляторными субъединицами, фермент максимально активен. По мере накопления СТР он связывается с регуляторными субъединицами и меняет их конформацию. Это изменение передается на каталитические субъединицы, которые затем также принимают неактивную конформацию. АТР предотвращает эти изменения, вызванные СТР. На рис. 22-38 показано влияние аллостерических регуляторов на активность аспартаттранскарбамоилазы.
Рис. 22-38. Аллостерическая регуляция аспартаттранскарбамоилазы с помощью СТР и АТР. Добавление 0,8 мМ СТР, аллостерического ингибиторааспартаттранскарбамоилазы, увеличивает К0,5 для аспартата (нижняя кривая) и скорость превращения аспартата в N-карбамоиласпартат. Введение 0,6 мМ АТР практически полностью снимает этот эффект (средняя кривая).
Нуклеозидмонофосфаты превращаются в нуклеозидтрифосфаты
В биосинтезе нуклеотиды обычно превращаются в нуклеозидтрифосфаты по путям, одинаковым для всех клеток. Фосфорилирование АМР до ADP осуществляется аденилаткиназой по реакции
ATP + АМР ⇄ 2ADP
Образованный ADP фосфорилируется до АТР гликолитическими ферментами в процессе окислительного фосфорилирования.
АТР также участвует в образовании других нуклеозиддифосфатов под действием ферментов нуклеозидмонофосфаткиназ. Этот класс ферментов специфичен в основном в отношении конкретного основания, но не специфичен по сахарам (рибоза или дезоксирибоза) и катализируют реакцию:
АТР + NMP ⇄ ADP + NDP
Эффективные системы рефосфорилирования ADP до АТР в клетке сдвигают равновесие этой реакции в сторону образования продуктов.
Нуклеозиддифосфаты превращаются в трифосфаты под действием распространенного фермента нуклеозиддифосфаткиназы, которая катализирует реакцию
NTPD + NDPA ⇄ NDPD + NTPA
Этот фермент необычен тем, что он неспецифичен ни по основанию (пурин или пиримидин), ни по сахару (рибоза или дезоксирибоза). Такое отсутствие специфичности относится и к акцептору фосфата (А) и к его донору (D), хотя донором (NTPD) обычно постоянно оказывается АТР, так как в аэробных условиях его в клетке в намного больше, чем других нуклеозидтрифосфатов.
Рибонуклеотиды служат предшественниками дезоксирибонуклеотидов
Дезоксирибонуклеотиды, строительные блоки ДНК, образуются из соответствующих рибонуклеотидов непосредственным восстановлением 2'-углеродного атома D-рибозы с образованием 2'-дезоксипроизводного. Например, аденозиндифосфат (ADP) восстанавливается до 2'- дезоксиаденозиндифосфата (dADP), а GDP — до dGDP. Эта реакция в некотором смысле необычна, так как перед восстановлением атом углерода не активируется; другие аналогичные реакции пока неизвестны. Реакция катализируется рибонуклеотидредуктазой, наиболее охарактеризованной для Е. coli, ее субстраты — рибонуклеозиддифосфаты.
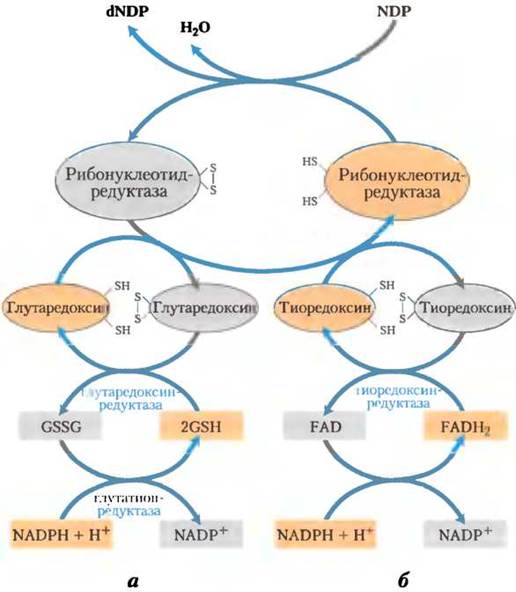
Восстановление некоторых остатков D-рибозы в рибонуклеозиддифосфате до 2'-дезокси- D-рибозы происходит с участием двух атомов водорода, которые поставляет NADPH через промежуточный водород-переносящий белок тиоредоксин. Этот распространенный белок выполняет похожую функцию в реакциях окисления-восстановления при фотосинтезе (см. рис. 20-19) и других процессах. Тиоредоксин содержит парные группы -SН, которые переносят атомы водорода от NАDРН на рибонуклеозиддифосфат. Его окисленная (дисульфидная) форма восстанавливается с помощью NАDРH в реакции, катализируемой тиоредоксинредуктазой (рис. 22-39), а затем используется рибонуклеотидредуктазой для восстановления нуклеозиддифосфатов (NDР) до дезоксирибонуклеозиддифосфатов (dNDР). Другой источник восстанавливающих эквивалентов для рибонуклеозидредуктазы — это глутатион (GSН). Глутатион служит восстановителем родственного тиоредоксину белка глутаредоксина, который передает восстановительный потенциал далее на рибонуклетидредуктазу (рис. 22-39).
Рис. 22-39. Восстановление рибонуклеотидов до дезоксирибонуклеотидов рибонуклеотидредуктазой. Электроны передаются (синие стрелки) к ферменту от NADPH через (а) глутаредоксин или (б) тиоредоксин. Сульфидные группы глутаредоксинредуктазы принадлежат связанному глутатиону (GSH; GSSG — окисленный глутатион). Обратите внимание, что тиоредоксинредуктаза — это флавофермент, в котором простетической группой служит FAD.
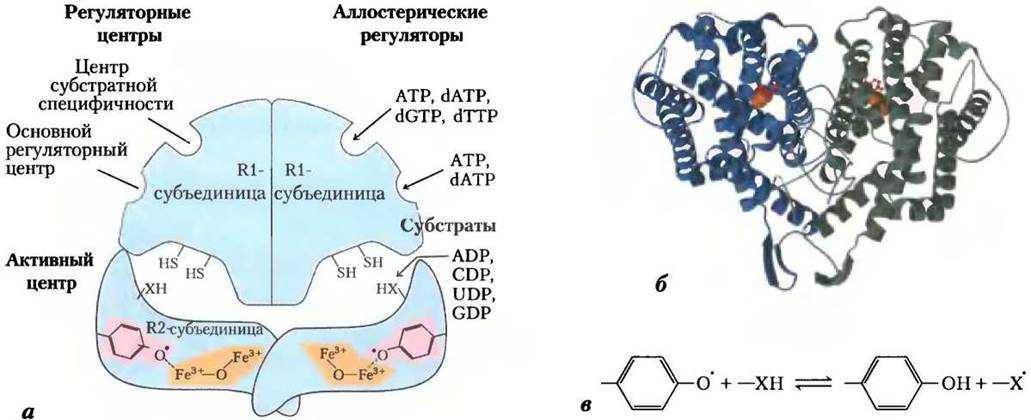
Рибонуклеотидредуктаза примечательна тем, что механизм катализа с ее участием подробно описан как пример свободнорадикальной реакции в биохимических процессах, что когда-то считалось довольно редким событием в живых системах. Этот фермент у Е. соli и большинства эукариот представляет собой димер, его субъединицы называются R1 и R2 (рис. 22-40). R1-субъединица содержит два типа регуляторных центров, как будет описано ниже. Два активных центра фермента образуются при взаимодействии R1- и R2-субъединиц. В каждом активном центре две сульфгидрильные группы, необходимые для активности фермента, принадлежат R1-субъединице, а стабильный радикал тирозина — R2-субъединице. R2-Субъединица также содержит кофактор с двумя ионами железа Fе3+, которые помогают генерировать и стабилизировать радикалы тирозина (рис. 22-40). Радикал тирозина находится слишком далеко от активного центра, чтобы непосредственно с ним взаимодействовать. Но он вызывает в активном центре образование другого радикала, который и функционирует при катализе. Наиболее вероятный механизм рибонуклеотидредуктазной реакции показан на рис. 22-41. У Е. соli наиболее вероятные источники необходимых восстановительных эквивалентов для этой реакции — это тиоредоксин и глутаредоксин (см. далее).
Рис. 22-40. Рибонуклеотидредуктаза. а — строение субъединиц. Работа двух регуляторных центров показана на рис. 22-42. Каждый активный центр содержит две тиоловых группы и одну группу -ХН, которая может быть преобразована в радикал; это, вероятнее всего, -SH-группа Cys439, который функционирует как тиоловый радикал. б — R2-субъединица рибонуклеотидредуктазы E. coli (PDB lD l PFR). Остаток тирозина, который работает как тирозиновый радикал, показан красным; двухъядерный железный центр — оранжевым. в — функция тирозинового радикала — образовывать в активном центре радикал -X•, необходимый в реакции, механизм которой изображен на рис. 22-41.
Обнаружено три класса рибонуклеотидредуктаз. Механизмы реакций (известные) в основном соответствуют схеме, приведенной на рис. 22-41, различия наблюдаются в природе радикала в активном центре и в природе кофактора, необходимого для его образования. Ферменту Е. соli (класс I) для «восстановления» «погашенного» радикала тирозина необходим кислород, поэтому этот фермент работает только в аэробных условиях. Ферменты класса II, найденные у других микроорганизмов, содержат 5'-дезоксиаденозилкобаламин (см. доп. 17-2) вместо двухъядерного железного центра. Ферменты класса III приспособились функционировать в анаэробных условиях. Если Е. coli растет анаэробно, она содержит независимый фермент класса III; этот фермент несет железосерный кластер (его структура отличается от двухъядерного железного центра ферментов класса I) и использует в работе NADPH и S-аденозилметионин. В качестве субстрата он предпочитает нуклеозидтрифосфаты, а не нуклеозиддифосфаты. Появление рибонуклеотидредуктаз различных классов, необходимых для образования предшественников ДНК в различных условиях окружающей среды, свидетельствует о важности этой реакции в метаболизме нуклеотидов.
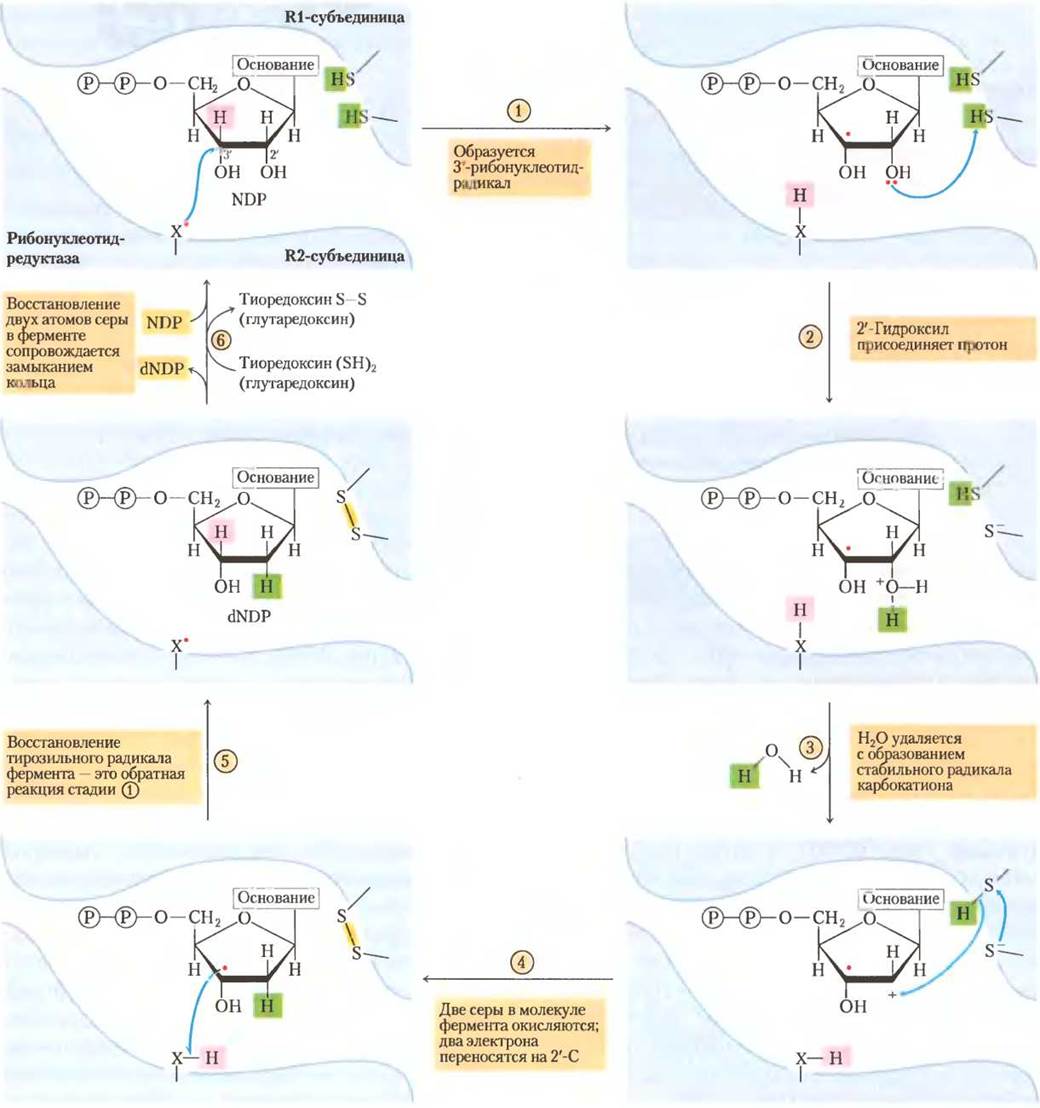
Рис. 22-41. Механизм реакции. Предполагаемый механизм катализа рибонуклеотидредуктазой. У Е. coli и большинства эукариот активные тиоловые группы этого фермента находятся на R1-субъединице, радикал активного центра -X• — на R2-субъединице, у Е. coli, возможно, это сульфгидрильный радикал Cys439(см. рис. 22-40).
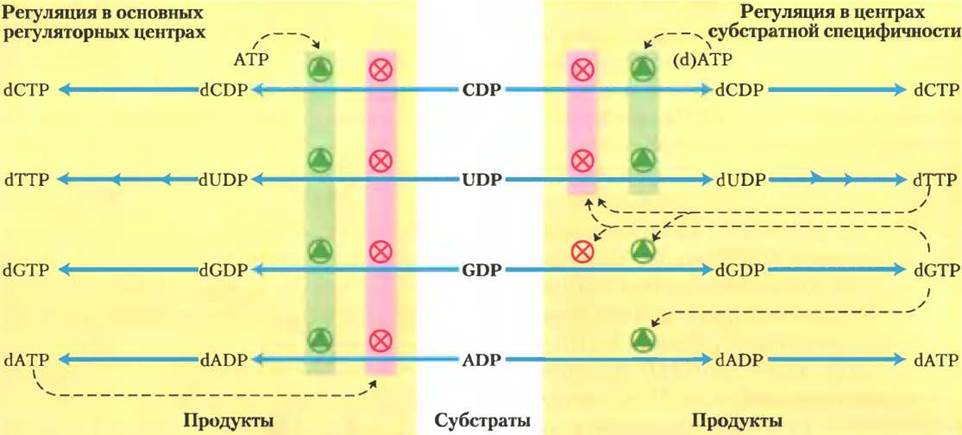
Регуляция рибонуклеотидредуктазы Е. coli несколько необычна: при связывании эффекторных молекул регулируется не только ее активность, но и ее субстратная специфичность. Каждая R1-субъединица имеет регуляторные центры двух типов (рис. 22-40). Один центр влияет на активность всего ферментативного комплекса и связывает либо АТР, который активирует фермент, либо dATP, который инактивирует его. Второй центр изменяет субстратную специфичность в ответ на молекулу-модулятор (ATP, dATP, dTTP или dGTP), которая с ним связывается (рис. 22-42). Когда с ним связаны АТР или dATP, более предпочтительно восстановление UDP и CDP. Когда связаны dTTP или dGTP, стимулируется восстановление GDP или ADP. Такая регуляция обеспечивает баланс между пулами предшественников для синтеза ДНК. АТР также выступает главным активатором биосинтеза и восстановления рибонуклеотидов. Присутствие dATP в небольших количествах увеличивает восстановление пиримидиновых нуклеотидов. Избыточное образование пиримидиновых dNTP приводит к высокому уровню dTTP, который изменяет специфичность реакции восстановления по субстрату — более предпочтителен GDP. В свою очередь высокие концентрации dGDP влияют на равновесие реакции, сдвигая его в сторону восстановления ADP, а большие концентрации dATPвообще «выключают» фермент. Считается, что эти эффекторы индуцируют несколько различных конформационных сдвигов, которые и вызывают изменение специфичности.
Рис. 22-42. Регуляция рибонуклеотидредуктазы дезоксинуклеозидтрифосфатами. Суммарная ферментативная активность регулируется путем связывания модуляторов с основным регуляторным центром (слева). Субстратная специфичность фермента регулируется природой эффекторной молекулы, связанной с регуляторным центром второго типа (справа). Показано ингибирование или активирование ферментативной активности четырьмя различными субстратами. Путь от dUDР до dТТР описан позднее (см. рис. 22-43,22-44).
Тимидилат образуется из dCDP и dUMP
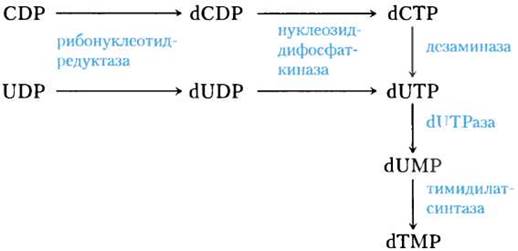
ДНК содержит тимин вместо урацила, и в пути синтеза тимина de novo участвуют только дезок- сирибонуклеотиды. Непосредственным предшественником тимидилата (dTMP) служит dUMP. У бактерий путь, ведущий к dUMP, начинается с образования dUTP, который получается либо при дезаминировании dCTP, либо при фосфорилировании dUDP (рис. 22-43). dUTP превращается в dUMP под действием dUTPазы. Последняя реакция должна быть эффективной, чтобы поддерживать пул dUTP на низком уровне и таким образом предотвращать включение уридилата в ДНК.
Рис. 22-43. Биосинтез тимидилата (dTМР). Показаны пути, начинающиеся с реакции, катализируемой рибонуклеотидредуктазой. На рис. 22-44 подробно изображена реакция тимидилатсинтазы.
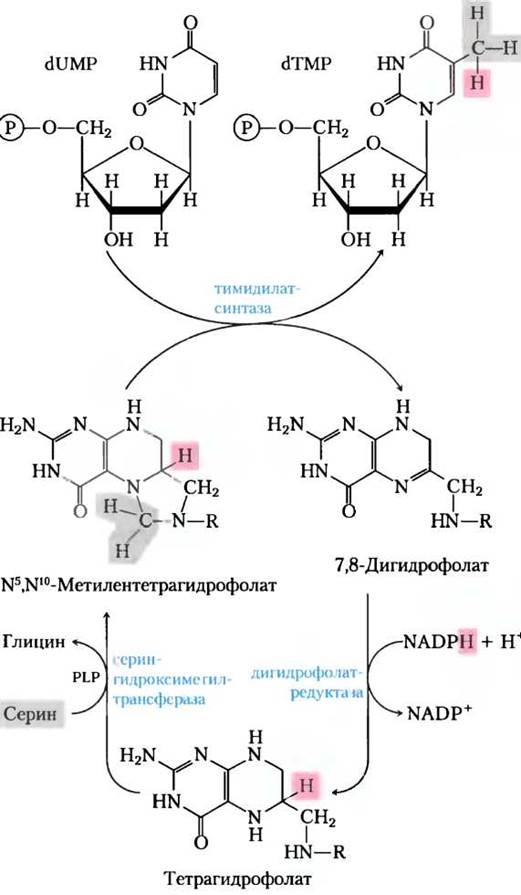
Превращение dUMP в dTMP катализируется тимидилатсинтазой. От N5, N10-метилен- тетрагидрофолата на dUMP переносится углеродая единица со степенью окисления углерода, как в гидроксиметильной группе -СН2ОН, (см. рис. 18-17), а затем восстанавливается до метальной группы (рис. 22-44). Это восстановление «оплачивается» окислением тетрагидрофолата до дигидрофолата, что довольно необычно для тетрагидрофолат-зависимых реакций. (Механизм этой реакции показан на рис. 22-50.) Дигидрофолат восстанавливается до тетрагидрофолата дигидрофолатредуктазой в реакции регенерации, которая почти обязательно присутствует во многих процессах с участием тетрагидрофолата. У растений и по крайней мере у одного простейшего тимидилатсинтаза и дигирофолатредуктаза образуют один бифункциональный белок.
Рис. 22-44. Превращение dUМР в dТМР под действием тимидилатсинтазы и дигидрофолатредуктазы. Для получения метиленовой формы N5, N10-тетрагидрофолата необходима серингидроксиметилтрансфераза. При синтезе (1ТМР три атома водорода метильной группы поступают с N5, N10-метилентетрагидрофолата (розовый и серый).
Около 10% всей человеческой популяции (в том числе почти у 50% бедного населения) страдают от недостатка в организме фолиевой кислоты. При значительном дефиците фолиевой кислоты могут возникать сердечно-сосудистые заболевания, злокачественные новообразования, а также те или иные нарушения мозговой деятель ности. Ряд этих симптомов связан с ослаблением синтеза тимидилата, в результате чего в ДНК начинает встраиваться урацил. Урацил в ДНК распознается и удаляется системой репарации (см. гл. 25, т. 3). При высоком содержании урацила в ДНК появляются разрывы, что нарушает нормальную работу и регуляцию ядерной ДНК и в итоге приводит к нарушениям в работе сердца и головного мозга, а также способствует возникновению рака. ■
При распаде пуринов и пиримидинов образуются мочевая кислота и мочевина
Пуриновые нуклеотиды разрушаются по пути, в котором они теряют свои фосфаты под действием 5'-нуклеотидазы (рис. 22-45). Аденилат превращается в аденозин, который дезаминируется с образованием инозина под действием аденозиндезаминазы, а инозин гидролизиуется до гипоксантина (своего пуринового основания) и D-рибозы. Гипоксантин последовательно окисляется до ксантина, а затем до мочевой кислоты под действием ксантиноксидазы, флавосодержащего фермента с атомом молибдена и четырьмя железосерными центрами в качестве простетических групп. Акцептором электронов в этой сложной реакции служит молекулярный кислород.
Катаболизм GМР также идти с образованием мочевой кислоты в качестве конечного продукта. GМР сначала гидролизуется до гуанозина, который потом расщепляется с образованием свободного гуанина. От гуанина гидролитически удаляется аминогруппа с образованием ксантина, который затем превращается в мочевую кислоту при действии ксантиноксидазы (рис. 22-45).
Рис. 22-45. Катаболизм пуриновых нуклеотидов. Обратите внимание на то, что у приматов основное количество азота выводится в цикле мочевины в виде мочевины (гл. 18), а не в виде мочевой кислоты, образующейся при распаде нуклеотидов. У рыб же азот выводится главным образом как NH+4, а не как мочевина, образование которой показано здесь.
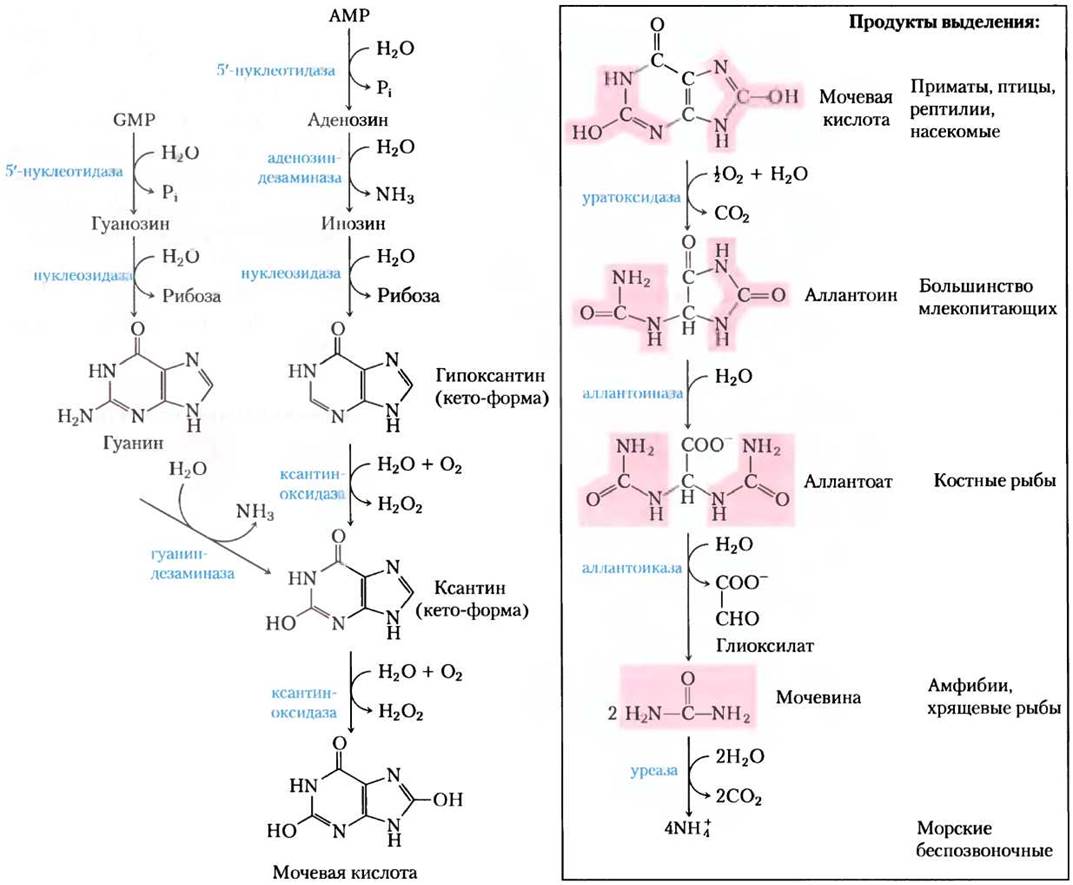
Мочевая кислота — конечный экскретируемый продукт пуринового катаболизма приматов, птиц и некоторых других животных. У здорового взрослого человека мочевая кислота выделяется со скоростью около 0,6 г/сут; часть выделяемого организмом продукта образуется из всасываемых в желудке пуринов, а часть — из пуриновых оснований нуклеиновых кислот. У большинства млекопитающих и других позвоночных мочевая кислота в дальнейшем разрушается до аллантоина под действием уратоксидазы. У других организмов этот путь продолжается дальше, как показано на рис. 22-45.
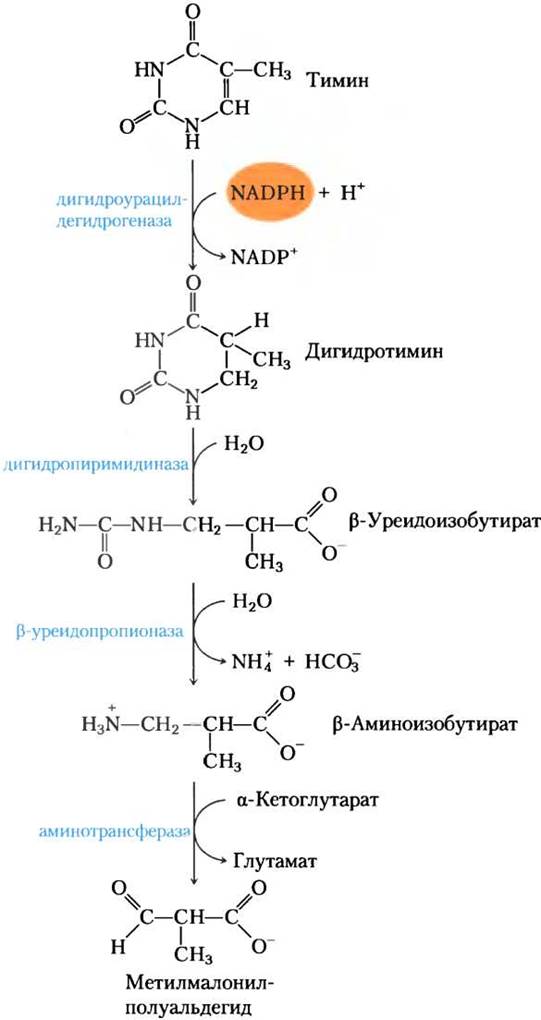
Пути распада пиримидинов главным образом ведут к NH4+, а значит, к мочевине. Тимин, например, деградирует до метилмалонилполуальдегида (рис. 22-46), интермедиата катаболизма валина. Дальше он распадается через пропионил- СоА и метилмалонил-СоА до сукцинил-СоА (см. рис. 18-27).
Рис. 22-46. Катаболизм пиримидина. Показаны пути деградации тимина. Метилмалонилполуальдегид затем разрушается до сукцинил-СоА.
У человека в метаболизме пуринов были найдены генетические отклонения, некоторые с серьезными последствиями. Например, дефицит аденозиндезаминазы (ADA) ведет к серьезной форме иммунодефицита, в которой Т-лимфоциты и В-лимфоциты развиваются не до конца. Отсутствие ADA ведет к увеличению концентрации dATP в 100 раз, что сильно ингибирует рибонуклеотид- редуктазу (рис. 22-42). Высокий уровень образования dATP приводит главным образом к недостатку других dNTP в Т-лимфоцитах. Причины поражения В-лимфоцитов менее понятны. При дефиците ADA иммунная система человека неэффективна, и люди способны выжить только в строго стерильных условиях. Дефицит ADA — одна из первых генетических болезней, в отношении которой были проведены испытания генной терапии на человеке (см. доп. 9-2, т. 1). ■
Пуриновые и пиримидиновые основания повторно используются в путях реутилизации
Свободные пуриновые и пиримидиновые основания постоянно высвобождаются в клетке в процессе катаболизма нуклеотидов. Основные количества свободных пуринов остаются и повторно используются для синтеза нуклеотидов в пути, намного более простом, чем ранее описанный синтез пуриновых нуклеотидов de novo. Один из самых простых путей реутилизации нуклеотидов состоит из одной- единственной реакции, катализируемой аденозинфосфорибозилтрансферазой, в которой свободный аденин взаимодействует с PRPP с образованием соответствующего аденинового нуклеотида:
Аденин + PRPP —> АМР + PPi
Свободный гуанин и гипоксантин (продукт дезаминирования аденина; рис. 22-45) реутилизируются в похожем пути под действием гипоксантин-гуанин-фосфорибозилтрансферазы. Аналогичный путь «спасения» существует и для пиримидиновых оснований у микроорганизмов, и, возможно, у млекопитающих.
Генетические дефекты в гипоксантин-гуанин-фосфорибозилтрансферазе, наблюдаемые практически исключительно у мальчиков, вызывают причудливый набор симптомов, называемых синдромом Лёша-Нихена. Дети с этим генетическим расстройством, которое становится очевидным в возрасте двух лет, иногда довольно плохо ориентируются в пространстве и умственно недоразвиты. Вдобавок они чрезвычайно враждебны и показывают маниакальную настроенность на саморазрушение: они калечат себя, откусывая пальцы рук, ног и губы. Попытки лечить этот синдром предпринимались еще на ранних этапах развития генной терапии (см. доп. 9-2). ■
Избыток мочевой кислоты вызывает подагру
Долго бытовало заблуждение, что подагра бывает только у аристократов. Подагра — это болезнь суставов, вызванная повышенным содержанием мочевой кислоты в крови и тканях. При воспалении суставов человек испытывает сильную боль, а из-за отложения кристаллов урата натрия могут проявляться симптомы артрита.
Повреждаются также почки, ведь избыток мочевой кислоты накапливается и в почечных канальцах. Обычно подагра развивается у мужчин. Причины болезни до конца неизвестны, но она часто сопровождается недостаточным выделением уратов. В некоторых случаях причиной может быть также генетическое нарушение в том или ином ферменте пуринового метаболизма.
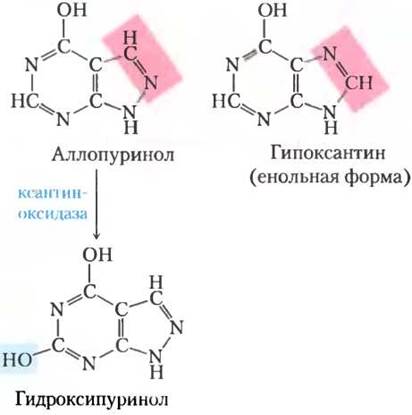
Для эффективного лечения подагры назначают соблюдение определенной диеты в комбинации с лекарственной терапией. Пища, особенно богатая нуклеотидами и нуклеиновыми кислотами, такая как печень или железы, должна быть исключена из рациона. Облегчение симптомов достигается при приеме лекарства аллопуринола (рис. 22-47), которое ингибирует ксантиноксидазу — фермент, катализирующий превращение пуринов в мочевую кислоту. Аллопуринол — субстрат ксантиноксидазы, под действием которой он превращается в гидроксипуринол (аллоксантин). Гидроксипуринол инактивирует восстановленную форму фермента, оставаясь прочно связанным с его активным центром. При ингибировании ксантиноксидазы выделяются продукты пуринового метаболизма: ксантин и гипоксантин, которые более растворимы, чем мочевая кислота и менее склонны к образованию кристаллических отложений. Аллопуринол был предложен Гертрудой Элайон и Джорджем Хитчингсом, которые также разработали ацикловир, используемый при лечении людей, больных СПИДом, и другие пуриновые аналоги, применяемые для химиотерапии рака. ■
Гертруда Элайон (1918-1999) и Джордж Хитчингс (1905-1998)

Рис. 22-47. Аллопуринол, ингибитор ксантиноксидазы. Гипоксантин — природный субстрат ксантиноксидазы. Всего лишь небольшие изменения в гипоксантине (выделено розовым) приводят к эффективному ингибитору этого фермента — аллопуринолу. В активном центре ксантиноксидазы аллопуринол превращается в гидроксипуринол, сильный конкурентный ингибитор, который остается прочно связанным с восстановленной формой фермента.
Большинство ферментов, служащих мишенями химиотерапевтических препаратов, относятся к пути биосинтеза нуклеотидов
Рост раковых клеток контролируется не так, как рост клеток в большинстве нормальных тканей. Раковые клетки нуждаются в больших количествах нуклеотидов как предшественников ДНК и РНК, и поэтому более чувствительны к ингибиторам биосинтеза нуклеотидов, чем нормальные клетки. Список важных химиотерапевтических препаратов, используемых при лечении рака и других болезней, и действующих как ингибиторы одного или более ферментов этих путей все расширяется. Мы опишем здесь несколько хорошо изученных примеров, которые иллюстрируют эффективные подходы при лечении, а также помогают нам понять, как работают эти ферменты.
Первый набор лекарств включает соединения, которые ингибируют глутаминамидотрансферазы. Вспомните, что глутамин служит донором азота по крайней мере в полудюжине разных реакций при биосинтезе нуклеотидов. Связывающий центр глутамина и механизм, по которому выделяется NН4+ в таких реакциях, довольно похожи для многих этих ферментов. Большинство ферментов эффективно ингибируется аналогами глутамина, такими как азасерин и ацивин (рис. 22-48). Азасерин, охарактеризованный Джоном Бьюкененом в 1950-х гг., был одним из первых примеров инактиваторов ферментов, разработанных на основе механизма реакции (суицидный ингибитор, с. 298, т. 1 и доп. 22-3). Большие надежды связаны также с ацивином как химиотерапевтическим препаратом.
Рис. 22-48. Азасерин и ацивицин — ингибиторы глутаминамидотрансфераз. Эти аналоги глутамина вмешиваются в ряд биосинтетических путей с участием аминокислот и нуклеотидов.
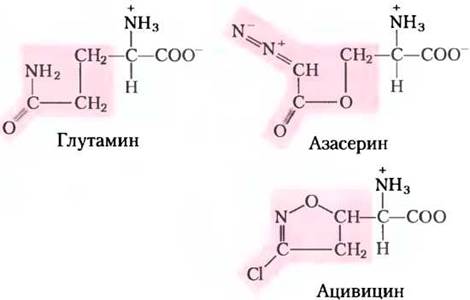
Другими полезными целями для фармацевтических препаратов могут быть тимидилатсинтаза и дигидрофолатредуктаза — ферменты, которые работают только в клеточном пути синтеза тимина (рис. 22-49). Ингибирующий эффект на тимидилатсинтазу оказывает только фторурацил (флуороурацил); это важный химиотерапевтический препарат. Сам по себе фторурацил не ингибирует фермент. На пути реутилизации в клетке он превращается в дезоксинуклеозидмонофосфат FdUМР, который связывается с ферментом и ингибирует его. Ингибирование под действием FdUМР (рис. 22-50) — классический пример инактивации фермента, основанной на механизме ферментативной реакции. Другой очень действенный химиотерапевтический агент метотрексат ингибирует дигидрофолатредуктазу. Этот аналог фолата активно действует как конкурентный ингибитор; сродство фермента дигидрофолатредуктазы к метотрексату выше, чем к дигидрофолату, примерно в 100 раз. Аминоптерин — родственное соединение, которое действует похожим образом.
Рис. 22-49. Синтез тимидилата и метаболизм фолата как мишени химиотерапии, а — в процессе синтеза тимидилата N5, N10-метилентетрагидрофолат превращается в 7,8-дигидрофолат; затем в две стадии происходит регенерация N5, N10-метилентетрагидрофолата (см. рис. 22-44). Этот цикл и является главной мишенью некоторых лекарственных препаратов. б — фторурацил и метотрексат — это важные химиотерапевтические препараты. В клетках фторурацил (флуороурацил) превращается в FdUМР, который ингибирует тимидилатсинтазу. Метотрексат, структурный аналог тетрагидрофолата, ингибирует дигидрофолатредуктазу; выделенные цветом метильная и аминогруппы замещают в фолате карбонильный кислород и водород соответственно (см. рис. 22-44). Другой важный аналог фолата аминоптерин идентичен метотрексату, только у него отсутствует метильная группа (она выделена). Триметоприм — ингибитор, прочно связывающийся с бактериальной дигидрофолатредуктазой; разрабатывался как антибиотик.
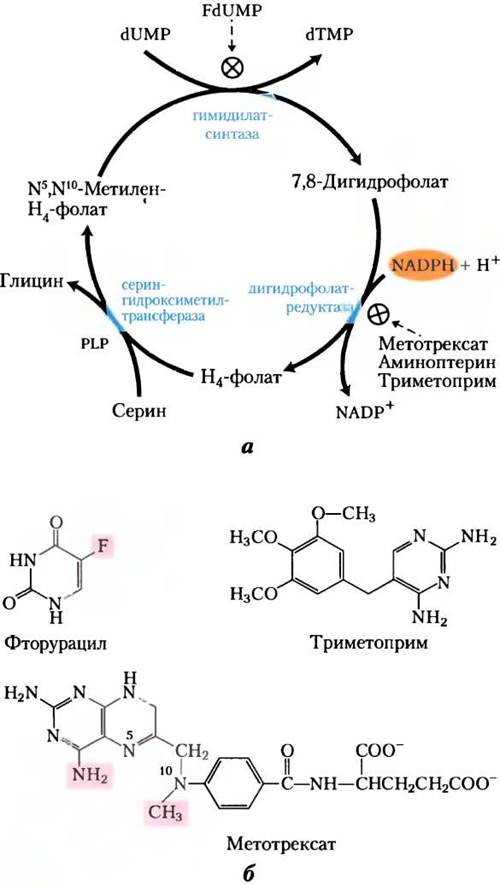
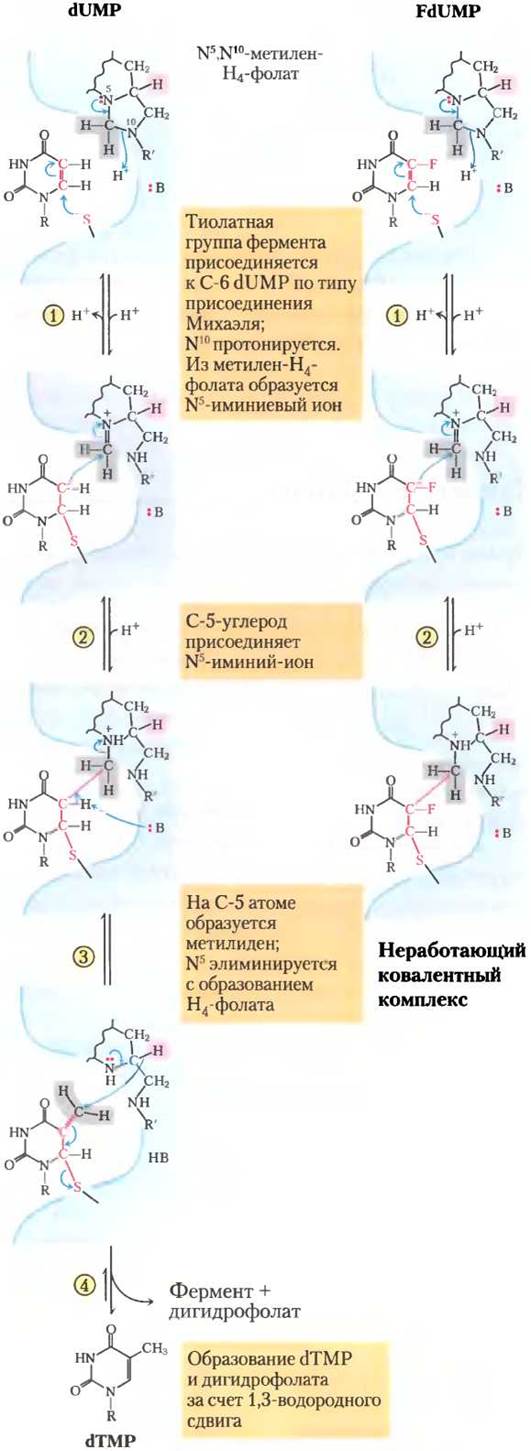
Рис. 22-50. Механизм реакции. Превращение dUМР в dТМР и его ингибирование FdUМР. Слева — обычный механизм реакции тимидилатсинтазы. Нуклеофильная сульфгидрильная группа фермента используется в реакции на стадии (1). Атомы кольца dUМР, принимающие участие в реакции, показаны красным; В означает боковую группу аминокислоты, которая выступает в качестве основания, необходимого для оттягивания протона на стадии (3). Атомы водорода, взятые с метиленовой группы N5, N10-метилентетрагидрофолата выделены серым цветом. Необычной особенностью механизма этой реакции является 1,3-водородный сдвиг (стадия (3)) — смещение иона водорода (выделен розовым) с С-6 атома Н4-фолата к метильной группе тимидина, в результате чего тетрагидрофолат окисляется до дигидрофолата. Именно этот этап реакции (водородный сдвиг) ингибируется, когда в качестве субстрата используется FdUМР (см. ниже). Стадии (1) и (2) протекают нормально, но в результате образуется стабильный комплекс, в котором FdUМР ковалентно связан с ферментом и тетрагидрофолатом, что инактивирует фермент. Механизм работы тимидилатсинтазы
Значение ингибиторов биосинтеза нуклеотидов в медицине не ограничивается лечением рака. Их потенциальными мишенями являются все быстрорастущие клетки (включая бактерий и простейших). Триметоприм, антибиотик, разработанный Хитчингсом и Элайон, связывается с бактериальной дигидрофолатредуктазой примерно в 100 000 раз лучше, чем с ферментом млекопитающих. Он используется для лечения определенных бактериальных инфекций мочеполовых путей и среднего уха. У паразитических простейших, таких как трипаносомы, которые вызывают африканскую сонную болезнь (африканский трипаносомоз), нет способов биосинтеза нуклеотидов de novo, и эти паразиты чрезвычайно чувствительны к агентам, которые препятствуют повторному использованию нуклеотидов из окружающей среды. Аллопуринол (рис. 22-47) и ряд схожих пуриновых аналогов показывают хорошие результаты при лечении африканского трипаносомоза, и это дает возможность еще глубже понять метаболизм и работу ферментов. ■
Краткое содержание раздела 22.4 Биосинтез и деградация нуклеотидов
■ Система пуринового кольца строится постадийно, начиная с 5-фосфорибозиламина. Все атомы азота пуринам поставляют аминокислоты глутамин, глицин и аспартат. Две финальные стадии замыкания цикла приводят к образованию пуринового ядра.
■ Пиримидины синтезируются из карбамоил- фосфата и аспартата, а затем к ним присоединяется рибозо-5-фосфат с образованием пиримидиновых рибонуклеотидов.
■ Нуклеозидмонофосфаты превращаются в соответствующие трифосфаты в реакциях ферментативного фосфорилирования. Из рибонуклеотидов под действием рибонуклеотидредуктазы образуются дезоксирибо- нуклеотиды; этот фермент проявляет себя очень необычно в катализе и регуляции. Тиминовые нуклеотиды образуются из dCDP и dUMP.
■ Конечные продукты распада пуринов и пиримидинов — мочевая кислота и мочевина.
■ Свободные пурины могут снова включаться в нуклеотиды. Генетические дефекты определенных ферментов пути утилизации вызывают серьезные болезни, такие как синдром Лёша-Нихена и дефицит ADA.
■ Накопление кристаллов мочевой кислоты в суставах, возможно, связанное с другим генетическим дефектом, вызывает подагру.
■ Ферменты пути биосинтеза нуклеотидов служат мишенями ряда химиотерапевтических препаратов, используемых при лечении рака и других заболеваний.