ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
Мы считаем, что любая ткань и, что более существенно, любая клетка организма секретирует... в кровь специфические вещества, или ферменты, которые влияют на все другие клетки, объединяя их с помощью иного, чем нервная система, механизма.
Шарль Эдуард Броун-Секар и Ж. д'Арсонвалъ, статья в Comptes Rendus de la Société de Biologie, 1891
23. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ И ИНТЕГРАЦИЯ МЕТАБОЛИЗМА МЛЕКОПИТАЮЩИ
В главах 13-22 мы обсудили метаболизм на уровне отдельной клетки, причем особое внимание уделялось основным путям, общим почти для всех клеток, как прокариотических, так и для эукариотических. Мы теперь увидели, каким образом метаболические процессы регулируются внутри клетки на уровне отдельных ферментативных реакций путем изменения доступности субстрата, с помощью аллостерических механизмов, а также путем фосфорилирования или других ковалентных модификаций ферментов.
Для полного понимания роли отдельных метаболических путей и способов их регуляции рассмотрим проблему на уровне всего организма. Самыми существенными особенностями многоклеточных организмов являются дифференцировка клеток и разделение функций. Специализация тканей и органов в таком сложном организме, как организм человека, предполагает наличие определенных метаболических путей и особые требования к источникам энергии. Метаболическая активность различных тканей координируется и интегрируется с помощью гормональных сигналов. Они оптимизируют распределение энергетически богатых веществ и предшественников для каждого органа.
В этой главе мы рассмотрим обмен веществ у млекопитающих, обращая особое внимание на специализированный метаболизм нескольких главных органов и тканей, а также на интеграцию каждого специализированного метаболизма в метаболизм всего организма. Начнем с описания широкого круга гормонов и гормональных механизмов, затем обратимся к тканеспецифическим функциям, которые регулируются этими механизмами. Обсудим распределение биологически активных веществ в различных органах, подчеркивая центральную роль печени, и метаболическую кооперацию органов. Для иллюстрации объединяющей роли гормонов опишем взаимодействие инсулина, глюкагона и адреналина при координации энергетического метаболизма в мышцах, печени и жировой ткани. Затем на примере метаболических нарушений при сахарном диабете покажем важность гормональной регуляции метаболизма.
Мы обсудим механизмы гормональной регуляции массы тела и влияние избыточной массы тела на развитие метаболического синдрома и диабета.
23.1. Гормоны: различные структуры для различных функций
В сущности, в сложном организме одним или несколькими гормонами регулируются все процессы: поддержание кровяного давления, изменения объема крови и баланса электролитов, эмбриогенез, половая дифференциация, развитие и репродукция, голод, пищевое поведение, переваривание и распределение энергетически обогащенных веществ и т. д. Рассмотрим методы определения и измерения концентрации гормонов, их взаимодействие с рецепторами и обсудим типы гормонов.
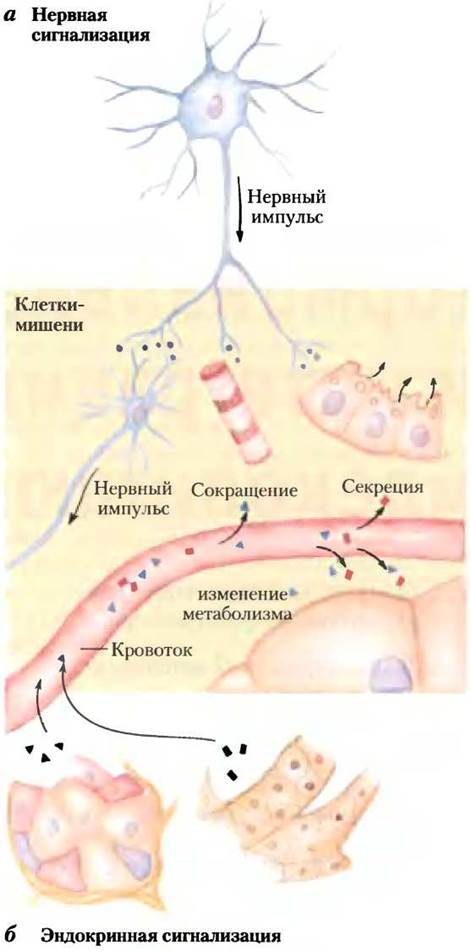
Координация метаболизма у млекопитающих осуществляется с помощью нейроэндокринной системы. Отдельные клетки в одной ткани чувствуют изменения условий для всего организма и отвечают на них секрецией химических посредников, которые проходят к другим клеткам в той же или в другой ткани, где они связываются с молекулой рецептора и запускают изменения в этой второй клетке. При передаче нервного импульса (рис. 23-1, а), химический посредник (нейромедиатор, например, ацетилхолин) может преодолеть расстояние только порядка микрометра, проходя через синаптическую щель к следующему нейрону. При гормональной сигнализации роль посредников выполняют гормоны, приносимые кровотоком к соседним клеткам или к удаленным органам и тканям. Чтобы достигнуть своей клетки-мишени, гормоны могут перемещаться на расстояние 1 м или более (рис. 23-1, б). За исключением этого различия, два химических сигнальных механизма, нейрональный и гормональный, очень похожи. Адреналин и норадреналин, например, играют роль нейромедиаторов в синапсах мозга и в гладкой мускулатуре и роль гормонов, регулирующих энергетический метаболизм в печени и в мышцах. Опираясь на обсуждение энергетического метаболизма в предыдущих главах, опишем клеточную сигнализацию, уделяя особое внимание действию гормонов. Отметим, что большинство рассмотренных фундаментальных сигнальных механизмов характерны и для действия нейромедиаторов.
Рис. 23-1. Сигнализация с помощью нейроэндокринной системы, а — при передаче нервного импульса в теле нейрона возникают электрические сигналы, которые очень быстро проходят к вершине аксона, где высвобождаются нейромедиаторы, диффундирующие затем к клеткам- мишеням. Такими клетками-мишенями (другой нейрон, миоцит или секреторная клетка) могут быть только те клетки, которые удалены от места высвобождения нейромедиатора на расстояние не более нескольких микрометров. б — в эндокринной системе гормоны секретируются в кровоток, который может транспортировать их через все тело к тканям-мишеням, которые могут быть удалены от секретирующей клетки на расстояние метр или более. И нейромедиаторы, и гормоны взаимодействуют со специфическими рецепторами на поверхности или внутри своих клеток-мишеней, вызывая ответ.
Для обнаружения и очистки гормонов необходимы биологические исследования
Как были обнаружены и изолированы гормоны? Во-первых, было установлено, что физиологические процессы в одной ткани зависят от сигналов, которые приходят из другой ткани. Например, поджелудочная железа вырабатывает вещество, которое влияет на объем и состав мочи; это и был первый открытый гормон — инсулин, (см. доп. 23-1). После того как установлено физиологическое действие предполагаемого гормона, производят количественные исследования для установления биологической роли гормона. В случае инсулина исследование состояло в инъекциях экстрактов поджелудочной железы (грубого источника инсулина) экспериментальным животным, испытывающим дефицит инсулина, затем анализировали результирующие изменения концентраций глюкозы в крови и в моче. Чтобы выделить гормон, экстракты, содержащие предполагаемый гормон, фракционируют с помощью тех же биохимических методов, которые используются для выделения других биомолекул (тонкослойная хроматография и другие хроматографические методы, электрофорез), и затем исследуют каждую фракцию на гормональную активность. Как только вещество очищено, могут быть определены его состав и структура.
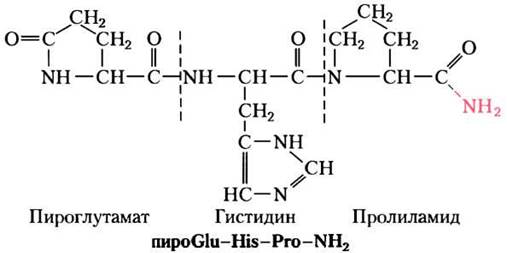
Такая методика исследования гормона только на первый взгляд кажется простой. Гормоны — чрезвычайно сильнодействующие вещества и поэтому вырабатываются в очень малых дозах. Получение достаточного количества гормона, дозволяющего охарактеризовать его химически, часто подразумевает биохимические работы в огромных масштабах. Так, когда Роже Гиймен и Эндрю Шалли независимо друг от друга очистили и охарактеризовали тиреотропин-высвобождающий гормон (ТRН) из гипоталамуса, группа Шалли переработала 20 т гипоталамуса примерно из 2 млн овец, а группа Гиймена приготовила экстракты из тканей примерно 1 млн свиней! Оказалось, что ТRH представляет собой производное трипептида Glu-Нis-Рго (рис. 23-2). Когда структура гормона была установлена, стало возможным химически синтезировать его в больших количествах для использования в физиологических и биохимических исследованиях.

Рис. 23-2. Структура тиреотропин-высвобождающего гормона (ТТГ или англ. TRH). Очищенный благодаря героическим усилиям тиреотропин-высвобождающий гормон из экстрактов гипоталамуса, как оказалось, является производным трипептида Glu-His-Pro. Карбоксильная группа боковой цепи N-концевого Glu образуется амид (связь выделена красным) с α-аминогруппой остатка, превращаясь в пироглутамат, а карбоксильная группа С-концевого Pro превращается в амид (красный -NH2). Такие модификации типичны для низкомолекулярных пептидных гормонов. В белке с Мr, ≈ 50 000 заряды на N- и С-концевых группах вносят относительно малый вклад в общий заряд белковой молекулы, но в трипептиде наличие этих двух заряженных групп определяют свойства пептида. Образование амидных производных нейтрализует эти заряды.
Нобелевская премия по физиологии и медицине в 1977 г. за работу на гормонах гипоталамуса была разделена между Шалли и Гийменом («За открытия, связанные с секрецией пептидных гормонов»), с одной стороны, а с другой — Розалин Ялоу («За развитие радиоиммунологических методов определения пептидных гормонов), которая (вместе с Соломоном А. Берсоном) предложила использовать очень чувствительный метод радиоиммунного анализа (РИА) для определения пептидных гормонов и разработала методику изучения действия гормонов. Метод РИА резко изменил весь процесс исследования гормонов, сделав возможным быстрое количественное и специфичное измерение гормонов в ультрамалых дозах.
Дополнение 23-1. МЕДИЦИНА. Как открывали гормоны. Тяжелый путь к чистому инсулину
Миллионы людей с сахарным диабетом I типа (инсулинзависимого) ежедневно делают себе инъекции чистого инсулина, чтобы компенсировать отсутствие выработки этого важнейшего гормона их собственными β-клетками поджелудочной железы. Инъекции инсулина не могут излечить сахарный диабет, но позволяют человеку, который иначе бы умер молодым, провести длинную и продуктивную жизнь. Открытие инсулина, начинавшееся со случайных наблюдений, показывает, как совсем неожиданно научно-техническое достижение было поддержано тщательно спланированным экспериментом. Именно благодаря такому стечению обстоятельств были открыты многие гормоны.
В 1889 г. Оскар Минковски, молодой ассистент Медицинского колледжа, и Йозеф фон Меринг из Института Хоппе-Зейлера в Страсбурге дружески поспорили о том, какую роль в процессе переваривания жира у собак играет поджелудочная железа, содержащая, как им было известно, липазы. Для решения своего спора исследователи начали опыты по изучению переваривания жира в организме. Они хирургически удалили поджелудочную железу у собаки, и Минковски заметил, что собака в этом случае вырабатывает намного больше мочи, чем нормальная (это общий симптом нелеченного диабета). Содержание глюкозы в моче собаки тоже намного превышало норму (это другой симптом диабета). Полученные данные указывали на то, что отсутствие некоторого продукта поджелудочной железы вызывает развитие диабета.
Минковски попытался исправить последствия удаления поджелудочной железы, снизить содержание глюкозы в моче или в крови, приготовив экстракт из поджелудочной железы собаки, но эти попытки были безуспешны... В настоящее время известно, что инсулин — белок и что поджелудочная железа очень богата
протеазами (трипсином и химотрипсином), которые в норме высвобождаются в тонкий кишечник для переваривания пищи. Именно эти протеазы и расщепляли инсулин в экстрактах поджелудочной железы в экспериментах Минковски.
Вопреки значительным усилиям ученых существенного прогресса в выделении и в определении «антидиабетического фактора» не было вплоть до лета 1921 г. В тот год за решение этой задачи взялись Фредерик Г. Бантинг, молодой ученый, работающий в лаборатории Дж. Дж. Р. Маклеода в Торонтском университете, и студент-ассистент Чарлз Бест. Через некоторое время было получено несколько независимых доказательств того, что поставщиком антидиабетического фактора, названного инсулином (от лат. insula — остров), служит группа специализированных клеток поджелудочной железы (островки Лангерганса; см. рис. 23-24).
В декабре 1921 г., предприняв все предосторожности для предотвращения протеолиза, Бантинг и Бест (позже к ним присоединился биохимик Дж. Б. Кол- лип) смогли приготовить очищенный экстракт поджелудочной железы, который снимал симптомы экспериментально вызванного диабета у собак. Уже месяц спустя 25 января 1922 г. их препарат инсулина ввели Леонарду Томсону, 14-летнему мальчику тяжело больному диабетом. Через несколько дней уровень кетоновых тел и глюкозы в моче Томсона значительно снизился; экстракт сохранил ему жизнь. В 1923 г. Бантинг и Маклеод получили Нобелевскую премию за выделение инсулина. Бантинг немедленно объявил, что он должен разделить эту награду с Бестом, Маклеод разделил ее с Коллипом.
К 1923 г. по всему миру фармацевтические компании снабжали уже тысячи пациентов инсулином, экстрагированным из поджелудочных желез свиней.
С развитием технологий генной инженерии в 1980-х гг. (гл. 9, т. 1) появилась возможность вырабатывать неограниченные количества человеческого инсулина с помощью микроорганизмов, которых позже стали выращивать в промышленных масштабах. В настоящее время некоторые пациенты с диабетом используют инсулиновые насосы, которые контролируют уровень сахара крови и при необходимости вводят определенные количества инсулина, удовлетворяя изменяющиеся потребности в гормоне во время еды и при нагрузках. В перспективе возможна трансплантация больным диабетом фрагмента панкреатической ткани как источника инсулина, который будет реагировать подобно нормальной поджелудочной железе и высвобождать инсулин в кровоток только при увеличении уровня глюкозы крови.
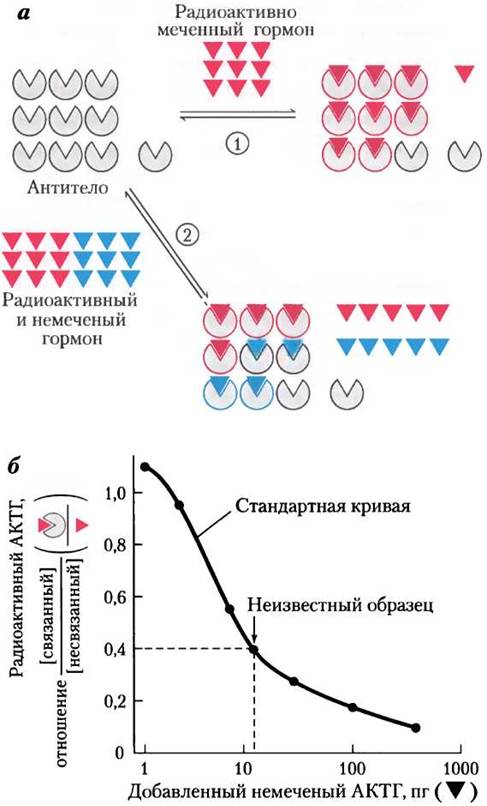
Ключевое вещество в радиоиммунном анализе — антитела, специфичные к определенному гормону. Очищенный гормон, введенный кролику, вызывает образование антител, связывающихся с этим гормоном с очень высоким сродством и специфичностью. При инкубации одного и того же (постоянного) количества изолированных антител с известным количеством радиоактивно меченного гормона с антителом связываются определенная доля радиоактивного гормона (рис. 23-3). Если помимо радиоактивно меченного гормона инкубируется и немеченый гормон, то немеченый гормон конкурентно вытесняет некоторое количество меченого гормона из его центра связывания на антителе. По концентрации, при которой меченый гормон вытесняется с антитела, рассчитывают количество немеченого гормона в образце крови или тканевого экстракта. При использовании очень высокорадиоактивного гормона можно повысить чувствительность метода до пикограммов гормона. Позднее появилась модификация этого метода — иммунофлуоресцентный анализ (ИФА); см. рис. 5-26, б, т. 1.
Рис. 23-3. Радиоиммунный анализ (РИА), а — низкие концентрации радиоактивно меченного гормона (красный) инкубировали (1) с определенным количеством антител, специфичных для этого гормона, или (2) с определенным количеством антител и немеченым гормоном в различных концентрациях (голубой). В последнем случае немеченый гормон конкурирует с меченым гормоном за связывание с антителом; количество связанного меченого гормона изменяется обратно пропорционально концентрации немеченого гормона, б — радиоиммунный анализ адренокортикотропного гормона (АКТГ, или кортикотропина). Для определения количества (немеченого) АКТГ в неизвестном образце строят стандартную кривую в координатах: отношение концентраций связанного радиоактивно меченного АКТГ и несвязанного против логарифма концентрации добавленного немеченого АКТГ. Если аликвоте с неизвестным количеством немеченого гормона соответствует отношение [связанный АКТГ]/[несвязанный АКТГ] = 0,4 (отмечено стрелкой), то эта аликвота должна содержать около 10 пг гормона.
Гормоны действуют через специфические клеточные рецепторы с высоким сродством
Как мы видели в гл. 12 (т. 1), все гормоны действуют через высокоспецифичные рецепторы в чувствительных к гормону клетках-мишенях, связывающих гормоны с высоким сродством (см. рис. 12-2, т. 1). Каждый тип клеток обладает своей собственной комбинацией рецепторов гормонов, которая определяет способность клеток отвечать на гормоны. Более того, клетки двух разных типов с одинаковыми рецепторами могут иметь разные внутриклеточные мишени для действия гормона и по-разному отвечать на один и тот же гормон. Специфичность действия гормонов определяется структурной комплементарностью гормона к рецептору; это взаимодействие очень избирательно, и поэтому похожие по структуре гормоны могут оказывать разное действие. Высокое сродство к определенному гормону позволяет клеткам отвечать на гормон в очень низкой концентрации. При лекарственной терапии гормональными препаратами, чтобы не нарушить тонкое равновесие в организме, необходимо исходя из структуры препарата учитывать соответствие специфичности и сродства у лекарства и природного гормона. Напомним, взаимодействие рецептора с гормоном можно количественно измерить с помощью анализа Скэтчарда (см. доп. 12-1, т. 1), который при оптимальных условиях позволяет рассчитать сродство (константу диссоциации комплекса) и число центров связывания гормона в препарате рецептора.
В зависимости от типа гормона взаимодействие гормона с рецептором может происходить на поверхности клетки, в цитозоле или в ядре. Внутриклеточные последствия взаимодействий гормон-рецептор можно разделить по крайней мере на шесть основных типов. (1) Внутри клетки образуется вторичный мессенджер (такой, как сАМР или инозиттрисфосфат), который действует как аллостерический регулятор одного или более ферментов. (2) Рецепторная тирозинкиназа активируется внеклеточным гормоном. (3) Рецепторная гуанилатциклаза активируется и образует вторичный мессенджер сGМР. (4) Из-за открывания или закрывания регулируемых гормоном ионных каналов происходит изменение мембранного потенциала. (5) Рецептор адгезии на клеточной поверхности взаимодействует с молекулами внеклеточного матрикса и сообщает информацию на цитоскелет. (6) Стероид или стероидоподобная молекула вызывает изменение уровня экспрессии (транскрипции ДНК в мРНК) одного или более генов, это происходит при связывании гормона с белком своего ядерного рецептора (см. рис. 12-2, т. 1).
Водорастворимые пептидные гормоны и гормоны-амины (например, инсулин и адреналин) действуют внеклеточно, связываясь на поверхности клетки с рецепторами, пронизывающими плазматическую мембрану (рис. 23-4). Когда гормон связывается с внеклеточным доменом рецептора, конформация рецептора меняется так же, как это происходит у аллостерического фермента при связывании молекулы эффектора. Конформационное изменение вызывает последующие эффекты гормона.
Одна молекула гормона, образуя комплекс гормон-рецептор, активирует катализатор, который вызывает продуцирование многих молекул вторичного мессенджера; таким образом, рецептор не только передает сигнал, но и усиливает его. Далее сигнал может быть амплифицирован сигнальным каскадом из последовательных стадий, в которых катализатор активирует катализатор, приводя к очень большому усилению первоначального сигнала. Каскад такого типа происходит при регуляции адреналином синтеза и расщепления гликогена (см. рис. 12-7, т. 1). Адреналин (через свой рецептор) активирует аденилатциклазу, вырабатывающую много молекул сАМР в ответ на каждую молекулу гормона, связанную с рецептором. Циклический АМР в свою очередь активирует сАМР-зависимую протеинкиназу (протеинкиназу А), активирующую фосфорилазу киназы, которая активирует гликогенфосфорилазу. В результате происходит амплификация (усиление) сигнала: одна молекулу адреналина вызывает образование многих тысяч молекул глюкозо-1-фосфата из гликогена.
Рис. 23-4. Два основных механизма действия гормона. Пептидные гормоны и гормоны-амины действуют быстрее, чем стероидные и тиреоидные гормоны.
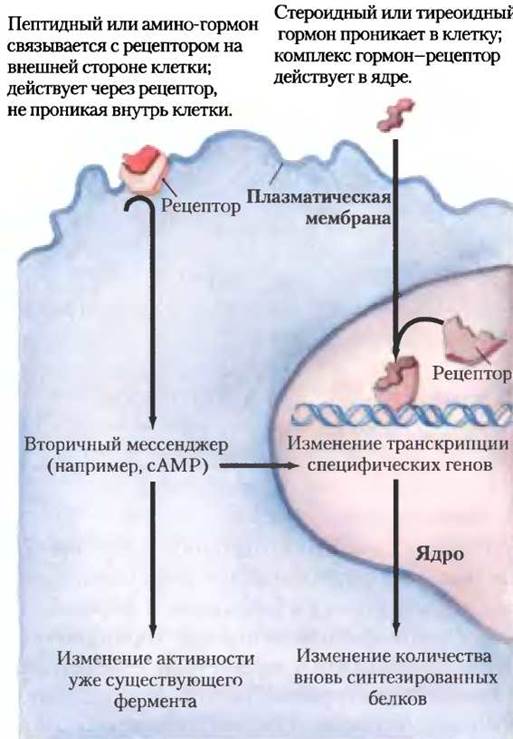
Нерастворимые в воде гормоны (стероиды, ретиноиды и гормоны щитовидной железы) легко проходят через плазматическую мембрану своих клеток-мишеней к рецепторным белкам в ядре (рис. 23-4). Для этого класса гормонов характерно, что комплекс гормон-рецептор сам передает сигнал; он взаимодействует с ДНК, меняя экспрессию специфических генов, при этом изменяется соотношение ферментов в клетке и, таким образом, изменяется и клеточный метаболизм (см. рис. 12-29, т. 1).
Гормоны, которые действуют через рецепторы плазматической мембраны, в основном инициируют очень быстрые физиологические или биохимические ответы. Так, уже через несколько секунд после выделения в кровоток адреналина из мозгового вещества надпочечников в скелетных мышцах происходит ответное ускоренное расщепление гликогена. Напротив, гормоны щитовидной железы и половые (стероидные) гормоны дают максимальные ответы в тканях-мишенях только через часы или даже дни. Эти различия в характерных временах ответа соответствуют различным способам действия. В основном быстро действующие гормоны вызывают изменения активности с помощью аллостерического механизма или ковалентной модификации одного или нескольких из уже существующих в клетке ферментов. Медленно действующие гормоны, как правило, меняют экспрессию генов, приводя к усилению или подавлению синтеза регулируемых ими белков.
Гормоны химически разнообразны
В организме млекопитающих синтезируются гормоны нескольких классов, которые различаются по своей химической структуре и способам действия (табл. 23-1). Снаружи клетки-мишени действуют, связываясь с поверхностными рецепторами, пептидные гормоны, эйкозаноидные гормоны и гормоны-амины. Стероиды, витамин D, ретиноиды и гормоны щитовидной железы проникают внутрь клетки и действуют через ядерные рецепторы. Монооксид азота также проникает в клетку, но активирует цитозольный фермент, гуанилатциклазу (см. рис. 12-10, т. 1).
Классификация гормонов может быть также основана на пути от центра их высвобождения до ткани-мишени. Эндокринные (от греч. endon — внутри и krinein — освобождать) гормоны высвобождаются в кровь и переносятся к клеткам- мишеням через все тело (например, инсулин). Паракринные гормоны выделяются в межклеточное пространство и диффундируют к соседним клеткам-мишеням (к такому типу принадлежат эйкозаноидные гормоны). Аутокринные гормоны высвобождаются теми клетками, на которые они же и действуют, связываясь с рецепторами на клеточной поверхности.
Млекопитающие обладают необычайной уникальной гормональной сигнальной системой. Но у насекомых и нематод также есть высокоразвитые системы гормональной регуляции, причем механизмы регуляции во многом похожи на механизмы регуляции у млекопитающих. Растения тоже используют гормональные сигналы для координации ферментативной активности в разных тканях (гл. 12). Исследование действия растительных гормонов продвигается не так успешно, как изучение гормонов животных, но уже известно, что некоторые механизмы у них одинаковы. Для иллюстрации структурного разнообразия и механизмов действия гормонов млекопитающих обсудим для каждого класса гормонов (табл. 23-1) наиболее яркие примеры.
Таблица 23-1. Классы гормонов

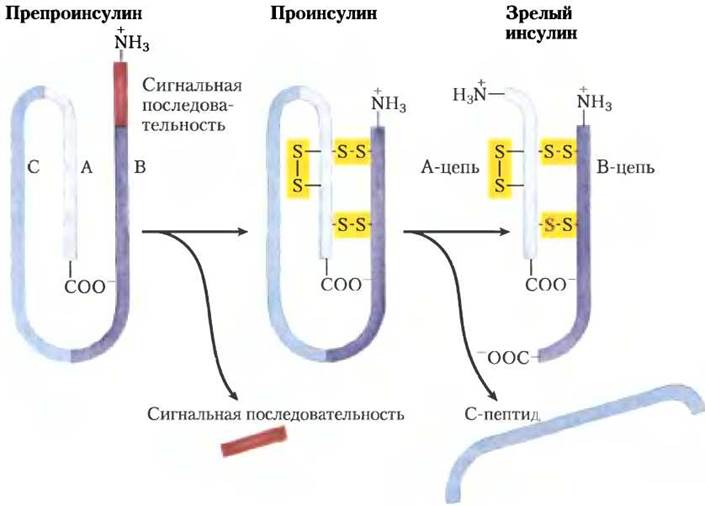
Петидные гормоны. Пептидные гормоны могут состоять из 3-200 или более аминокислотных остатков. Это гормоны поджелудочной железы инсулин, глюкагон и соматостатин, гормон пара щитовидных желез кальпитонин и все гормоны гипоталамуса и гипофиза (см. ниже). Эти гормоны синтезируются на рибосомах в форме длинных белков-предшественников (прогормонов), затем упаковываются в секреторные везикулы и протеолитически расщепляется до образования активных пептидов. Инсулин — это небольшой белок (Мr 5800) с двумя полипептидными цепями А и В, соединенными двумя дисульфидными связями. В поджелудочной железе синтезируется неактивный одноцепочечный предшественник препроинсулин (рис. 23-5) с сигнальной последовательностью на N-конце, которая и направляет его в секреторные везикулы. (Сигнальные последовательности обсуждаются в гл. 27; см. рис. 27-38, т. 3.) Протеолитическое удаление сигнальной последовательности и образование трех дисульфидных связей приводит к проинсулину, который хранится в секреторных гранулах β-клеток поджелудочной железы. При активации секреции инсулина повышенным уровнем глюкозы накопленный в крови проинсулин превращается в активный инсулин специфическими протеазами, расщепляющими две пептидные связи с образованием зрелой молекулы инсулина.
Рис. 23-5. Инсулин. Зрелый инсулин образуется из макромолекулы своего предшественника препроинсулина при процессинге путем протеолиза. Проинсулин получается при удалении сегмента из 23 аминокислотных остатков (сигнальная последовательность) с N-конца препроинсулина и образовании трех дисульфидных связей. В ходе дальнейшего протеолитического расщепления с проинсулина удаляется С-пептид, при этом получается зрелый инсулин, состоящий из А- и В-цепей. Аминокислотная последовательность бычьего инсулина представлена на рис. 3-24 в т. 1.
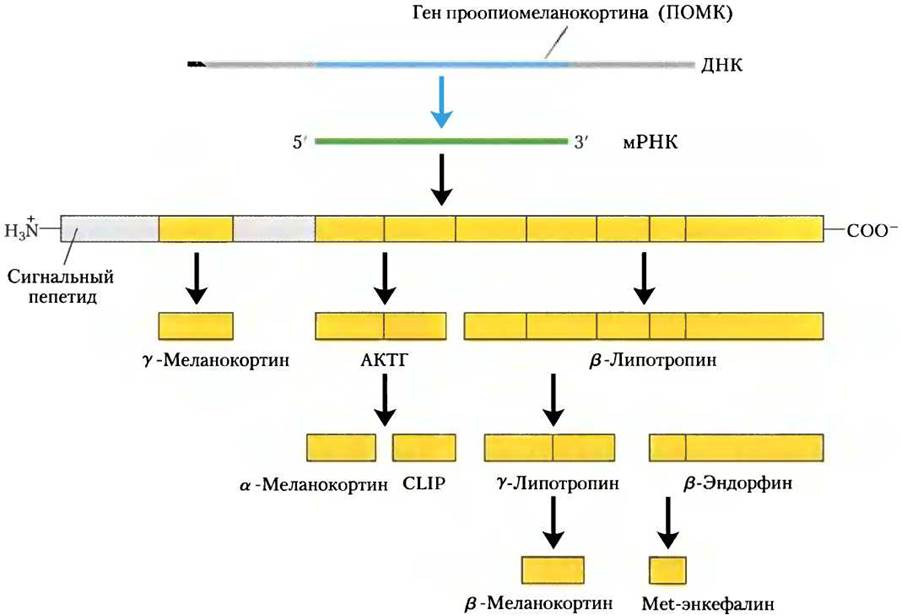
Но гораздо чаще вместо образования одного большого пептидного гормона из белка- прогормона получается несколько активных гормонов. Яркий пример того, когда несколько гормонов кодированы единственным геном, — это проопиомеланокортин (ПОМК). Ген ПОМК кодирует большой полипептид, который последовательно дробится по крайней мере на девять биологически активных пептидов (рис. 23-6). Концевые остатки пептидных гормонов очень часто модифицируются, как, например, в случае ТRН (рис. 23-2).
Рис. 23-6. Протеолитический процессинг предшественника проопиомеланокортина (ПОМК). Исходный продукт гена ПОМК — это длинный полипептид, который подвергается расщеплению серией протеаз. Это приводит к образованию АКТГ, β- и y-липотропинов, α-, β- и у-МСГ (меланоцитстимулирующих гормонов), CLIP (кортикотропинподобного пептидного интермедиата), β-эндорфина и Met-энкефалина. Места расщепления — между парами аминокислотных остатков Arg-Lys, Lys-Arg, Lys-Lys с основными свойствами.
Концентрация пептидных гормонов внутри секреторных гранул такая высокая, что содержимое везикул почти кристаллическое; поэтому, когда при экзоцитозе содержимое гранул высвобождается, одновременно появляется большое количество гормона. Эндокринные железы, продуцирующие пептиды, окружены фенестрированными капиллярами (они проницаемы для пептидов), таким образом молекулы гормонов легко проникают в кровоток и транспортируются в клетки-мишени по всему организму. Как отмечалось ранее, все пептидные гормоны действуют, связываясь с рецепторами на плазматической мембране. При этом образуется вторичный мессенджер, который, попадая в цитозоль, меняет активность определенного внутриклеточного фермента, и тем самым меняя весь клеточный метаболизм.
Катехоламинные гормоны. Водорастворимые вещества адреналин и норадреналин относят к катехоламинам из-за их структурного сходства с катехолом. Синтезируются они из тирозина.
Тирозин —> L-Дофа —> Дофамин —> Норадреналин —> Адреналин
Образующиеся в мозге и других тканях нервной системы катехоламины действуют как нейромедиаторы. Но гормоны адреналин и норадреналин синтезируются и секретируются надпочечниками. Как и пептидные гормоны, катехоламины содержатся внутри секреторных везикул в очень высокой концентрации, а высвобождаются посредством экзоцитоза. Действуют они, связываясь с рецепторами на поверхности клеток, что приводит к образованию внутриклеточных вторичных мессенджеров. С помощью катехоламинов осуществляется широкое разнообразие физиологических ответов на сильный стресс (см. табл. 23-6).
Эйкозаноидные гормоны (простагландины, тромбоксаны, лейкотриены) образуются из арахидоновой кислоты (20-углеродная жирная полиненасыщенная кислота).
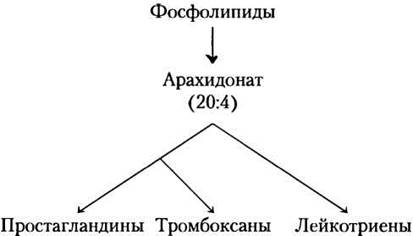
В отличие от гормонов, о которых мы говорили выше, они не синтезируются заранее и не хранятся, а вырабатываются, только когда нужны. Эйкозаноидные гормоны образуются из архидоновой кислоты, которая высвобождается из мембранных фосфолипидов под действием ферментативной активности фосфолипазы А2 (см. рис. 10-18, т. 1).
В тканях млекопитающих очень широко распространены ферменты, участвующие в биосинтезе простагландинов и тромбоксанов (см. рис. 21-15). Вырабатывать эйкозаноиды и посылать с их помощью сигналы способно большинство клеток, а клетки многих тканей могут отвечать на такие сигналы, активируя специфические рецепторы плазматической мембраны. Паракринные эйкозаноидные гормоны секретируются в тканевую жидкость (а иногда в кровь) и действуют на окружающие клетки.
Простагландины вызывают сокращение гладких мышц, в том числе кишечника и матки (поэтому их можно использовать для усиления схваток при родовспоможении). Эйкозаноиды также можно использовать как средство, снимающее боль и воспаление во всех тканях. Многие противовоспалительные лекарственные препараты действуют, ингибируя некоторые стадии синтеза простагландина (см. рис. 21-5). Тромбоксаны регулируют работу тромбоцитов и таким образом влияют на свертываемость крови. Лейкотриены LTС4 и LTD4 действуют на рецепторы плазматической мембраны, вызывая сокращения гладких мышц кишечника, бронхов и трахеи. Они опосредуют анафилактический шок — сильный негативный иммунный ответ. ■
Стероидные гормоны (адренокортикоидные и половые гормоны) синтезируются из холестерина несколькими эндокринными железами.
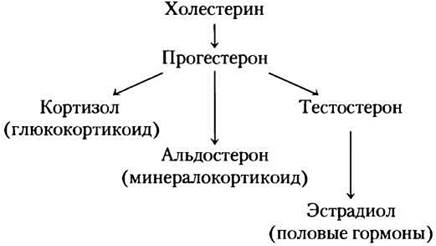
Связываясь с белками-переносчиками, они транспортируются кровотоком к клеткам-мишеням. В коре надпочечников вырабатывается более 50 кортикостероидных гормонов; в ферментативных реакциях из D-кольца холестерина удаляется боковая цепь и внедряется кислород с образованием кето- и гидроксильных групп. Многие из этих реакций протекают с участием ферментов, содержащих цитохром Р-450 (см. доп. 21-1). Существуют два типа стероидных гормонов. Глюкокортикоиды (например, кортизол) преимущественно действуют на метаболизм углеводов, минералокортикоиды (например, альдостерон) регулируют концентрацию электролитов в крови. В семенниках и яичниках синтезируются андрогены (тестостерон) и эстрогены (например, эстрадиол, см. рис. 10-19, т. 1). Их синтез происходит с участием ферментов, содержащих цитохром Р-450. Ферменты отщепляют боковую цепь от холестерина и присоединяют атомы кислорода. Андрогены и эстрогены действуют на половое развитие, половое поведение и на многие другие функции организма, как связанные, так и не связанные с репродуктивной сферой.
Все стероидные гормоны связываются с ядерными рецепторами и изменяют уровень экспрессии специфических генов (с. 643 в т. 1). Они могут действовать и быстрее — через рецепторы на плазматической мембране.
Гормон витамина D. Кальцитриол (1,25-дигид- роксихолекальциферол) вырабатывается в печени и почках из витамина D путем ферментативного гидроксилирования (рис. 10-20, а в т. 1). Витамин D организм получает с пищей или при фотолизе 7-дегидрохолестерина в коже на солнечном свету.
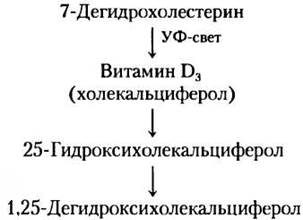
Кальцитриол участвует в гомеостазе Са2+ совместно с гормоном паращитовидных желез, регулируя концентрацию ионов кальция в крови и равновесие между запасаемым Са2+ и Са2+, мобилизованным из костей. Действуя через ядерные рецепторы, кальцитриол активирует синтез Са2+-связывающего белка в кишечнике, это необходимо для усвоения Са2+, поступающего с пищей. Неадекватное поступление с пищей витамина D или нарушения в биосинтезе кальцитриола приводят к таким серьезным заболеваниям, как рахиты, при которых кости становятся слабыми и уродливыми (рис. 10-20, б в т. 1). ■
Ретиноидные гормоны. Ретиноиды — сильнодействующие гормоны, регулирующие рост и дифференцировку клеток через ядерные ретиноидные рецепторы. Прогормон ретинол синтезируется из витамина А, преимущественно в печени (см. рис. 10-21 вт. 1); во многих тканях ретинол превращается в ретиноевую кислоту.
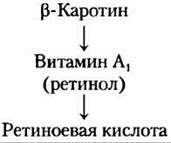
Ретиноевая кислота действует на все ткани, так как все типы клеток обладают по крайней мере одной формой ядерного ретиноидного рецептора. У взрослых самые главные мишени — роговица, кожа, эпителий легких и трахей и иммунная система. Ретиноевая кислота регулирует синтез белков, играющих большую роль в период роста и в дифференцировке клеток. Излишек витамина А может вызывать врожденные уродства, поэтому беременным женщинам советуют не использовать содержащие ретиноиды кремы, предназначенные для лечения сильной угревой сыпи. ■
Тиреоидные гормоны. Тиреоидные гормоны Т4 (тироксин) и Т3 (трииодтиронин) синтезируются из белка-предшественника тиреоглобулина (Мr 660 000). В щитовидной железе ферментативно иодируется более 20 остатков тирозина в молекуле тиреоглобулина. Затем два остатка иодтирозина соединяются с образованием гормона тироксина. При необходимости он высвобождается путем протеолиза. Моноиодтирозин, соединяясь с дииодтирозином, образует активный гормон Т3, который тоже высвобождается при протеолизе.

Тиреоидные гормоны действуют через ядерные рецепторы, стимулируя энергетический метаболизм, особенно в печени и в мышцах, усиливая экспрессию генов, кодирующих ключевые фермента катаболизма.
Монооксид азота (NO). Монооксид азота — достаточно стабильный радикал, который синтезируется из молекулы кислорода и азота гуанидина в аргинине (рис. 22-31) по реакции, катализируемой синтазой NO.
Аргинин + 11/2 NАDРН +2 O2 —> NO + цитруллин + 2 Н2O + 11/2 NАDР+
Этот фермент обнаружен во многих тканях и в клетках разного типа: в нейронах, макрофагах, гепатоцитах, миоцитах гладких мышц, в эндотелиальных клетках кровеносных сосудов и почек. Действует N0 недалеко от места выделения, проникая в клетки-мишени и активируя в цитоплазме фермент гуанилатциклазу, которая катализирует образование вторичного мессенджера сGМР (см. рис. 12-20 вт. 1).
Высвобождение гормонов регулируется иерархически нейрональными и гормональными сигналами
Изменение концентраций гормонов регулирует клеточные процессы, но что же регулирует уровень самих гормонов? За это ответственна центральная нервная система (ЦНС), которая, получая сигналы, например, об опасности, голоде, приеме пищи, составе и давлении крови от многих внутренних и внешних сенсоров, организует секрецию соответствующих гормонов эндокринными железами. Чтобы разобраться более подробно, рассмотрим основные гормональные системы в организме человека, а также их функциональные взаимосвязи.
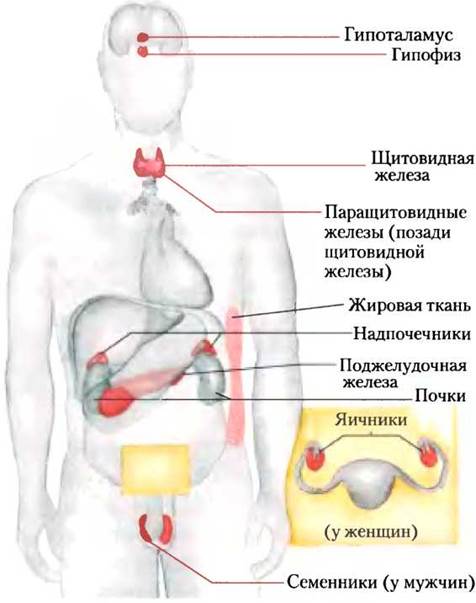
На рис. 23-7 показано анатомическое расположение главных желез внутренней секреции у человека, рис. 23-8 представляет «цепь команд» в иерархии гормональной сигнализации. Координационный центр эндокринной системы — это гипоталамус — небольшая область в мозге (рис. 23-9), где принимаются и интегрируются сообщения от центральной нервной системы. В ответ на сигналы ЦНС гипоталамус вырабатывает регуляторные гормоны (релизинг-факторы), которые проходят прямо к соседней железе гипофизу по специальным кровеносным сосудам и нейронам, соединяющим обе железы (рис. 23-9, б). Гипофиз состоит из двух функционально различных частей. Задняя доля гипофиза содержит окончания аксонов множества нейронов, тела которых располагаются в гипоталамусе. Эти нейроны вырабатывают короткие пептидные гормоны окситоцин и вазопрессин (рис. 23-10), перемещающиеся вниз по аксону к нервным окончаниям в гипофизе, где они накапливаются в секреторных гранулах, ожидая сигнала к высвобождению.
Рис. 23-7. Главные эндокринные железы. Железы отмечены красным цветом.
Передняя доля гипофиза отвечает на приносимые кровью гормоны гипоталамуса, вырабатывая тропные гормоны, или тропины (от греч. tropos — поворот). Это относительно длинные полипептиды, они активируют ряд желез внутренней секреции (рис. 23-8): кору надпочечников, щитовидную железу, яичники и семенники. В ответ эти железы секретируют свои специфические гормоны, которые переносятся кровотоком к клеточным рецепторам в тканях-мишенях. Например, кортикотропин-высвобождающий гормон гипоталамуса стимулирует высвобождение АКТГ передней долей гипофиза, и АКТГ направляется к пучковой зоне коры надпочечников и активирует высвобождение кортизола. Кортизол, последний гормон в этом каскаде, действует через свои рецепторы, изменяя метаболизм в клетках-мишенях разного типа. Один из эффектов кортизола в гепатоцитах — увеличение скорости глюконеогенеза.
Рис. 23-8. Главные эндокринные системы и их ткани-мишени. Сигналы, формирующиеся в центральной нервной системе (вверху), проходят через серию каскадов к конечным тканям-мишеням (внизу). Кроме показанных на схеме желез, гормоны секретируют также тимус, эпифиз и группы клеток в желудочно-кишечном тракте. Штриховыми линиями обозначены связи в ЦНС.
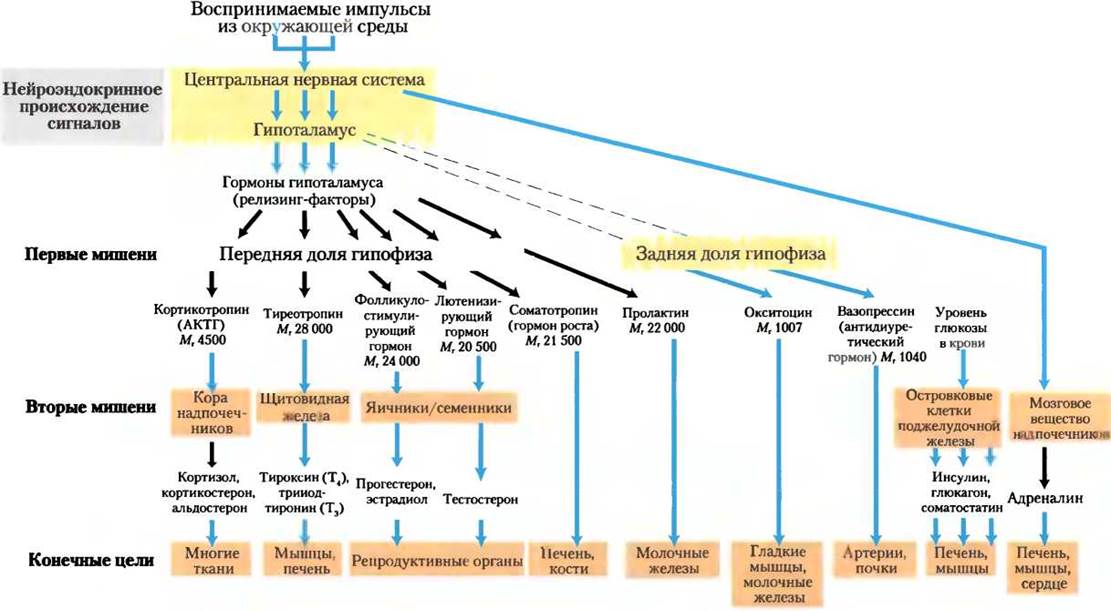
Рис. 23-9. Нейроэндокринное происхождение гормональных сигналов, а — расположение гипоталамуса и гипофиза. б — гипоталамо-гипофизарная система. Сигналы по вставочным нейронам от гипоталамуса к гипофизу стимулируют секрецию гипоталамусом релизинг-факторов в кровь, которая переносит эти гормоны прямо в капиллярную сеть передней доли гипофиза. В ответ на каждый релизинг-фактор гипоталамуса передняя доля гипофиза высвобождает соответствующий гормон в систему кровообращения. Гормоны задней доли гипофиза синтезируются в нейронах, идущих от гипоталамуса. Эти гормоны транспортируются по аксонам к нервным окончаниям в задней доле гипофиза и хранятся здесь до высвобождения в кровь в ответ на нервный импульс.
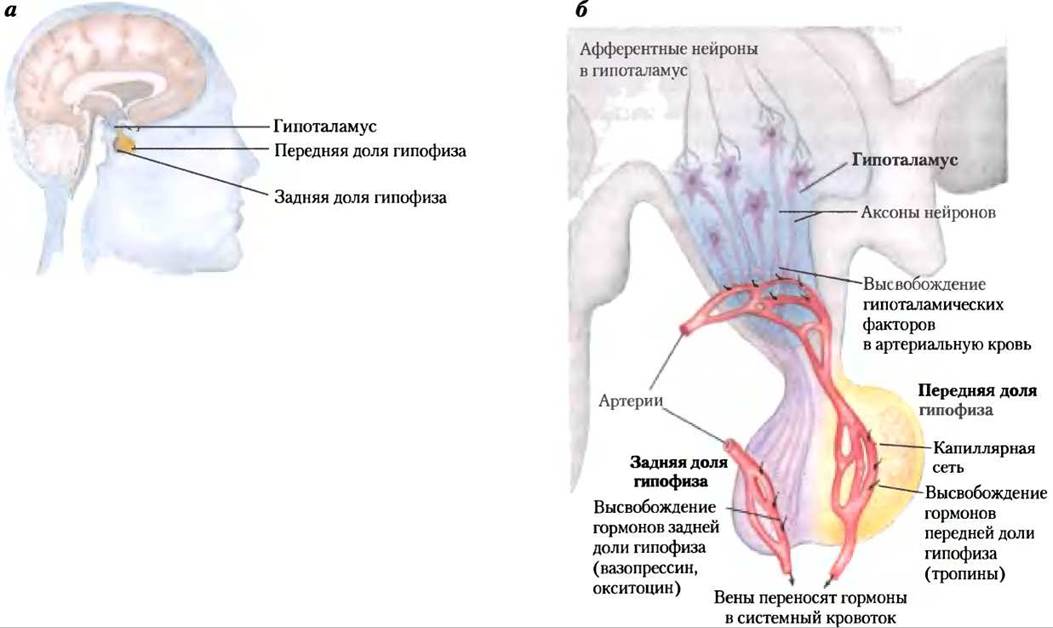
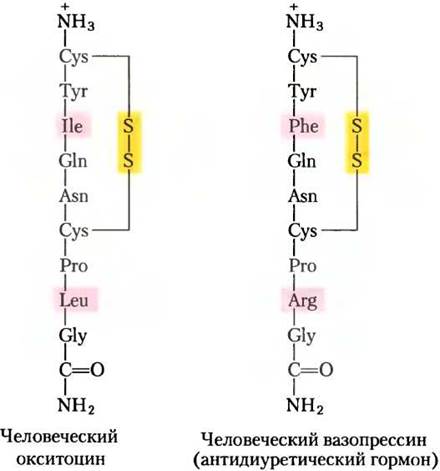
Рис. 23-10. Два гормона задней доли гипофиза. На С-концах обоих пептидов находится глицинамид -NH-СН2-СONH2 (амидирование С-концов характерно для коротких пептидных гормонов; см. рис. 23-2). Эти два гормона по составу идентичны, кроме двух остатков (выделены розовым), но они обладают очень разным биологическим действием. Окситоцин влияет на гладкие мышцы матки и на молочные железы, вызывая сокращение матки во время родов и выделение молока при лактации. Вазопрессин (антидиуретический гормон) увеличивает всасывание воды в почках и вызывает сужение кровеносных сосудов, таким образом повышая кровяное давление.
Гормональные каскады, ведущие к высвобождению кортизола и адреналина, вызывают значительное усиление начального сигнала и позволяют очень тонко и точно регулировать поступление конечного гормона каскада (рис. 23-11). На каждом уровне каскада «малый» сигнал усиливается до «большего» ответа. Первоначальный электрический импульс, пришедший в гипоталамус, ведет к выделению нескольких нанограммов кортикотропин-высвобождающего гормона, который усиливает сигнал, вызывая высвобождение нескольких микрограммов кортикотропина. Кортикотропин действует на кору надпочечников, стимулируя выделение нескольких миллиграммов кортизола, в результате происходит амплификация сигнала по крайней мере в миллион раз.
Рис. 23-11. Каскад высвобождения гормонов после импульса из центральной нервной системы в гипоталамус. В каждой эндокринной железе сигнал с более высокого уровня принимается, амплифицируется и приводит к высвобождению следующего в каскаде гормона. Каскад на нескольких уровнях чувствителен к регуляции по механизму обратной связи путем ингибирования конечным гормоном (в случае кортизола). Иными словами, продукт регулирует свое собственное образование, как это происходит по механизму обратной связи путем ингибирования биосинтеза внутри клетки.
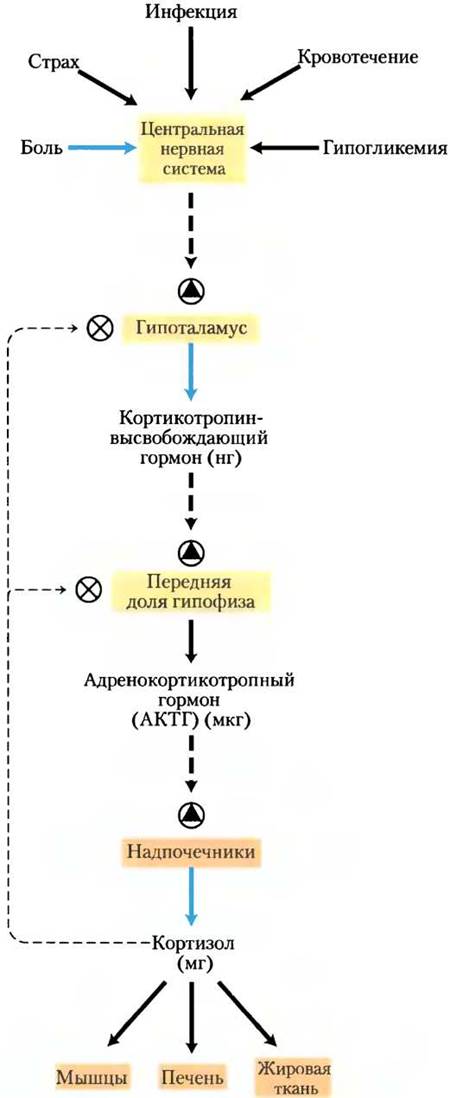
На каждом уровне гормонального каскада возможно ингибирование ранних стадий по механизму обратной связи — завышенный сверх необходимого уровень конечного гормона или одного из промежуточных гормонов ингибирует высвобождение предыдущих гормонов каскада. Здесь механизм обратной связи приводит к тому же результату, что и механизм, лимитирующий образование продукта в путях биосинтеза (ср. рис. 23-11 и рис. 6-28 вт. 1): продукт синтезируется (или высвобождается) только до тех пор, пока не будет достигнута необходимая концентрация.
Краткое содержание раздела 23.1 Гормоны: различные структуры для различных функций
■ Гормоны — химические посредники, секретируемые определенными тканями в кровь или тканевую жидкость, служащие для регуляции активности других клеток или тканей.
■ Радиоиммунный анализ (РИА) и иммунофлуоресцентный анализ (ИФА) — два очень чувствительных метода для обнаружения и количественного определения уровня гормонов.
■ Пептидные гормоны, эйкозаноидные гормоны и аминогормоны действуют снаружи клетки-мишени на специфические рецепторы плазматической мембраны, изменяя уровень внутриклеточного вторичного мессенджера.
■ Стероидные гормоны, ретиноидные гормоны, витамин D и гормоны щитовидной железы проникают в клетки-мишени и взаимодействуют со специфическими ядерными рецепторами.
■ Гормональные каскады, в которых катализатор активирует катализатор, усиливают (амплифицируют) первоначальный стимул в несколько раз, часто за очень короткое время (за секунды).
■ Нервные импульсы стимулируют гипоталамус для отправки определенных гормонов к гипофизу, стимулируя (или ингибируя) тем самым высвобождение тройных гормонов. Эти гормоны в свою очередь стимулируют другие железы внутренней секреции (щитовидную железу, надпочечники, поджелудочную железу) для секреции их собственных гормонов, которые уже стимулируют ткани-мишени.