ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
23. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ И ИНТЕГРАЦИЯ МЕТАБОЛИЗМА МЛЕКОПИТАЮЩИ
23.2. Тканеспецифичный метаболизм: разделение функций
Каждая ткань человеческого тела обладает специализированными функциями, что находит отражение в анатомии и метаболической активности (рис. 23-12). Скелетные мышцы осуществляют направленное движение; жировая ткань сохраняет и выделяет энергию в форме жиров, которые служат топливом для всего тела; клетки мозга транспортируют ионы, создавая электрические сигналы. Печень играет центральную обрабатывающую и распределяющую роль в метаболизме и поставляет по кровотоку во все другие органы и ткани необходимую смесь питательных веществ. Центральная функциональная роль печени подтверждается ее взаимосвязями со всеми другими внепеченочными, или периферическими, тканями и органами. Поэтому наше обсуждение разделения метаболических функций начнем с превращений углеводов, аминокислот и жиров в печени млекопитающих. Далее рассмотрим и кратко охарактеризуем основные метаболические функции жировой, мышечной и мозговой тканей, а также крови — посредника между всеми тканями организма.
Рис. 23-12. Специализированные метаболические функции тканей млекопитающих.
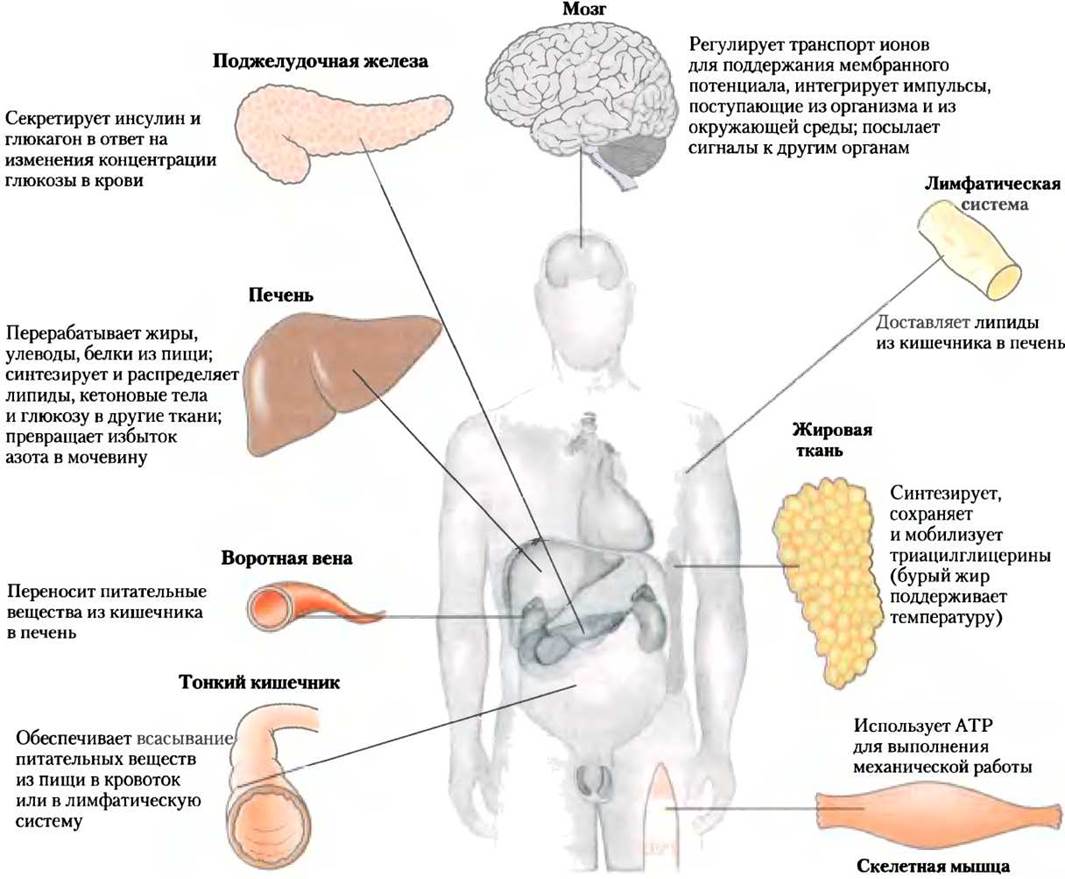
Процессы в печени и распределение питательных веществ
У млеопитающих в процессе пищеварении три основных класса питательных веществ (углеводы, белки и жиры) подвергаются ферментативному гидролизу, приводящему к расщеплению их на менее сложные соединения. Расщепление необходимо, так как через эпителиальные клетки, выстилающие стенки кишечника, всасываются только относительно небольшие молекулы. Многие жирные кислоты и моноацилглицерины, высвобождаемые при переваривании жиров в кишечнике, превращаются в эпителиальных клетках снова в триациалглицерины.
После того как произошло всасывание основных количеств сахаров и аминокислот, а некоторое количество триацилглицеринов было перенесено кровотоком к печени, оставшиеся триацилглицерины с лимфой поступают в жировую ткань. «Воротами» из пищеварительной системы в печень служит воротная вена. Поэтому-то печень — первый орган, которого достигают все питательные вещества пищи на своем
пути. Печень содержит в основном клетки двух типов. Звездчатые эндотелиоциты — это фагоциты, выполняющие иммунную функцию. Но сейчас нас больше интересуют гепатоциты. Они превращают полученные из пищи питательные вещества в топливные молекулы и биосинтетические предшественники, необходимые другим тканям, и выделяют их в кровь. Разнообразие и количество поступающих в печень питательных веществ варьируют в зависимости от нескольких факторов, включая рацион питания и время между приемами пищи. Потребность разных органов и тканей в энергии и молекулах-предшественниках также различается в зависимости от уровня активности человека и его конституции.
Чтобы учесть эти постоянно меняющиеся параметры, печень обладает значительной метаболической пластичностью. Например, при богатой белками диете уровень ферментов для расщепления аминокислот и глюконеогенеза в гепатоцитах становится очень высоким. Если в пище много углеводов, то буквально в течение нескольких часов концентрации этих ферментов начинают снижаться, а гепатоциты увеличивают производство ферментов, необходимых для метаболизма углеводов и синтеза жиров. Оборот ферментов печени (их синтез и распад) в 5-10 раз выше скорости ферментативного оборота в других тканях, например, в мышцах. Внепеченочные ткани тоже могут приспосабливать свой метаболизм к текущим условиям, но в нашем организме нет органа, более способного к адаптации, чем печень, и играющего такую же важную роль в общем метаболизме. Далее мы рассмотрим возможные пути метаболизма сахаров, аминокислот и липидов, приносимых в печень кровотоком. Для наглядности метаболических превращений главные пути и процессы суммированы в табл. 23-2, там же приведены номера рисунков, где каждый путь представлен подробно. Здесь мы только обобщаем данные об этих путях, указывая номер стадии на рис. 23-13-23-15.
Таблица 23-2. Метаболические пути углеводов, аминокислот и жиров, обсуждаемые в предыдущих главах
Путь |
Номер рисунка |
Цикл лимонной кислоты: ацетил-СоА —> 2 СО2 |
16-7 |
Окислительное фосфорилирование: синтез АТР |
19-20 |
Катаболизм углеводов |
|
Гликогенолиз: гликоген —> глюкозо-1-фосфат —> глюкоза крови |
15-25; 15-26 |
Включение гексоз в гликолиз: фруктоза, манноза, галактоза —> глюкозо-6-фосфат |
14-10 |
Гликолиз: глюкоза —> пируват |
14-2 |
Пируватдегидрогеназная реакция: пируват —> ацетил-СоА |
16-2 |
Молочнокислое брожение: глюкоза —> лактат + АТР |
14-3 |
Пентозофосфатный путь: глюкозо-6-фосфат —> пентозофосфаты + NАDРН |
14-21 |
Анаболизм углеводов |
|
Глюконеогенез: интермедиаты цикла Кребса —> глюкоза |
14-16 |
Глюкозо-аланиновый цикл: глюкоза —> пируват —> аланин —> глюкоза |
18-9 |
Синтез гликогена: глюкозо-6-фосфат —> глюкозо-1-фосфат —> гликоген |
15-30 |
Метаболизм аминокислот и нуклеотидов |
|
Расщепление аминокислот: аминокислоты —> ацетил-СоА, интермедиаты цикла Кребса |
18-15 |
Синтез аминокислот |
22-9 |
Цикл мочевины: NН3 —> мочевина |
18-10 |
Глюкозо-аланиновый цикл: аланин —> глюкоза |
18-9 |
Синтез нуклеотидов: аминокислоты —> пурины, пиримидины |
22-33; 22-36 |
Синтез гормонов и нейромедиаторов |
22-29 |
Катаболизм жиров |
|
β-Окисление жирных кислот: жирные кислоты —> ацетил-СоА |
17-8 |
Окисление кетоновых тел: β-гидроксибутират —> ацетил-СоА —> СO2 в цикле Кребса |
17-19 |
Анаболизм жиров |
|
Синтез жирных кислот: ацетил-СоА —> жирные кислоты |
21-6 |
Синтез триацилглицеринов: ацетил-СоА —> жирные кислоты —> триацилглицерины |
21-18; 21-19 |
Образование кетоновых тел: ацетил-СоА —> ацетоацетат, β-гидроксибутират |
17-18 |
Синтез холестерина и эфиров холестерина: ацетил-СоА —> холестерин —> эфиры холестерина |
21-33-21-37 |
Синтез фосфолипидов: жирные кислоты —> фосфолипиды |
21-17; 21-23-21-28 |
Сахара. Переносчик глюкозы в гепатоцитах (GLUT2) столь эффективен, что обеспечивает внутри гепатоцита практически такую же концентрацию глюкозы, как в крови. Глюкоза, проникающая в гепатоцит, фосфорилируется гексокиназой IV (глюкокиназой) до глюкозо-6-фосфата. Глюкокиназа имеет настолько высокую константу Км (мМ), что не ингибируется продуктом своей реакции — глюкозо-6-фосфатом, успешно подавляющим изоферменты гексокиназы в других клетках (с. 141). В присутствии глюкокиназы гепатоциты продолжают фосфорилирование глюкозы, даже когда концентрация глюкозы увеличивается настолько, что активность других гексокиназ была бы давно подавлена. Большая величина Км глюкокиназы также обеспечивает фосфорилирование глюкозы при очень низкой ее концентрации в ге- патоцитах, не позволяя самой печени потреблять глюкозу и использовать ее в гликолизе. Таким образом глюкоза экономится для других тканей. Фруктоза, галактоза и манноза, которые всасываются в тонком кишечнике, тоже превращаются в глюкозо-6-фосфат в ферментативных путях, рассмотренных в гл. 14. Глюкозо-6-фосфат — ключевая молекула в нескольких путях углеводного метаболизма печени (рис. 23-13), а метаболический путь выбирается в зависимости от текущих потребностей организма. С помощью различных аллостерически регулируемых ферментов и через гормональную регуляцию синтеза и активности ферментов печень направляет поток глюкозы по одному или нескольким из этих путей.
Рис. 23-13. Метаболические пути глюкозо-6-фосфата в печени. Здесь и на рис. 23-14 и 23-15 анаболические пути показаны стрелкой вверх, а катаболические пути — стрелкой вниз, при распределении к другим органам — горизонтальные стрелки. Процессы описаны в тексте под соответствующим номером.
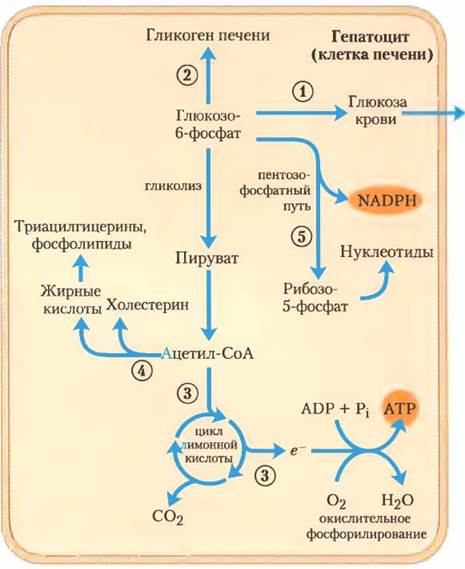
(1) Глюкозо-6-фосфат дефосфорилируется глюкозо-6-фосфатазой до высвобождения свободной глюкозы (см. рис. 15-28), которая затем дополняет уровень глюкозы крови. Когда запас глюкозо-6-фосфата ограничен, происходит преимущественно его экспорт, потому что для обеспечения мозга и других тканей необходимым количеством энергии концентрация глюкозы в крови должна поддерживаться на достаточно высоком уровне (4 мМ). (2) Глюкозо-6-фосфат, который не используется немедленно для образования глюкозы и выделения ее в кровь, превращается в гликоген печени или же попадает в один из нескольких других путей. Последующее расщепление глюкозо-6-фосфата происходит при гликолизе и декарбоксилировании пирувата (в пируватдегидрогеназной реакции), (3) образованный при этом ацетил-СоА может быть окислен с выделением энергии в цикле лимонной кислоты с последующим переносом электрона и окислительным фосфорилированием, при котором происходит синтез АТР. (Но обычно для получения энергии в гепатоцитах служат жирные кислоты). (4) Ацетил-СоА также может служить предшественником жирных кислот, которые включаются в состав триацилглицеринов, фосфолипидов и холестерина. Основные количества липидов, синтезированных в печени, транспортируются в другие ткани кровотоком как липопротеины. (5) Наконец, глюкозо-6-фосфат может поступать в пентозофосфатный путь, где участвует в образовании NADPH, необходимого при биосинтезе жирных кислот и холестерина, или в образовании D-рибозо-5-фосфата, предшественника в биосинтезе нуклеотидов. Кроме того, NADPH играет существенную роль также в детоксикации и выведении многих лекарств и ксенобиотиков, метаболизируемых печенью.
Аминокислоты. Аминокислоты, попадающие в печень, отправляются по нескольким важным метаболическим путям (рис. 23-14). (1) Они служат предшественниками для синтеза белков; этот процесс обсуждается в гл. 27. Печень постоянно обновляет свои собственные белки, которые имеют относительно высокую скорость оборота (среднее время их полужизни — несколько дней), а также синтезирует большинство белков плазмы крови. (2) Аминокислоты переносятся кровотоком к другим органам для использования в биосинтезе белков тканей. (3) Другие аминокислоты являются предшественниками в биосинтезе нуклеотидов, гормонов и азотсодержащих веществ в печени и других тканях.
Рис. 23-14. Метаболизм аминокислот в печени.
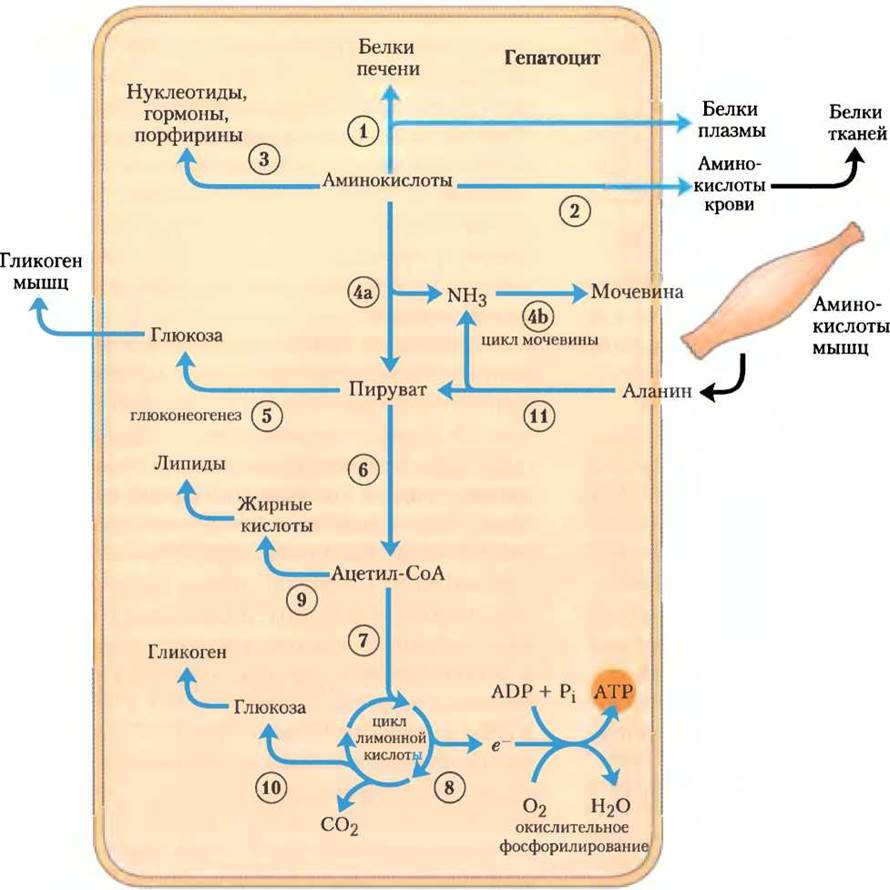
(4a). Аминокислоты, не использованные как предшественники в биосинтезе, трансаминируются или дезаминируются и расщепляются с образованием пирувата и интермедиатов цикла лимонной кислоты (с различными судьбами). (4б). Высвобождаемый аммиак превращается в выделяемый из организма продукт — мочевину. (5) Пируват превращается в глюкозу и гликоген в ходе глюконеогенеза или (6) он может быть превращен в ацетил-СоА, у которого тоже несколько дальнейших путей превращения. (7) Он может быть окислен в цикле лимонной кислоты и (8) при окислительном фосфорилировании образовать АТР или (9) превращен в липиды для хранения. (10) Интермедиаты цикла лимонной кислоты могут быть перекачаны в синтез глюкозы с помощью глюконеогенеза.
Печень также метаболизирует аминокислоты, которые приходят из других тканей. Глюкоза поступает в кровь сразу после переваривания и всасывания углеводов пищи или между приемами пищи при превращении гликогена печени в глюкозу крови. Во время перерывов между приемами пищи, особенно продолжительных, до аминокислот расщепляется некоторое количество белков мышц. Эти аминокислоты предоставляют свои аминогруппы (с помощью реакции трансаминирования) продукту гликолиза пирувату, образуя аланин, который (11) транспортируется в печень и там дезаминируется. Гепатоциты превращают получившийся пируват в глюкозу крови (в процессе глюконеогенеза (5), а аммиак — в мочевину для выведения из организма (4б). Важное свойство этого глюкозо-аланинового цикла (рис. 18-9) — сглаживание колебаний уровня глюкозы крови между приемами пищи. В мышцах дефицит аминокислот восстанавливается после нескольких приемов пищи.
Липиды. У проникающих в гепатоциты жирных кислот, которые входят в состав липидов, тоже возможно несколько путей превращения (рис. 23-15). (1) Некоторые превращаются в липиды печени. (2) Большинство жирных кислот в печени окисляется с выделением энергии. Свободные жирные кислоты могут быть активированы и окислены с образованием ацетил-СоА и NADPH. (3) Ацетил-СоА далее окисляется в цикле лимонной кислоты, и (4) продукты окисления участвуют в синтезе АТР при окислительном фосфорилировании. (5) Избыток ацетил-СоА (неиспользованный) превращается в печени в ацетоацетат и β-гидроксибутират; эти кетоновые тела с кровотоком поступают в другие ткани и могут использоваться в качестве топлива в цикле лимонной кислоты. Кетоновые тела можно считать транспортной формой ацетильных групп. В некоторых внепеченочных тканях именно так запасается во время продолжительного голодания значительная часть энергии — до 1/3 в сердце и более чем 60-70% в мозге. (6) Некоторое количество ацетил- СоА, образованного из жирных кислот (и из глюкозы), используется для биосинтеза холестерина, который необходим для построения мембран. Кроме того, холестерин служит предшественником всех стероидных гормонов и желчных солей, которые необходимы для переваривания и всасывания липидов.
Рис. 23-15. Метаболизм жирных кислот в печени.
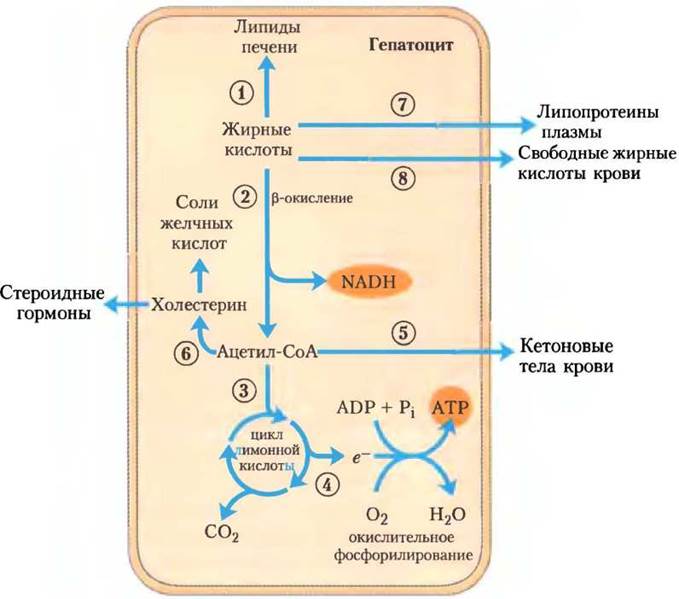
Два других пути превращения липидов используются в специализированных механизмах транспорта нерастворимых липидов с кровотоком. (7) Жирные кислоты превращаются в фосфолипиды и триацилглицерины липопротеинов крови, которые доставляют липиды в жировую ткань для хранения в виде триацилглицеринов. (8) Некоторые свободные жирные кислоты связываются с сывороточным альбумином и направляются к сердцу и скелетным мышцам, где свободные жирные кислоты поглощаются и используются путем окисления как основной источник энергии. Сывороточный альбумин — самый распространенный белок плазмы крови; а одна его молекула может переносить до 10 молекул свободных жирных кислот.
Таким образом, в организме печень служит распределяющим центром, который экспортирует питательные вещества в нужных пропорциях ко всем органам, сглаживая колебания концентраций веществ, возникающие между приемами пищи, и перерабатывает избыток аминогрупп в мочевину и другие продукты, которые выводятся через почки. В печени хранятся определенные питательные вещества, включая ионы железа и витамин А. Кроме того, печень обезвреживает чужеродные органические вещества, такие как лекарства, пищевые добавки, консерванты и другие потенциально вредные вещества, не имеющие пищевой ценности. При детоксикации часто происходит гидроксилирование с участием цитохрома Р-450 малорастворимых органических соединений, что делает их более растворимыми и доступными для дальнейших реакций деградации и для выведения из организма (см. доп. 21-1).
Жировая ткань запасает и поставляет жирные кислоты
Существуют два типа жировой ткани — белая и бурая, выполняющие в организме разные функции; сначала мы поговорим о той, которая присутствует в организме в большем количестве. Белая жировая ткань (рис. 23-16, а) имеет аморфную структуру и локализуется в органах и различных частях тела — в коже, вокруг глубоких кровеносных сосудов, а также в области живота. Адипоцит белой жировой ткани — крупная клетка сферической формы (диаметр от 30 до 70 мкм); он почти полностью заполнен большой каплей жира (три- ацилглицерина), который составляет -65% массы клетки и сдвигает митохондрии и ядро клетки в узкое свободное от жира пространство вблизи плазматической мембраны (рис. 23-16, б). В организме взрослого здорового человека на белую жировую ткань приходится около 15% общей массы тела. Адипоциты метаболически очень активны, быстро отвечают на гормональные сигналы между печенью, скелетными мышцами и сердцем.
Рис. 23-16. Адипоциты белой и бурой жировой ткани. а — раскрашенное изображение адипоцитов человека в белой жировой ткани, полученное с помощью сканирующего электронного микроскопа. В жировой ткани сферические адипоциты окружены сетью капилляров и коллагеновых волокон. Почти весь объем этих метаболически активных клеток занят каплей жира, б — типичный адипоцит белой жировой ткани и в — типичный адипоцит бурой жировой ткани. В клетках бурой жировой ткани митохондрии гораздо более заметны, ядро располагается вблизи центра клетки, просматриваются многочисленные отдельные капельки жира. Адипоциты белой жировой ткани крупнее и содержат по одной большой капле жира, прижимающей митохондрии и ядро к плазматической мембране.

Как и другие типы клеток, адипоциты активно осуществляют гликолиз, используют цикл лимонной кислоты для окисления пирувата и жирных кислот и проводят окислительное фосфорилирование до конца. При интенсивном потреблении углеводов жировая ткань может превращать глюкозу (через пируват и ацетил-СоА) в жирные кислоты, жирные кислоты переводить в триацилглицерины и хранить их в виде больших жировых капель, хотя у человека синтез жиров происходит главным образом в гепатоцитах. Запасы триацилглицеринов в адипоцитах пополняются из печени (переносятся кровью в виде ЛПОНП; см. рис. 21-40, а) и из кишечного тракта (переносятся в хиломикронах), особенно после приема пищи, богатой жирами.
При уменьшении количества топливных молекул липазы в адипоцитах гидролизуют хранящиеся триацилглицерины до свободных жирных кислот, которые могут переносится кровотоком к скелетным мышцам и сердцу. Высвобождение жирных кислот из адипоцитов очень сильно ускоряется адреналином, который стимулирует сАМР-зависимое фосфорилирование перилипина; это дает триацилглицеринлипазе доступ к триацилглицеринам в липидных каплях. Липаза, чувствительная к адреналину, стимулируется также фосфорилированием, но это не главная причина увеличения липолиза (см. рис. 17-3). Инсулин уравновешивает действие адреналина, снижая активность липазы.
Распад и синтез триацилглицеринов в жировой ткани объединены в субстратный цикл; до 70% жирных кислот, высвобожденных триацилглицеринлипазой, вновь этерифицируются в адипоцитах, образуя триацилглицерины. Мы уже встречали такой субстратный цикл в гл. 15; он позволяет осуществлять хорошую регуляцию скорости и направления потока интермедиатов по этому пути в обе стороны. Глицерин, высвобождаемый триацилглицеринлипазой в жировой ткани, не может быть вновь использован в синтезе триацилглицеринов, так как в адипоцитах отсутствует фермент глицеринкиназа. Вместо этого необходимый для синтеза триацилглицеринов глицеринфосфат образуется из пирувата в ходе глицеронеогенеза с помощью цитозольного фермента ФЕП-карбоксикиназы (см. рис. 21-22).
Кроме функции запасания топливных молекул жировая ткань играет важную роль в качестве эндокринного органа, синтезируя и выделяя гормоны, передающие информацию о состоянии энергетических запасов и координирующие метаболизм жиров и углеводов во всем организме. Мы вернемся к этой функции жировой ткани позже, когда будем обсуждать гормональную регуляцию массы тела.
Термогенная функция бурой жировой ткани
У мелких позвоночных и впадающих в зимнюю спячку животных значительную долю жировой ткани составляет бурый жир; по сравнению с адипоцитами белого жира адипоциты бурого жира меньше по размеру (от 20 до 40 мкм) и имеют другую форму (многогранник, а не сфера). Как и клетки белой жировой ткани, адипоциты бурого жира запасают триглицерины, однако не в одной крупной капле жира, а в нескольких мелких жировых капельках (рис. 23-16, в). Клетки бурой жировой ткани содержат больше митохондрий и лучше снабжаются кровью, чем клетки белой жировой ткани. Цитохромы в митохондриях и гемоглобин в капиллярах придают бурой жировой ткани ее характерный цвет. Особенность адипоцитов бурой жировой ткани — в высоком уровне экспрессии гена UNC1, кодирующего термогенин — разобщающий митохондриальный белок (см. рис. 19-34). Именно с активностью термогенина связана основная функция клеток бурой жировой ткани — термогенез.
Жирные кислоты, запасенные в жировых капельках адипоцитов бурой жировой ткани, высвобождаются и проникают в митохондрии, где подвергаются полному превращению в СO2 в процессе β-окисления и в цикле лимонной кислоты. Образующиеся при этом восстановленные FADH2 и NADH передают электроны по дыхательной цепи на молекулярный кислород. В белой жировой ткани протоны, выкаченные из митохондрий в процессе передачи электронов, вновь проникают в матрикс с помощью ATP-синтазы, а энергия от передачи электронов запасается в форме АТР. Термогенин, присутствующий в бурой жировой ткани, создает другую возможность для возврата протонов в матрикс — без участия АТР-синтазы. В этом случае энергия протонного градиента рассеивается в виде тепла, что позволяет поддерживать оптимальную температуру тела (особенно нервной системы и внутренних органов) при понижении температуры окружающей среды.
У плода человека дифференцировка преадипоцитов (малодифференцированных фибробластов) в клетки бурой жировой ткани начинается на 20-й неделе беременности, а в момент рождения клетки бурой жировой ткани составляют 1% массы тела младенца. Отложения бурой жировой ткани образуются там, где выделяемое в процессе термогенеза тепло необходимо для поддержания функций жизненно важных тканей (магистральных сосудов головы, основных кровеносных сосудов брюшной полости, а также поджелудочной железы, надпочечников и почек), что существенно при попадании новорожденного в окружающую среду с более низкой температурой, чем была в организме матери (рис. 23-17).
Рис. 23-17. Распределение бурой жировой ткани в организме новорожденного. Бурая жировая ткань распределяется в организме новорожденного так, как показано здесь, ведь она защищает от охлаждения главные кровеносные сосуды и важные внутренние органы. Со временем бурая жировая ткань исчезает; в организме взрослых людей нет больших запасов бурых адипоцитов.

После рождения в организме младенца начинает развиваться белая жировая ткань, а бурая жировая ткань постепенно исчезает. В организме взрослого человека не встречается оформленных отложений бурой жировой ткани, а отдельные адипоциты бурой жировой ткани остаются вкрапленными в белую жировую ткань, составляя в общей сложности только ~1% всех адипоцитов организма. У взрослых, кроме того, имеются преадипоциты, которые могут превращаться в адипоциты бурой жировой ткани при длительной адаптации к холоду. У больных с феохромоцитомой (опухолью надпочечников) образуется повышенное количество адреналина и норадреналина, из-за этого, в частности, преадипоциты дифференцируют в адипоциты бурой жировой ткани, которая локализуется приблизительно так же, как в организме новорожденных. В адаптации к холоду и в нормальной дифференцировке клеток белой и бурой жировой ткани важную роль играет ядерный фактор транскрипции РРАRy, о котором будет сказано ниже.
Мышцы используют АТР для механической работы
В клетках скелетных мышц миоцитах метаболизм специализируется на выработке АТР как источника энергии для сокращения мышц. Более того, скелетные мышцы приспособлены для выполнения механической работы в различном режиме. При необходимости скелетная мышца может короткое время работать на своей максимальной мощности, например, при спринте на 100 м; а может выполнять и более продолжительную работу — бег на марафонскую дистанцию.
Существуют два вида мышечной ткани, которые различаются по своей физиологической роли и по энергетическому обмену. Медленно сокращающиеся мышечные волокна, так называемые красные мышцы, производят относительно слабое сокращение, но они долго не утомляются. Они образуют АТР с помощью медленного, но постоянного процесса окислительного фосфорилирования. Красные мышцы исключительно богаты митохондриями и обслуживаются очень плотной сетью кровеносных сосудов, которые приносят кислород, необходимый для синтеза АТР. Характерный красный цвет этой ткани придают цитохромы митохондрий и гемоглобин крови. Быстросокращающиеся мышечные волокна, или белые мышцы, содержат меньше митохондрий, чем красные мышцы, и в меньшей степени окружены кровеносными сосудами, но они могут развивать большее усилие и делать это намного быстрее. Белые мышцы быстрее устают, потому что во время активной работы они используют АТР быстрее, чем могут восстанавливать его запас. Соотношение красных и белых мышц у человека во многом индивидуально и генетически обусловлено; но путем тренировок выносливость быстросокращающихся мышц можно улучшить.
Скелетные мышцы в зависимости от мышечной активности могут использовать для получения энергии свободные жирные кислоты, кетоновые тела или глюкозу (рис. 23-18). В состоянии покоя преимущественно расходуются свободные жирные кислоты из жировой ткани и кетоновые тела из печени. Они окисляются и расщепляются с образованием ацетил-СоА, который поступает в цикл лимонной кислоты для окисления до СO2. Следующий переносчик электронов к O2 поставляет энергию для синтеза АТР при окислительном фосфорилировании. Мышцы средней активности наряду с жирными кислотами и кетоновыми телами используют глюкозу крови. Глюкоза фосфорилируется, затем расщепляется в ходе гликолиза до пирувата, который превращается в ацетил-СоА и окисляется в цикле лимонной кислоты и при окислительном фосфорилировании.
Рис. 23-18. Источники энергии для сокращения мышц. Во время пиковой физической нагрузки и при малой активности или в покое для синтеза АТР используются различные виды топлива. Фосфокреатин может быстро восстанавливать АТР.
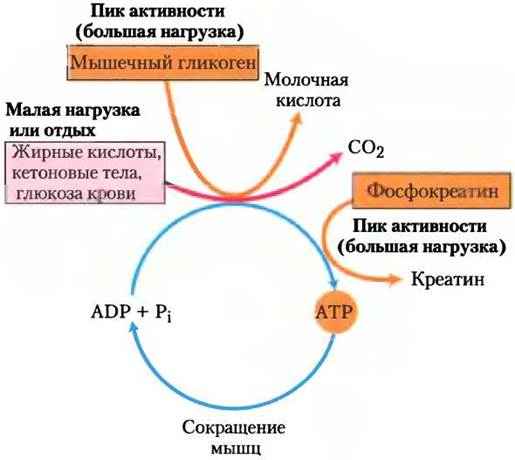
При максимальной активности быстрых скелетных мышцах их потребность в АТР так велика, что кровоток не справляется с быстрой доставкой О2 и энергетических субстратов. Снабжение необходимым количеством АТР происходит только с помощью аэробного дыхания. В этих условиях запасенный в мышцах гликоген расщепляется до лактата ферментативным путем (с. 69). Каждая единица глюкозы, расщепляясь, дает три молекулы АТР, а так как при фосфоролизе гликогена образуется глюкозо-6-фосфат (через глюкозо-1- фосфат), это позволяет экономить АТР, который обычно тратится в гексокиназной реакции. Ферментативный путь образования молочной кислоты отвечает на увеличение потребности мышц в АТР быстрее, чем окислительное фосфорилирование. Благодаря этому пути поддерживается необходимый уровень АТР, который получается при аэробном фосфорилировании других энергетических субстратов в цикле лимонной кислоты и дыхательной цепи. Использование глюкозы крови и мышечного гликогена как источников энергии для мышечной активности значительно увеличивается при секреции адреналина, который стимулирует высвобождение глюкозы из гликогена печени и расщепление гликогена в мышечной ткани.
Относительно малое содержание гликогена в организме (около 1% общей массы скелетных мышц) ограничивает количество энергии, которое может дать гликолиз во время самых больших физических нагрузок. Более того, накопление лактата и последующее падение pH в максимально активных мышцах снижает эффективность гликолиза. Но у скелетных мышц есть и другой источник АТР — фосфокреатин (10-30 мМ), который может быстро регенерировать АТР из ADP с помощью креатинкиназной реакции:

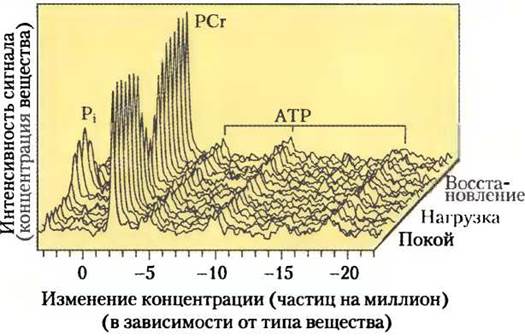
Во время активных сокращений и преобладания гликолиза эта реакция проходит преимущественно в направлении синтеза АТР; во время восстановления сил после нагрузки этот же фермент снова синтезирует фосфокреатин из креатина, расходуя АТР. Учитывая сравнительно высокий уровень АТР и фосфокреатина в мышцах, эти вещества можно детектировать в интактной мышечной ткани в реальном времени с помощью метода ЯМР-спектроскопии (рис. 23-19).
Рис. 23-19. Фосфокреатин позволяет поддерживать концентрацию АТР при физической нагрузке. ЯМР- спектр (31Р): пики соответствуют неорганическому фосфату (Рi), фосфокреатину (РСr) и АТР (каждая фосфатная группа которого дает свой сигнал). На спектре виден переход от состояния покоя к физической нагрузке и к последующему восстановлению. Обратите внимание, что сигнал АТР почти не изменяется при физической нагрузке, поддерживаясь на высоком уровне за счет дыхательной цепи и запаса фосфокреатина, количество которого снижается при нагрузке. Вовремя восстановления сил (отдыха), когда образование АТР в реакциях катаболизма выше его расхода мышцами, находящимися в состоянии покоя, запас фосфокреатина восполняется.
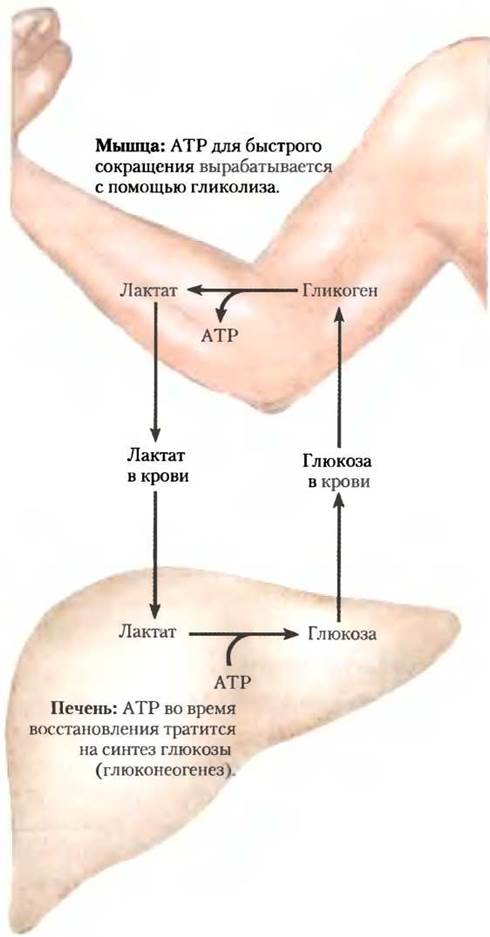
Чтобы увеличить количество кислорода воздуха, идущего на окислительное фосфорилирование в печени, необходимо продолжать усиленно дышать после интенсивной мышечной активности. Образованный АТР используется для глюконеогенеза из лактата, перенесенного кровью из мышц. Образованная глюкоза вновь возвращается в мышцы для пополнения запаса гликогена, замыкая цикл Кори (рис. 23-20; см. также доп. 15-4).
Рис. 23-20. Метаболическая взаимосвязь между скелетными мышцами и печенью. При пиковой активности мышцы используют в качестве источника энергии гликоген, образуя в процессе гликолиза лактат (молочную кислоту). Во время восстановления некоторое количество молочной кислоты переносится в печень и превращается в глюкозу в ходе глюконеогенеза. Глюкоза высвобождается в кровь и возвращается в мышцы для восстановления запасов гликогена в них. Весь путь глюкоза —> молочная кислота (лактат) —> глюкоза составляет цикл Кори.
При активном сокращении скелетных мышц выделяется тепло — побочный продукт неполного сопряжения химической энергии АТР и механической работы при сокращении мышц. При низкой температуре окружающей среды эта способность мышц выделять тепло может сослужить хорошую службу: скелетные мышцы осуществляют сократительный термогенез — быстро повторяющиеся мышечные сокращения (дрожь), что позволяет организму получать тепло практически без движения и помогает поддерживать температуру тела в норме, т. е. около 37 °С.
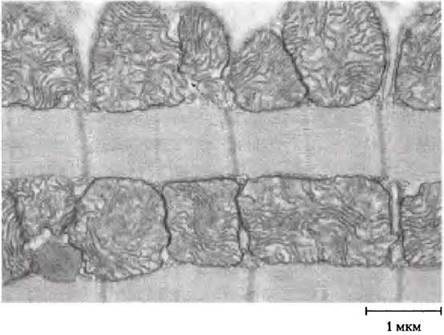
Сердечная мышца отличается от скелетной мышцы тем, что она активна долгое время в регулярном ритме сокращения-расслабления, ее метаболизм всегда только аэробный. В ней намного больше митохондрий, чем в скелетной мышце, — митохондрии составляют больше половины объема клетки (рис. 23-21). Сердце использует в качестве основного энергетического источника свободные жирные кислоты, но также и некоторое количество глюкозы и кетоновых тел, поставляемых кровью; эти энергетические источники для синтеза АТР окисляются в цикле лимонной кислоты и при окислительном фосфорилировании. Как и скелетная мышца, сердечная
мышца не запасает в больших количествах липиды или гликоген. Есть небольшие запасы доступной энергии в виде фосфокреатина, и этого достаточно для нескольких секунд сокращения. Сердце — аэробный орган, оно получает энергию при окислительном фосфорилировании, поэтому недостаток кислорода в определенном участке сердечной мышцы, возникающий, когда кровеносные сосуды блокированы липидными бляшками (при артеросклерозе) или кровяными сгустками (при коронарном тромбозе), может вызывать смерть этого участка сердечной мышцы. Так происходит при инфаркте миокарда (часто говорят о разрыве сердца). ■
Рис. 23-21. Электронная микрофотография сердечной мышцы. В тканях сердца для синтеза АТР в огромном количестве митохондрий окисляются пируват, жирные кислоты и кетоновые тела. Постоянный аэробный метаболизм позволяет человеческому сердцу качать кровь со скоростью ~6 л/мин или -350 л/ч, т. е. за 70 лет сердце перекачивает 200 • 106 л.
Мозг использует энергию для передачи электрических импульсов
В мозге обмен веществ имеет характерные особенности. Нейроны головного мозга взрослого млекопитающего в норме используют в качестве источника энергии только глюкозу (рис. 23-22). (Астроциты, другой главный тип клеток мозга, могут окислять жирные кислоты.) Мозг обладает очень активным дыхательным метаболизмом (рис. 23-23); он использует кислород с довольно постоянной скоростью и потребляет почти 20% общего количества O2, необходимого организму в покое. Поскольку содержание гликогена в мозге очень мало, мозг постоянно зависит от поступления глюкозы из крови. Если содержание глюкозы в крови уменьшается значительно ниже критического уровня даже на короткое время, в работе мозга могут произойти очень существенные и иногда необратимые изменения.
Рис. 23-22. Источники топлива, поставляющие АТР в мозг. Источник энергии, который использует головной мозг, зависит от характера питания. Кетоновые тела, используемые во время голодания, представляют собой β-гидроксибутират. Электрогенный транспорт, осуществляемый Nа+/К+-АТРазой, поддерживает трансмембранный потенциал, необходимый для передачи информации между нейронами.
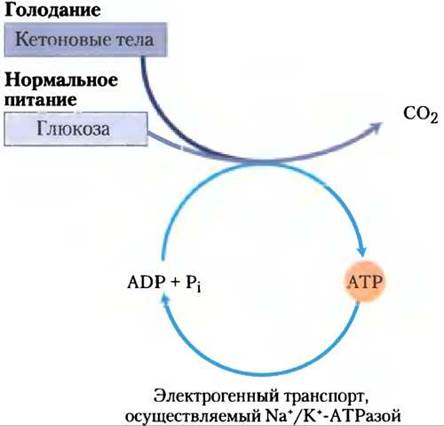
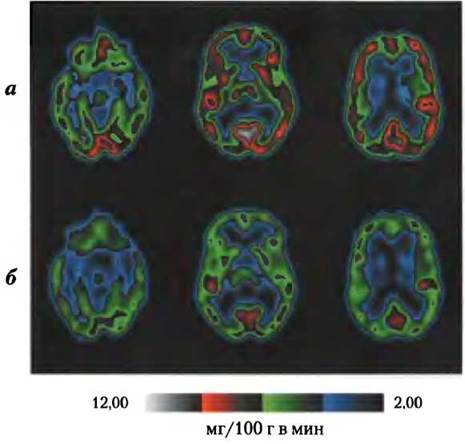
Рис. 23-23. Метаболизм глюкозы в головном мозге. Метаболическая активность специфических зон мозга показана с помощью метода сканирующей позитронной эмиссионной томографии (ПЭТ). Результаты исследования ПЭТ позволяют увидеть в реальном времени меченную изотопами глюкозу в точно локализованных зонах мозга живого человека. Меченый аналог глюкозы 2-[18F]-фтор- 2-дезокси-D-глкжоза вводят в кровяное русло; через несколько секунд ПЭТ-сканер показывает, какое количество глюкозы поглощено каждой зоной мозга — это позволяет измерить метаболическую активность. Здесь представлены результаты ПЭТ переднезадних срезов мозга на трех уровнях, верх (слева) — низ (справа). Сравнивается метаболизм глюкозы (в мг на 100 г/мин), когда обследуемый отдыхает (а) и лишен сна в течение 48 ч (б).
Хотя нейроны мозга не могут использовать непосредственно из крови свободные жирные кислоты как источник энергии, когда необходимо, они могут использовать β-гидроксибутират (кетоновое тело), который образуется из жирных кислот в печени. Способность мозга окислять β-гидроксибутират через ацетил-СоА приобретает большое значение во время продолжительного голодания или полного истощения, т. е. после того как гликоген печени истрачен; в этих условиях мозг может использовать как источник энергии запас жиров. Во время сильного истощения единственным источником глюкозы для мозга становятся запасные мышечные белки (благодаря глюконеогенезу в печени).
Нейроны окисляют глюкозу в цикле лимонной кислоты, и благодаря потоку электронов от окисления через дыхательную цепь образуется почти весь АТР, используемый этими клетками. Энергия необходима для создания и поддержания электрического потенциала на плазматической мембране нейронов. Мембрана содержит электрогенный ATP-зависимый антипортер Nа+/К+-АТРазу, которая одновременно перекачивает 2 иона К+ внутрь и 3 иона Na+ наружу нейрона (см. рис. 11-37 в т. 1). Возникающий трансмембранный потенциал меняется, по мере того как электрический сигнал (потенциал действия) проходит от одного конца нейрона к другому (см. рис. 12-25 вт. 1). Потенциал действия — основной механизм передачи информации в нервной системе, поэтому истощение запаса АТР в нейронах подавляет все активности, координируемые нейрональной сигнализацией.
Переносчики кислорода, метаболиты и гормоны крови
Кровь опосредует метаболические взаимодействия всех тканей. Она транспортирует питательные вещества от тонкого кишечника к печени и от печени и жировой ткани к другим органам; она же переносит выделяемые продукты из тканей к почкам. Кислород переносится кровотоком от легких к тканям, а СO2 возвращается кровотоком из тканей в легкие для выдыхания. Кровь передает гормональные сигналы от одной ткани к другой. В этой роли передатчика сигнала кровеносная система напоминает нервную систему — обе регулируют и интегрируют активности разных органов.
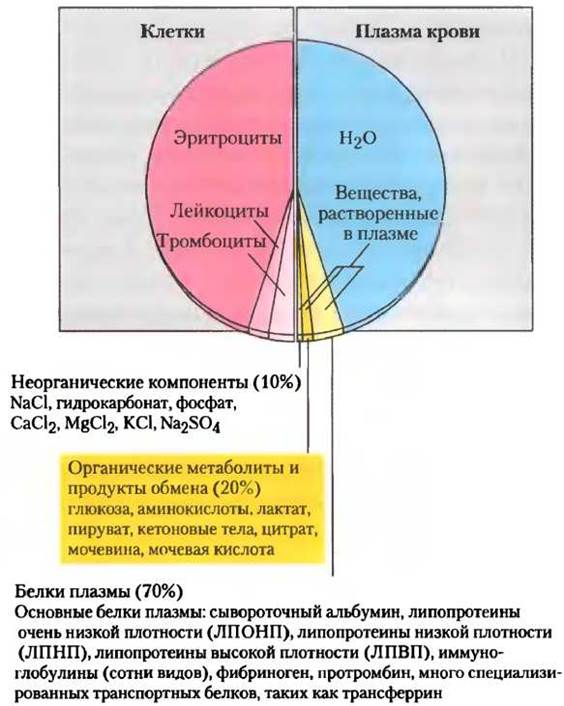
В организме взрослого человека в среднем 5-6 л крови. Почти половину объема крови приходится на клетки трех типов (рис. 23-24): эритроциты (красные кровяные клетки), содержащие гемоглобин и специализирующиеся на переносе кислорода и СO2; намного меньше в крови лейкоцитов (белых кровяных клеток) разных типов (включая лимфоциты) — основных клеток иммунной системы, защищающих организм от инфекций; и тромбоциты, которые помогают осуществлять свертывание крови. Жидкая часть крови — это плазма крови, которая на 90% состоит из воды и лишь 10% в ней солей. В плазме растворено или суспендировано большое разнообразие белков, липопротеинов, питательных веществ, метаболитов, продуктов выделения, неорганических ионов и гормонов. Более 70% твердых компонентов плазмы — это белки плазмы, преимущественно иммуноглобулины (циркулирующие антитела), сывороточный альбумин, аполипопротеины, участвующие в транспорте липидов, трансферрин (переносит железо) и белки свертывания крови, такие как фибриноген и протромбин.
Рис. 23-24. Состав крови. Цельную кровь с помощью центрифугирования можно разделить на плазму крови и клетки. Около 10% плазмы крови — это растворенные вещества, из которых 10% составляют неорганические соли, 20% — малые органические молекулы и 70% — белки плазмы. Приведены основные растворимые компоненты. Кровь содержит много других веществ, часто в следовых количествах, в том числе другие метаболиты, ферменты, гормоны, витамины, микроэлементы и желчные пигменты. Измерения концентраций компонентов плазмы крови важно для диагностики и лечения многих болезней.
Растворенные в плазме крови небольшие ионы и молекулы — непостоянные ее компоненты; они непрерывно циркулируют между кровью и различными тканями. Количество поступающих с пищей неорганических ионов Na+, К+ и Са2+ (главных электролитов крови и цитоплазмы) уравновешивается их выведением с мочой. Для многих компонентов крови достигается подобие динамического равновесия: концентрация компонентов меняется мало, хотя между пищеварительным трактом, кровью и мочой происходит постоянный обмен. Содержание ионов Na+, К+ и Са2+ в плазме остаются почти постоянным и составляет 140, 5 и 2,5 мМ соответственно; при поступление с пищей содержание этих электролитов в крови меняется незначительно. Заметные отклонения от этих показателей — симптомы серьезных заболеваний (иногда с летальным исходом). В поддержании ионного баланса исключительно важную роль играют почки, они селективно отфильтровывают продукты распада и избыток ионов из крови и в то же время предотвращают потерю необходимых питательных веществ и ионов.
В ходе дифференцировки эритроциты человека утрачивают ядро и митохондрии, поэтому для синтеза АТР могут использовать только гликолиз. Получающийся в результате гликолиза лактат возвращается в печень, где путем глюконеогенеза превращается в глюкозу и запасается в виде гликогена или поступает в периферические ткани. Эритроцитам постоянно доступна глюкоза крови.
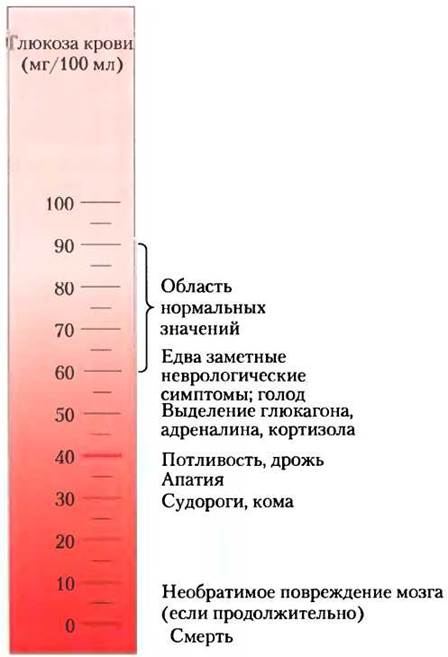
Концентрация глюкозы в плазме жестко регулируется. Мозг постоянно потребляет глюкозу, а печень поддерживает нормальный уровень глюкозы крови: 60-90 мг/100 мл цельной крови (~4,5 мМ). (Поскольку эритроциты составляют значительную долю всего объема крови, после их удаления с помощью центрифугирования остается жидкий супернатант — плазма, содержащая «глюкозу крови» в меньшем объеме. Для перехода к концентрации глюкозы в плазме концентрацию глюкозы крови надо умножить на 1,14.) Когда уровень глюкозы крови падает до 40 мг/100 мл (гипогликемия), человек испытывает дискомфорт и спутанность сознания (рис. 23-25); дальнейшее уменьшение этого показателя вызывает кому, судороги, а при сильной гипогликемии наступает смерть. Поддержание нормальной концентрации глюкозы крови, таким образом, высокоприоритетно для организма, и для этого существуют различные регуляторные механизмы. Среди наиболее важных регуляторов уровня глюкозы крови — гормоны инсулин, глюкагон и адреналин (см. разд. 23.3). ■
Рис. 23-25. Физиологические последствия низкого уровня глюкозы крови у человека. Уровни глюкозы крови 40 мг/100 мл и ниже означают сильную гипогликемию.
Краткое содержание раздела 23.2 Тканеспецифичный метаболизм: разделение функций
■ У млекопитающих метаболические функции выполняют специализированные ткани и органы. Печень — центральный орган, распределяющий и обрабатывающий питательные вещества. Сахара и аминокислоты, образующиеся при переваривании пищи, проходят через кишечный эпителий в кровь, которая переносит их в печень. Некоторые триациаглицерины из расщепленных липидов также направляются в печень, где их жирные кислоты используются в различных процессах.
■ Глюкозо-6-фосфат — ключевой интермедиат углеводного метаболизма. Он может быть полимеризован в гликоген, дефосфорилирован в глюкозу крови или превращен в жирные кислоты через ацетил-СоА. Он может подвергаться окислению в гликолизе, в цикле лимонной кислоты и в дыхательной цепи с образованием АТР или поступать в пентозофосфатный путь для образования пентоз и NADPH.
■ Аминокислоты используются для синтеза белков печени и плазмы крови или же их углеродный скелет превращается в глюкозу и в гликоген путем гликонеогенеза; аммиак, образуемый при дезаминировании, превращается в мочевину.
■ Печень превращает жирные кислоты в триацилглицерины, фосфолипиды или в холестерин и эфиры холестерина — для транспорта липопротеинов кровотоком в жировую ткань для хранения. Жирные кислоты также могут быть окислены с образованием АТР или кетоновых тел, которые кровоток переносит к другим тканям.
■ В белой жировой ткани хранятся большие запасы триглицеринов, которые высвобождаются в кровь в ответ на сигнал — адреналин или глюкагон. Специфической функцией бурой жировой ткани является термогенез в результате окисления жирных кислот в разобщенных митохондриях.
■ Скелетные мышцы высокоспециализированы для образования и использования АТР при механической работе. При напряженной мышечной активности единственным источником энергии служит гликоген, обеспечивающий образование АТР с помощью ферментативных превращений до молочной кислоты. В период отдыха молочная кислота опять превращается в печени (путем глюконеогенеза) в гликоген и глюкозу. Во время активного сокращения промежуточным источником АТР выступает фосфокреатин.
■ Сердечная мышца получает почти весь необходимый АТР в результате окислительного фосфорилирования.
■ Нейроны мозга в качестве источника энергии используют только глюкозу и β-гидроксибутират, при голодании или истощении роль последнего становится самой важной. Почти весь свой АТР мозг использует для активного транспорта Na+ и К+ с целью поддержания мембранного потенциала нейронов.
■ Кровь переносит питательные вещества и продукты обмена, а также передает гормональные сигналы между органами.