ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
23. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ И ИНТЕГРАЦИЯ МЕТАБОЛИЗМА МЛЕКОПИТАЮЩИ
23.3. Гормональная регуляция энергетического метаболизма
Регуляция, поддерживающая концентрацию глюкозы крови на уровне -4,5 мМ, происходит с помощью постоянного комбинированного воздействия инсулина, глюкагона, адреналина и кортизола на метаболические процессы во многих тканях тела, но особенно в печени, в мышцах и в жировой ткани. Инсулин дает сигнал этим тканям, что уровень глюкозы крови выше необходимого; в результате клетки забирают избыток глюкозы из крови и превращают его в запас гликогена и триацилглицеринов. Глюкагон сигнализирует, что уровень глюкозы в крови слишком низкий, — в ответ ткани начинают получать глюкозу из гликогена, расщепляя гликоген, и путем глюконеогенеза (в печени), а также путем окисления жиров, чтобы снизить использование глюкозы.
Адреналин выделяется в кровь для подготовки мышц, легких и сердца к резкому повышению активности. Кортизол опосредует ответ организма на продолжительный стресс. Обсудим эти схемы гормональной регуляции в трех метаболических состояниях — у хорошо питающегося человека, человека, временно воздерживающегося от приема пищи, и человека, длительно голодающего, и поговорим о последствиях для метаболизма такого заболевания, как сахарный диабет, возникающего в результате нарушения контролирующих метаболизм глюкозы сигнальных путей.
Инсулин препятствует чрезмерному повышению уровня глюкозы крови
Действуя через рецепторы плазматической мембраны (см. рис. 12-15 и 12-16 в т. 1), инсулин стимулирует захват глюкозы мышечной и жировой тканями (табл. 23-3), где глюкоза превращается в глюкозо-6-фосфат. В печени инсулин активирует гликогенсинтазу и инактивирует гликогенфосфорилазу, так что основное количество глюкозо- 6-фосфата переходит в гликоген.
Таблица 23-3. Влияние инсулина на уровень глюкозы крови: потребление глюкозы клетками и хранение в виде триацилглицеринов и гликогена
Метаболический эффект |
Фермент-мишень |
↑ Потребление глюкозы (мышцы, жировая ткань) |
↑ Транспортер глюкозы (GLUT4) |
↑ Потребление глюкозы (печень) |
↑ Глюкокиназа (усиление экспрессии) |
↑ Синтез гликогена (печень, мышцы) |
↑ Гликогенсинтаза |
↑ Расщепление гликогена (печень, мышцы) |
↑ Гликогенфосфорилаза |
↑ Гликолиз, образование ацетил-СоА (печень, мышцы) |
↑ РFК-1 (с помощью ↑ РFK-2) ↑ Пируватдегидрогеназный комплекс |
↑ Синтез жирных кислот (печень) |
↑ Ацетил-СоА-карбоксилаза |
↑ Синтез триацилглицеринов (жировая ткань) |
↑ Липопротеинлипаза |
В жировой ткани инсулин стимулирует запасание избытка таких энергетически богатых веществ, как жиры (рис. 23-26). В печени он активирует окисление глюкозо-6-фосфата до пирувата в ходе гликолиза и окисление пирувата до ацетил-СоА. Если ацетил-СоА не окисляется далее для получения энергии, он используется для синтеза жирных кислот в печени, а жирные кислоты в виде триацилглицеринов экспортируются липопротеинами (ЛПОНП) плазмы крови в жировую ткань. В адипоцитах инсулин стимулирует синтез триацилглицеринов из жирных кислот, высвобождаемых из триацилглицеринов фракции ЛПОНП. Эти жирные кислоты вырабатываются только из избытка глюкозы, который поступает из крови в печень. Таким образом, действие инсулина направлено в основном на превращение избытка глюкозы крови в формы для ее хранения: гликоген (в печени и мышцах) и триацилглицерины (в жировой ткани) (табл. 23-3).
Рис. 23-26. При усиленном питании в печени синтезируются жиры. Сразу после потребления высококалорийной пищи в печень направляются глюкоза, жирные кислоты и аминокислоты. Инсулин, выделяющийся в ответ на повышение концентрации глюкозы в крови, стимулирует поглощение глюкозы тканями. Некоторое количество глюкозы отправляется для обеспечения питания мозга, а часть — к адипоцитам и мышечной ткани. В печени оставшая глюкоза окисляется до ацетил-СоА, который идет на синтез жирных кислот, для экспорта ЛПОНП в виде триацилглицеринов в адипоциты и мышечную ткань. Необходимый для синтеза липидов NADРН образуется при окислении глюкозы по пентозофосфатному пути. Избыток аминокислот превращается в пируват и ацетил-СоА, которые также используются в синтезе липидов. Жиры пищи в виде хиломикронов транспортируются лимфой от кишечника к мышечной и жировой тканям.
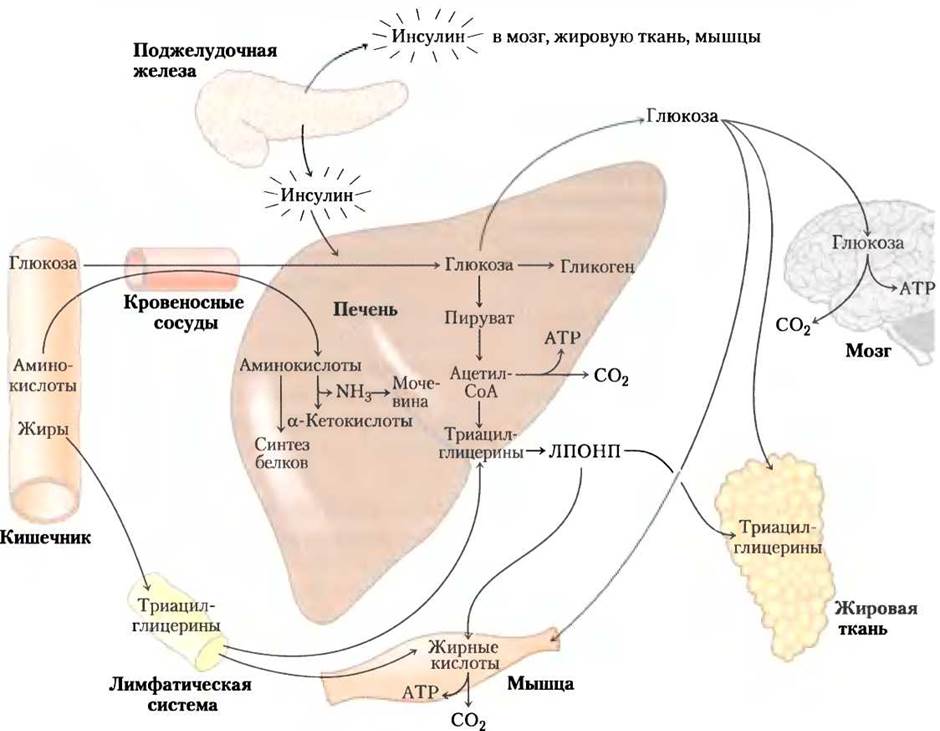
Кроме прямого влияния на мышцы и печень, изменяющего метаболизм углеводов и жиров, инсулин также воздействует на головной мозг, посылая через него опосредованный сигнал этим тканям (см. далее).
Поджелудочная железа секретирует инсулин или глюкагон в ответ на изменения уровня глюкозы крови
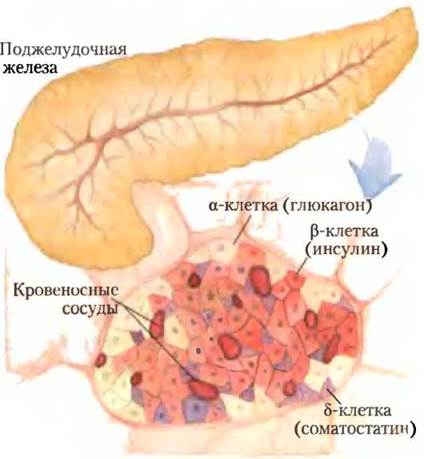
Когда после приема богатой углеводами пищи глюкоза попадает из кишечника в кровоток, происходит увеличение секреции инсулина (и уменьшение секреции глюкагона). Инсулин, секретируемый поджелудочной железой, в основном регулируется уровнем глюкозы крови, снабжающей поджелудочную железу. Пептидные гормоны инсулин, глюкагон и соматостатин вырабатываются кластерами специализированных клеток поджелудочной железы — островками Лангерганса (рис. 23-27). Каждый тип клеток в островках продуцирует определенный гормон: α-клетки — глюкагон; β-клетки — инсулин; δ-клетки — соматостатин.
Рис. 23-27. Эндокринные клетки поджелудочной железы. В поджелудочной железе присутствуют и экзокринные клетки (рис. 18-3, б), которые секретируют пищеварительные ферменты зимогены, и кластеры эндокринных клеток — островки Лангерганса. Островки содержат α-, β- и δ-клетки (также известные как А-, В- и D-клетки соответственно), каждый тип клеток секретирует специфический полипептидный гормон.
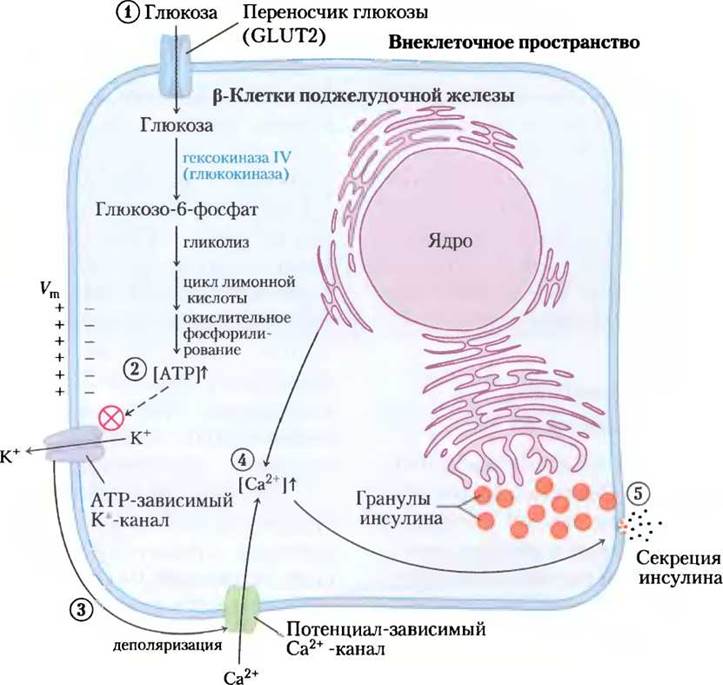
Как показано на рис. 23-28, при увеличении уровня глюкозы крови (1) GLUТ2-транспортеры переносят глюкозу в β-клетки, где она с помощью гексокиназы IV (глюкокиназы) немедленно превращается в глюкозо-6-фосфат и вступает в гликолиз (рис. 23-25). С повышением скорости распада глюкозы (2) увеличивается концентрация АТР, вызывая закрывание ATP-зависимых К+- каналов в плазматической мембране. (3) Снижение потока К+ деполяризует мембрану. (Вспомните, что выход ионов К+ из открытых калиевых каналов гиперполяризует мембрану, а закрывание К+-каналов эффективно деполяризует мембрану; см. разд. 12.6, т. 1). Деполяризация мембраны вызывает открывание потенциал-чувствительных Са2+-каналов, и (4) как следствие увеличение концентрации ионов кальция, (5) что инициирует высвобождение инсулина путем экзоцитоза. На секрецию инсулина также влияют сигналы парасимпатической и симпатической нервной системы (стимулирующие и ингибирующие соответственно). Ограничивает секрецию гормона в кровь простая петля обратной связи: инсулин снижает уровень глюкозы крови, стимулируя поглощение глюкозы тканями; снижение глюкозы крови детектируется β-клетками как уменьшенный поток веществ через гексокиназную реакцию; это замедляет или останавливает секрецию инсулина. Такая регуляция по типу обратной связи поддерживает концентрацию глюкозы крови примерно постоянной, несмотря на значительные колебания ее поступления с пищей.
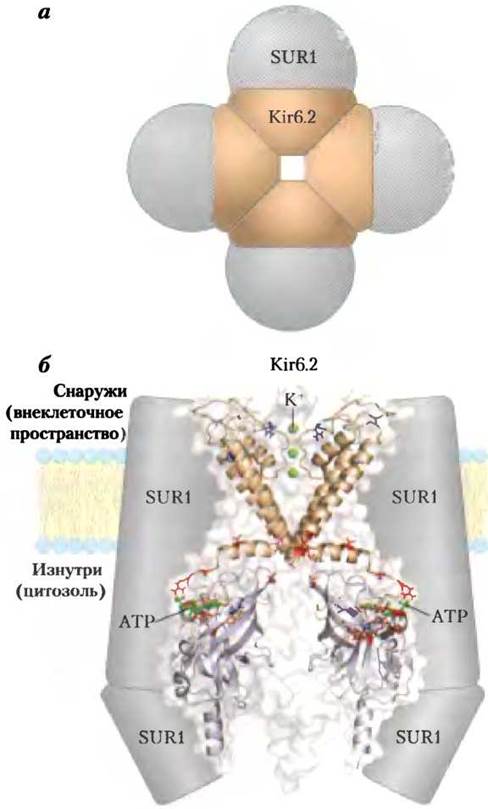
Действие ATP-зависимых калиевых каналов играет ключевую роль в регуляции секреции инсулина β-клетками. Эти каналы построены из восьми субъединиц: четырех идентичных субъединиц Kir6.2 и четырех идентичных субъединиц SUR1I; они устроены приблизительно так же, как и калиевые каналы бактерий и других эукариотических клеток (см. рис. 11-48, 11-49 и 11-50 в т. 1). Четыре субъединицы Kir6.2 образуют конус вокруг калиевого канала и выступают в роли селективного фильтра, действие которого связано с концентрацией АТР (рис. 23-29). При повышении концентрации АТР (что соответствует повышению уровня глюкозы крови) К+-каналы закрываются, это приводит к деполяризации плазматической мембраны и секреции инсулина, как показано на рис. 23-28.
Рис. 23-28. Регуляция секреции инсулина β-клетками поджелудочной железы уровнем глюкозы. При высоком уровне глюкозы крови активный метаболизм глюкозы в β-клетках увеличивает внутриклеточную концентрацию АТР, что приводит к закрыванию К+-каналов в плазматической мембране и тем самым к деполяризации мембраны. В ответ на изменение мембранного потенциала потенциал-зависимые Са2+-каналы плазматической мембраны открываются, позволяя Са2+ проходить в клетку и таким образом повышая концентрацию Са2+ в цитоплазме до тех пор, пока не будет инициировано высвобождение инсулина путем экзоцитоза. (Кроме того, Са2+ высвобождается из эндоплазматического ретикулума в ответ на исходное увеличение концентрации Са2+ в цитозоле.) После этого уровень ионов Са2+ в цитозоле становится достаточным, чтобы вызвать высвобождение инсулина путем экзоцитоза. Процессы, обозначенные цифрами, обсуждаются в тексте.
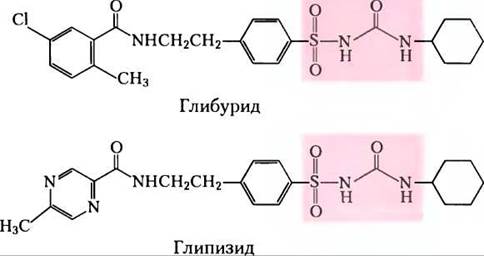
Лекарственные препараты, относящиеся к группе производных сульфонилмочевины и применяемые перорально для лечения сахарного диабета II типа, связываются с субъединицами SUR1 {sulfonylurea receptor) калиевых каналов, закрывая их и стимулируя высвобождение инсулина. Препараты первого поколения (например, толбутамид) появились в 1950-х гг. Препараты второго поколения, включая глибурид (Микроназ), глипизид (Глюкотрол) и глимепирид (Амарил), оказались более мощными и более безопасными. В структуре препаратов остаток сульфонилмочевины выделен розовым цветом. Иногда препараты этой группы используют в сочетании с инъекциями инсулина, однако часто их одних достаточно для контроля заболевания.
К счастью, мутации белков АТР-зависимых калиевых каналов в β- клетках встречаются редко. Мутации белка Kir6.2, приводящие к тому, что калиевые каналы постоянно открыты (красные аминокислотные остатки на рис. 23-29, б), вызывают неонатальный сахарный диабет новорожденных; это заболевание сопровождается тяжелой формой гипергликемии и требует лечения инсулином. Другие мутации Kir6.2 или SUR1 (синие остатки на рис. 23-19, б) приводят к постоянно закрытому состоянию К+-каналов и постоянной выработке инсулина. Если таких больных не лечить, у них разовьется гиперинсулинемия (гипогликемическая болезнь). Избыток инсулина приводит к тяжелой гипогликемии (пониженному содержанию глюкозы в крови), что может вызвать необратимое поражение головного мозга. Одним из эффективных способов лечения является хирургическое удаление части поджелудочной железы, что позволяет снизить выработку инсулина. ■
Рис. 23-29. АТР-зависимые калиевые каналы в β-клетках. а — октамерная структура канала (вид в перпендикулярном к клеточной мембране направлении). Канал образован четырьмя идентичными субъединицами Kir6.2 и четырьмя идентичными внешними субъединицами SUR1 (рецепторы сульфонилмочевины). б — структура субъединиц Kir6.2 (вид в плоскости мембраны). Для простоты представлены лишь два трансмембранных домена и два цитозольных домена. В области селективного фильтра изображены три иона калия (зеленые). Мутации некоторых аминокислотных остатков (красные) приводят к развитию неонатального сахарного диабета; мутации других аминокислот (синие) — причина гипогликемии у детей. Эта структура (любезно предоставленная Франс Эшфорд с коллегами из Оксфордского университета) была получена непрямым кристаллографическим методом, а с помощью наложения известной последовательности Kir6.2 на кристаллическую структуру бактериального канала Kir (KirBac1.1; PDB ID 1P7B), а также N- и С-концевых доменов другого белка — Kir3.1 (PDB ID 1U4E). Сравните эту структуру с регулируемым калиевым каналом, изображенным на рис. 11-50 в т. 1.
Глюкагон препятствует чрезмерному понижению уровня глюкозы крови
Через несколько часов после поступления углеводов пищи уровень глюкозы крови немного снижается из-за окисления глюкозы в мозге и других органах и тканях. Низкий уровень глюкозы крови индуцирует секрецию глюкагона и уменьшает выделение инсулина (рис. 23-30).
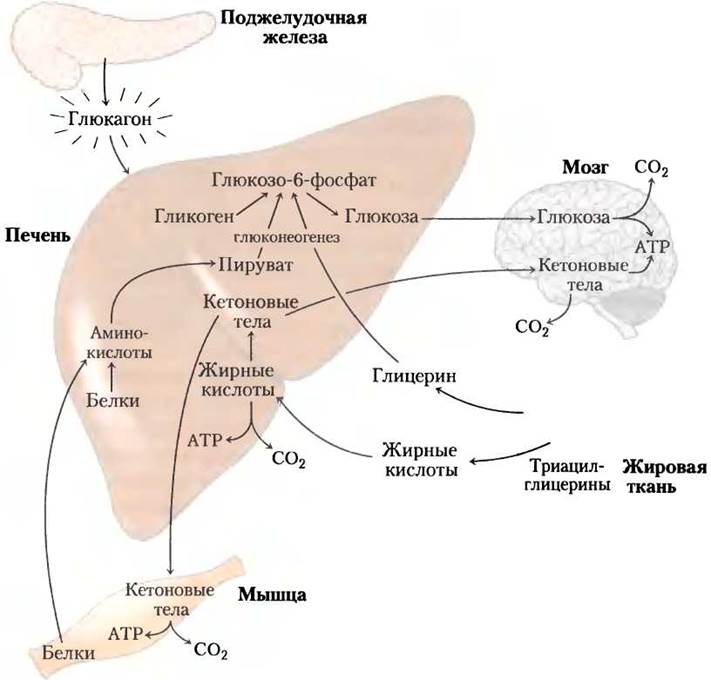
Рис. 23-30. Состояние голода: печень образует глюкозу. После нескольких часов без поступления пищи основным источником энергии для мозга становится печень. Гликоген печени расщепляется, и образованный глюкозо-1-фосфат превращается в глюкозо-6-фосфат, затем в свободную глюкозу, которая высвобождается в кровоток. Аминокислоты из расщепленных белков и глицерин, полученный при разрушении триацилглицеринов в жировой ткани, используются для глюконеогенеза. Жирные кислоты служат в печени основным видом топлива, а избыток ацетил-СоА превращается в кетоновые тела, которые экспортируются в другие ткани для получения энергии; когда глюкозы запасено мало, мозг особенно зависит от этого источника энергии (см. рис. 23-22).
Существует несколько способов повышения концентрации глюкозы в крови за счет глюкагона (табл. 23-4). Как и адреналин, он стимулирует только распад гликогена печени, активируя гликогенфосфорилазу и инактивируя гликогенсинтазу; оба эффекта возникают в результате фосфорилирования регулируемых глюкагоном ферментов, которые активируются сАМР. Глюкагон ингибирует расщепление глюкозы с помощью гликолиза в печени и стимулирует синтез глюкозы в глюконеогенезе. Это влияние обусловлено снижением концентрации фруктозо-2,6-бисфосфата, аллостерического ингибитора фермента глюко- неогенеза 1,6-бисфосфатазы (FВРаза-1) и активатора фосфофруктокиназы-1. Концентрация фруктозо-2,6-бисфосфата контролируется только сАМР-зависимой протеинфосфатазной реакцией (см. рис. 15-17). Кроме того, глюкагон ингибирует гликолитический фермент пируваткиназу (стимулируя его сАМР-зависимое фосфорилирование), таким образом блокируя превращение фосфоенолпирувата в пируват и предупреждая окисление пирувата в цикле лимонной кислоты. В итоге, накопление фосфоенолпирувата усиливает глюконеогенез. Это воздействие глюкагона дополняется тем, что он стимулирует синтез фермента глюконеогенеза ФЕП-карбоксикиназы. Способствуя расщеплению гликогена, которое предотвращает гликолиз и усиливает глюконеогенез в гепатоцитах, глюкагон облегчает для печени экспорт глюкозы и поддерживает уровень глюкозы крови в пределах нормы.
Таблица 23-4. Влияние глюкагона на уровень глюкозы крови: образование и высвобождение глюкозы в печени

Хотя первая мишень глюкагона — это печень, но он (как и адреналин) также действует и на жировую ткань, активируя распад триацилглицери- нов путем сАМР-зависимого фосфорилирования перилипина и гормончувствительной липазы. Активированная липаза высвобождает свободные жирные кислоты, которые переносятся в печень и другие ткани в качестве источников энергии, экономя глюкозу для мозга. Собственно, эффект глюкагона — это стимуляция синтеза глюкозы и ее высвобождение печенью, а также мобилизация жирных кислот из жировой ткани, чтобы они были использованы как энергоносители для других тканей, в том числе для мозга (табл. 23-4). Все эти действия глюкагона опосредуются сАМР- зависимым фосфорилированием белков.
Во время голодания и при истощении метаболизм переключается на обеспечение энергией мозга
У здорового человека можно выделить три типа запасенной энергии: (1) гликоген в печени и относительно малые количества — в мышцах; (2) большие количества триацилглицеринов в жировой ткани; (3) белки тканей, которые расщепляются, когда необходимо снабдить организм топливом в отсутствие других источников (табл. 23-5).
Таблица 23-5. Доступное метаболическое топливо в организме человека с нормальной массой тела (70 кг) и у человека с ожирением (140 кг) в начале голодания
Топливные молекулы |
Масса(кг) |
Энергетический эквивалент, ккал (кДж) |
Приблизительное время выживания, мес.* |
Человек с нормальной массой тела, 70 кг |
|||
Триацилглицерины (жировая ткань) |
15 |
141(589) |
|
Белки (преимущественно мышцы) |
6 |
24(100) |
|
Гликоген (мышцы, печень) |
0.225 |
0.90 (3.8) |
|
Вещества, циркулирующие в крови (глюкоза, жирные кислоты, триацилглицерины и др.) |
0,023 |
0,10(0,42) |
|
Итого |
166 (694) |
3 |
|
Человек с ожирением, 140 кг |
|||
Триацилглицерины (жировая ткань) |
80 |
752 (3,140) |
|
Белки (преимущественно мышцы) |
8 |
32(134) |
|
Гликоген (мышцы, печень) |
0,23 |
0,92 (3,8) |
|
Вещества, циркулирующие в крови |
0,025 |
0,11(0,46) |
|
Итого |
785 (3280) |
14 |
|
* Время выживания подсчитано на основании предположения о том, что минимальные необходимые затраты энергии составляют 1800 ккал/сут.
Через несколько часов после приема пищи уровень глюкозы крови немного уменьшается, и ткани получают глюкозу, высвобождаемую из гликогена печени. Синтез липидов происходит очень ослабленно или вообще отсутствует. При голодании через 24 ч после приема пищи уровень глюкозы крови падает еще ниже, секреция инсулина замедляется, а секреция глюкагона увеличивается. Эти гормональные сигналы мобилизуют триацилглицерины, которые становятся преобладающим источником энергии для мышц и печени. Ответы на продолжительное голодание представлены на рис. 23-31. (1) Для обеспечения мозга глюкозой печень расщепляет те белки, которые имеют наименее короткий срок существования в организме, и могут быть без вреда разрушены в организме, не получающем питания. Их незаменимые аминокислоты трансаминируются или дезаминируются (гл. 18), и (2) аминогруппы превращаются в мочевину, которая переносится кровотоком в почки и выводится.
Кроме того, в печени трехуглеродный скелет аминокислот, участвующих в образовании глюкозы, превращается в пируват или интермедиаты цикла лимонной кислоты. (3) Интермедиаты (такие как глицерин, образующийся в жировой ткани из триацилглицеринов) обеспечивают стартовый материал для глюконеогенеза в печени, (4) поставляя глюкозу мозгу. (5) Жирные кислоты окисляются до ацетил-СоА, но из-за расходования в глюконеогенезе интермедиатов цикла лимонной кислоты запасы оксалоацетата истощаются, (6) ингибируя вхождение в цикл ацетил-СоА, и ацетил- СоА накапливается. Ацетил-СоА, получающийся при окислении жирной кислоты, теперь преимущественно накапливается. (7) Это способствует образованию из ацетил-СоА ацетоацетил-СоА и кетоновых тел. После нескольких дней голодания концентрация кетоновых тел в крови увеличивается (рис. 23-32), так как эти энергетические субстраты экспортируются из печени в сердце, скелетные мышцы и мозг, которые используют их вместо глюкозы (рис. 23-31, (8)).
Рис. 23-31. Метаболизм топливных молекул в печени при длительном голодании или при неконтролируемом сахарном диабете. После исчерпания запасов углеводов важным источником глюкозы становятся белки; глюкоза образуется из глюкогенных аминокислот в процессе глюконеогенеза ((1)-(4)). Жирные кислоты, поступающие из жировой ткани, превращаются в кетоновые тела и направляются в головной мозг ((5)-(8)). Пунктирными стрелками показаны те реакции, которые в этих условиях ослабевают. Стадии процесса обсуждаются далее в тексте.
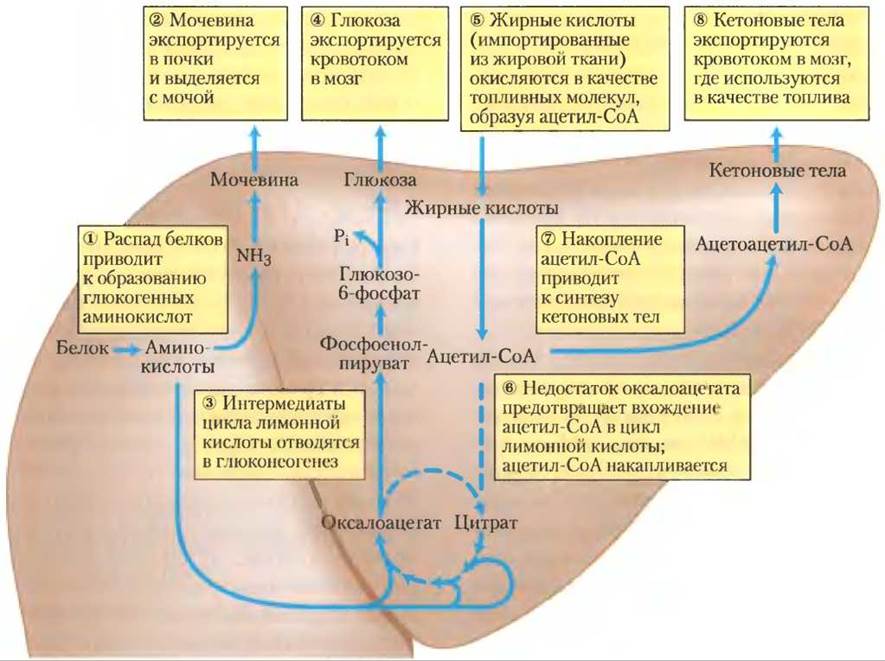
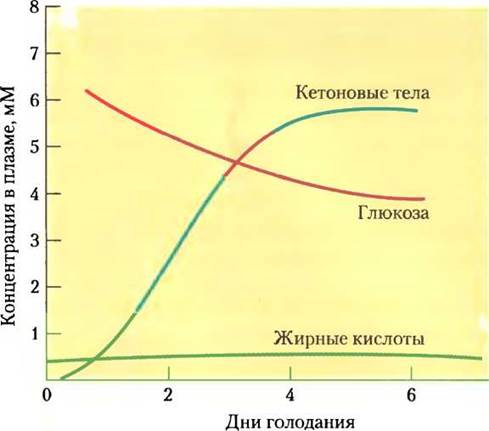
Рис. 23-32. Концентрации жирных кислот, глюкозы и кетоновых тел в плазме крови во время первой недели голодания. Несмотря на гормональный механизм поддержания нормального уровня глюкозы крови, после двух дней голодания количество глюкозы начинает уменьшаться. Кетоновые тела, почти отсутствующие в крови перед голоданием, резко накапливаются после 2-4 дней режима голодания. Во время длительного голодания кетоны ацетоацетат и β-гидроксибутират, растворимые в воде, служат дополнительным источником энергии. Жирные кислоты не могут служить топливом для мозга — они не могут проникать через гематоэнцефалический барьер.
Ацетил-СоА — это важнейший регулятор превращений пирувата; он аллостерически ингибирует дегидрогеназу и стимулирует пируваткарбоксилазу (см. рис. 15-20). В этих путях ацетил- СоА не допускает образования новых молекул ацетил-СоА из пирувата, стимулируя первую стадию глюконеогенеза — превращение пирувата в оксалоацетат.
У взрослого человека с нормальной массой тела в жировой ткани хранится столько триацилглицеринов, что их хватит для поддержания минимального уровня метаболизма в течение примерно трех месяцев; очень тучный взрослый человек обладает достаточным запасом веществ для того, чтобы голодать больше года (табл. 23-5). Когда заканчивается накопленный жир, начинается расщепление белков; это ведет к потере работоспособности сердца и печени, и, наконец, к смерти. Во время голодания или жесткой диеты запасы жиров могут обеспечивать необходимую энергию, но витамины и минеральные вещества должны поступать извне. Кроме того, глюкогенные аминокислоты белков расходуются в ходе глюконеогенеза, поэтому тоже нуждаются в пополнении из пищи. По этой причине пищевой рацион с целью снижения массы тела дополняют витаминами, минеральными веществами и аминокислотами или белками.
Адреналин сигнализирует о предстоящей физической нагрузке
Когда животное попадает в стрессовую ситуацию и нуждается в увеличении активности (борьба- бегство), нервные импульсы из мозга инициируют высвобождение адреналина или норадреналина надпочечниками. Оба гормона усиливают дыхание для ускорения поглощения O2, увеличивают частоту и силу сердечных сокращений, повышают кровяное давление, таким образом увеличивая поступление O2 и топливных молекул к тканям (табл. 23-6).
Таблица 23-6. Физиологические и метаболические эффекты адреналина: подготовка к активным действиям

Адреналин действует преимущественно на мышцы, жировую ткань и печень. Он активирует гликогенфосфорилазу и инактивирует гликоген- синтазу с помощью сАМР-зависимого фосфорилирования ферментов, стимулируя превращение гликогена печени в глюкозу крови, что необходимо для анаэробной работы мышц. Адреналин активирует также анаэробный распад гликогена в мышцах в ходе ферментативных превращений молочной кислоты, стимулируя гликолитическое образование АТР. Усиление гликолиза сопровождается увеличением концентрации фруктозо- 2,6-бисфосфата, потенциального аллостерического активатора ключевого гликолитического фермента фосфофруктокиназы-1 (см. рис. 15-16, 15-17). Адреналин стимулирует мобилизацию жиров в жировой ткани, активируя (с помощью сАМР-зависимого фосфорилирования) гормон- чувствительную липазу, отщепляет перилипин с поверхности жировых капель (см. рис. 17-3). Наконец, адреналин стимулирует секрецию глюкагона и ингибирует секрецию инсулина, усиливая их эффект на мобилизацию топливных молекул и препятствуя запасанию последних.
Кортизол сигнализирует о стрессе, в том числе о низком уровне глюкозы
Стресс (тревога, боль, страх, лихорадка, инфекции, низкий уровень глюкозы крови, истощение организма) стимулирует высвобождение корой надпочечников кортикостероидного гормона кортизола. Кортизол действует на мышцы, печень и жировую ткань, стимулируя обеспечение организма топливными молекулами и помогая противостоять стрессу. Этот гормон действует относительно медленно путем изменения метаболизма — набора и концентрации определенных ферментов, которые синтезируют его клетки- мишени, а также путем регуляции активности уже существующих молекул ферментов.
В жировой ткани кортизол приводит к увеличению высвобождения жирных кислот из запаса триацилглицеринов. Жирные кислоты экспортируются в другие ткани, чтобы обеспечить там клетки энергией, а глицерин используется для глюконеогенеза в печени. Кортизол стимулирует распад мышечных белков и экспорт аминокислот в печень, где они служат предшественниками в глюконеогенезе. В печени кортизол усиливает глюконеогенез, стимулируя синтез ключевого фермента ФЕП-карбоксикиназы (см. рис. 14-17, б); такое же действие оказывает глюкагон, а инсулин создает противоположный эффект. Глюкоза, образуемая в этом пути, накапливается в печени в форме гликогена или немедленно экспортируется в ткани, нуждающиеся в энергии. Эти изменения метаболизма необходимы для поддержания нормального уровня глюкозы крови и для увеличения запасов гликогена, который легко доступен для обеспечения ответа на стресс — борьба-бегство. Эффект кортизола, таким образом, уравновешивает действие инсулина. При длительном стрессе постоянный выброс кортизола перестает играть положительную адаптационную роль и начинает наносить вред мышечной и костной ткани, а также нарушать эндокринную и иммунную функции организма.
Сахарный диабет развивается из-за нарушений образования инсулина или дефектов его действия
Сахарный диабет — весьма распространенное заболевание: примерно у 60% населения США наблюдаются некоторые отклонения в метаболизме глюкозы, свидетельствующие о развитии диабета или о склонности к нему. В клинической практике выделяют две главные формы диабета: диабет I типа, или инсулинзависимый сахарный диабет (ИЗСД), и диабет II типа, или инсулиннезависимый сахарный диабет (ИНЗСД).
Диабет I типа проявляется в раннем возрасте и быстро становится серьезной болезнью. ИЗСД лечится инъекциями инсулина, потому что причина залючается в недостаточности β-клеток поджелудочной железы, которые не способны вырабатывать нужное количество инсулина. Такой больной нуждается в инсулиновой терапии и внимательном, в течение всей жизни, контроле за балансом между поступлением пищи и дозой инсулина. Характерные симптомы сахарного диабета I типа (и II типа) — сильная жажда и частое мочеиспускание (полиурия), что приводит к потреблению большого количества воды (полидипсия). («Сахарный диабет» означает «чрезмерное выделение сладкой мочи».) Эти симптомы появляются из-за того, что в мочу выделяется много глюкозы (глюкозурия).
Диабет II типа развивается медленно (обычно в пожилом возрасте, у тучных людей), симптомы проявляются слабо, часто в первый период болезнь развивается незаметно. Это целая группа заболеваний, при которых инсулин вырабатывается, но нарушается регуляторная активность инсулина. Больные ИНЗСД не чувствительны к инсулину. Связь между диабетом II типа и полнотой (это обсуждалось ранее) в настоящее время активно исследуется.
При любой форме диабета человек не способен эффективно получать глюкозу из крови; вспомните, что инсулин инициирует перемещение транспортера глюкозы GLUT4 к плазматической мембране в мышечной и жировой тканях (см. рис. 12-16 в т. 1). Кроме того, при диабете происходит очень интенсивное, но неполное окисление жирных кислот в печени. Ацетил-СоА, образованный при β-окислении, не может быть полностью окислен в цикле лимонной кислоты, потому что в результате β-окисления создается большая величина отношения концентраций [NADH]/[NAD+], что ингибирует цикл (NADH превращается в NAD+ в три стадии). Накопление ацетил-СоА ведет к избыточному образованию кетоновых тел ацетоацетата и β-гидроксибутирата, которые не могут быть использованы внепеченочными тканями так же быстро, как они синтезируются печенью. Кроме β-гидроксибутирата и ацетоацетата кровь больных диабетом содержит ацетон, который образуется при спонтанном декарбоксилировании ацетоацетата:
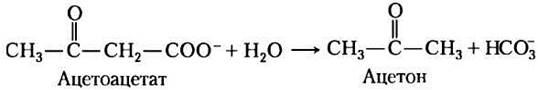
Ацетон — летучее вещество с характерных запахом, и при неконтролируемом диабете в дыхании больного легко улавливается запах ацетона, иногда по ошибке принимаемый за запах этанола. Больному диабетом, у которого из-за высокого уровня глюкозы крови наступает спутанность сознания, нередко ставят неправильный диагноз алкогольной интоксикации, и эта ошибка может оказаться фатальной. Избыточное образование кетоновых тел, называемое кетозом, приводит к значительному возрастанию концентрации кетоновых тел в крови (кетонемия) и в моче (кетонурия).
Кетоновые тела представляют собой карбоновые кислоты, которые при диссоциации образуют протоны. При неконтролируемом диабете закисление может превысить емкость бикарбонатной буферной системы крови, вызывая уменьшение pH, называемое ацидозом, или, в сочетании с кетозом, кетоацидозом; эти явления потенциально опасны для жизни.
Для диагностики и лечения диабета очень важно сделать биохимический анализ крови и анализ мочи. Информативным показателем служит тест на толерантность кглюкозе. Пациент голодает ночь, затем пьет тестовую дозу 100 г глюкозы, растворенной в стакане воды. Уровень глюкозы крови измеряют перед приемом тестовой дозы и далее в течение нескольких часов через интервалы времени в 30 мин. Здоровый человек усваивает глюкозу быстро, уровень глюкозы крови увеличивается не более чем до 9-10 мМ, в моче глюкозы немного или она отсутствует. Больные диабетом усваивают тестовую дозу глюкозы плохо; уровень глюкозы крови многократно увеличивается и очень медленно снижается до исходной концентрации. Поскольку уровень глюкозы крови намного превышает почечный порог (около 10 мМ), глюкоза обнаруживается в моче. ■
Краткое содержание раздела 23.3 Гормональная регуляция энергетического метаболизма
■ Концентрация глюкозы в крови регулируется гормонально. Колебания уровня глюкозы крови (в норме от 60 до 90 мг/100 мл, или -4,5 мМ) при приеме пищи или при активной работе исправляются разнообразными изменениями метаболизма в отдельных органов под действием гормонов.
■ Высокий уровень глюкозы крови усиливает высвобождение инсулина, который ускоряет поглощение глюкозы тканями и благоприятствует запасанию энергии в виде гликогена и триацилглицеринов и в то же время ингибирует мобилизацию жирных кислот в жировой ткани.
■ Низкий уровень глюкозы вызывает выделение глюкагона, который стимулирует высвобождение глюкозы из гликогена печени и сдвигает энергетический метаболизм в печени и в мышцах к окислению жирных кислот и к экономии глюкозы для мозга. При продолжительном голодании триацил-глицерины становятся решающим видом топлива; печень превращает жирные кислоты в кетоновые тела для экспорта в другие ткани, в том числе и в мозг.
■ Адреналин подготавливает организм к увеличенной нагрузке, мобилизуя глюкозу из гликогена и других предшественников и выделяя ее в кровь.
■ Кортизол, высвобождаемый в ответ на различные виды стресса (включая низкий уровень глюкозы крови), стимулирует глюконеогенез из аминокислот и глицерина в печени, таким образом увеличивая уровень глюкозы крови и уравновешивая воздействие инсулина.
■ При диабете инсулин или не вырабатывается, или же не распознается тканями, и поглощение глюкозы из крови затрудняется. При высоком уровне глюкозы крови глюкоза выводится из организма. В результате ткани становятся энергетически зависимыми от жирных кислот (вырабатываются кетоновые тела), а также происходит расщепление клеточных белков, что обеспечивает появление глюкогенных аминокислот для синтеза глюкозы. Поэтому неконтролируемый диабет характеризуется высоким уровнем глюкозы крови и в моче, а также образованием и выделением кетоновых тел.