Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Метод рентгеноструктурного анализа позволил установить как третичную, так и четвертичную структуру гемоглобина
Первым олигомерным белком, ставшим объектом рентгеноструктурного анализа, был гемоглобин (мол. масса 64 500), содержащий четыре полипептидные цепи и четыре простетические гемогруппы, в которых атомы железа находятся в закисной форме [Fe (II)]. Белковая часть молекулы, называемая глобином, состоит из двух а-цепей (по 141 остатку в каждой) и двух ß-цепей (по 146 остатков). Поскольку молекула гемоглобина по своим размерам в четыре раза крупнее молекулы миоглобина, для расшифровки его трехмерной структуры, выполненной Максом Перутцем и его коллегами в Кембридже (Англия), потребовалось намного больше времени и труда. Согласно данным рентгеноструктурного анализа, молекула гемоглобина по своей форме приближается к сфере с диаметром около 5,5 нм. Каждая из четырех цепей имеет характерную для нее третичную структуру. Подобно миоглобину, а- и ß-цепи гемоглобина содержат несколько а-спиральных сегментов, разделенных участками, образующими изгибы цепи. Четыре полипептидные цепи уложены относительно друг друга приблизительно в виде тетраэдра, в результате чего возникает характерная четвертичная структура гемоглобина (рис. 8-10). С каждой цепью связана одна гемогруппа. Гемы разных цепей сравнительно далеко (на расстоянии около 2,5 нм) расположены друг от друга и имеют разный угол наклона. Каждый гем частично погружен в «карман», выстланный гидрофобными R-группами, и соединен с полипептидной цепью координационной связью между атомом железа и R-группой остатка гистидина, как показано на рис. 8-2. Шестая координационная связь атома железа в каждом из гемов свободна и используется для связывания молекулы O2.
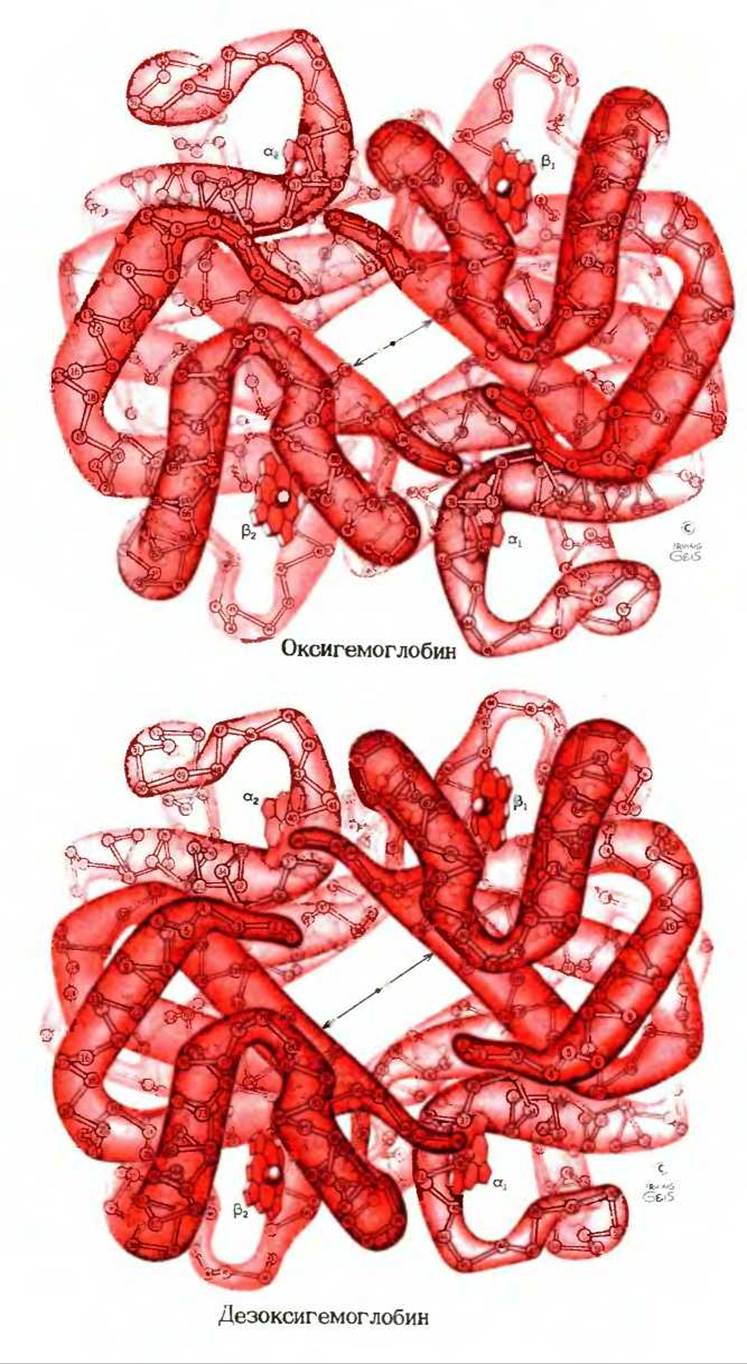
Рис. 8-10. Трехмерная структура окси- и дезоксигемоглобина, установленная методом рентгеноструктурного анализа. Показана четвертичная структура молекулы, т.е. способ совместной укладки четырех субъединиц. Субъединицы объединены в пары а1ß1 и a2ß2.
Между идентичными субъединицами двух типов (а и ß) имеется мало точек соприкосновения друг с другом, тогда как между разными субъединицами возникает множество контактов, стабилизирующих пары a1ß1 и a2ß2. Несмотря на нерегулярную форму, молекула обладает осью симметрии 2-го порядка: при повороте молекулы на 180 вокруг оси, проходящей через центр молекулы перпендикулярно плоскости рисунка, субъединица а1 совмещается с субъединицей а2, a ß1 - с ß2. В каждой цепи указаны номера остатков. Важная роль принадлежит центральной сквозной полости, о чем говорится в дополнении 8-1. Обратите внимание на сравнительно большие расстояния между гемогруппами. Различия между оксигемоглобином и дезоксигемоглобином невелики, но очень важны для функционирования гемоглобина. Вопрос о них будет обсуждаться в этой главе несколько позже.
Тщательный анализ четвертичной структуры гемоглобина с помощью моделей показывает, что между двумя а-цепями или двумя ß-цепями образуется мало прямых контактов, тогда как между а- и ß-цепями возникают многочисленные контакты типа a1ß1 и a2ß2. В образовании таких контактов принимают участие в основном гидрофобные R-группы аминокислотных остатков. Вследствие нерегулярной формы полипептидных цепей две пары субъединиц a1ß1 и a2ß2 не могут плотно прилегать друг к другу, так что в центре между ними остается канал (или полость), проходящий сквозь всю молекулу гемоглобина, что хорошо видно, если смотреть на молекулу сверху (рис. 8-10). Ниже мы еще вернемся к вопросу об этом канале.