Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Количество фермента можно определить по его активности
Количество фермента в данном растворе или экстракте ткани можно определить исходя из каталитического действия этого фермента. Для этого необходимо знать: 1) суммарное уравнение катализируемой реакции, 2) какой аналитический метод наиболее пригоден для определения расхода субстрата или образования продуктов реакции, 3) нуждается ли фермент в таких кофакторах, как ионы металлов или коферменты, 4) зависимость активности фермента от концентрации субстрата, т. е. величину КM для данного субстрата, 5) оптимум pH фермента и 6) температурный интервал, в котором фермент стабилен и обладает высокой активностью. Обычно активность ферментов измеряют при оптимальном значении pH, какой-либо определенной, удобной в том или ином отношении температуре (как правило, в интервале от 25 до 38 °С) и при концентрации субстрата, близкой к насыщающей. В этих условиях начальная скорость реакции обычно пропорциональна концентрации фермента, по крайней мере в заданном диапазоне концентраций фермента (рис. 9-7).
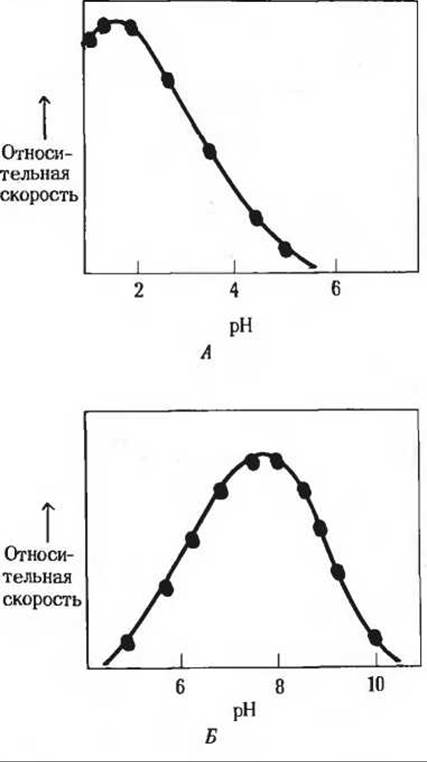
Рис. 9-6. Кривые, характеризующие зависимость активности фермента от pH. Такие кривые строятся на основе данных, полученных при измерении начальных скоростей реакции, протекающей в буферных растворах с разными значениями pH. А. Кривая, описывающая pH-зависимость активности пепсина, который гидролизует определенные пептидные связи в белках во время их переваривания в желудке. Величина pH желудочного сока лежит между 1 и 2. Б. Кривая, описывающая рН-зависимость активности глюкозо-6-фосфатазы из клеток печени, ответственной за выделение глюкозы в кровь. В норме величина pH цитозоля клеток печени составляет около 7,2.
Согласно международному соглашению, за единицу активности фермента принимается такое количество фермент та, которое катализирует превращение 1 мкмоля субстрата (1 мкмоль = 10-6 моля) в 1 мин при 25 С в оптимальных условиях действия фермента. Удельной активностью называется число единиц ферментативной активности в расчете на 1 мг белка. Удельная активность - это мера чистоты ферментного препарата: она возрастает в процессе очистки фермента и становится максимальной и постоянной, когда фермент находится в чистом состоянии.
Числом оборотов фермента называется число молекул субстрата, претерпевающих превращение в единицу времени в расчете на одну молекулу фермента (или один каталитический центр) в условиях, когда концентрация фермента является единственным фактором, лимитирующим скорость реакции (табл. 9-6). Карбонат-дегидратаза (карбоангидраза) - важный фермент, присутствующий в больших концентрациях в эритроцитах, - представляет собой один из наиболее активных ферментов с числом оборотов 36 000 000 в 1 мин в расчете на одну молекулу фермента. Этот фермент катализирует обратимую реакцию гидратации растворенной в воде двуокиси углерода с образованием угольной кислоты (в отсутствие фермента - очень медленно протекающую реакцию)
CO2 + Н2O H2CO3.
Таблица 9-6. Число оборотов некоторых ферментов (число молекул субстрата, претерпевающих превращение за 1 мин при 20-38 ˚С)
|
Карбоангидраза |
36000000 |
|
ß-Амилаза |
1 100000 |
|
1 100000 |
12500 |
|
Фосфоглюкомутаза |
1 240 |
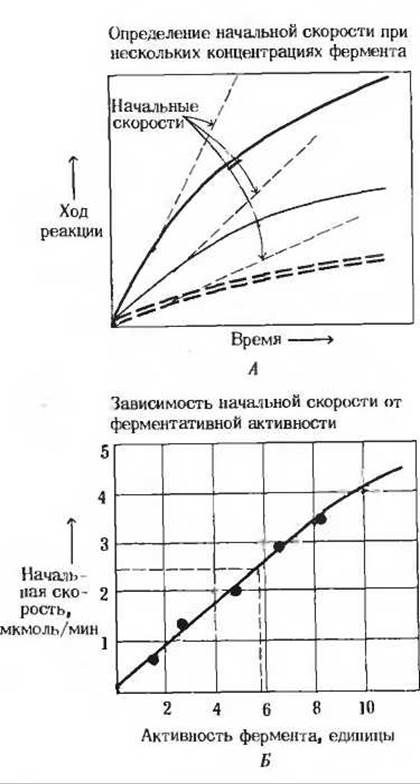
Рис. 9-7. Количественное определение ферментативной активности. Эта процедура проводится в три этапа: 1) определение КM (рис. 9-4 и дополнение 9-2), 2) измерение начальных скоростей (А) при различных концентрациях фермента и при концентрации субстрата, близкой к насыщающей, например при концентрации, равной 10∙КM,
3) построение графика (Б), по оси абсцисс которого откладывается концентрация фермента, а по оси ординат-начальная скорость. Используя линейную часть кривой, можно определить количество фермента в неизвестном образце, обеспечивающем данную начальную скорость. В этом примере неизвестный образен дает начальную скорость 2,5 мкмоль/мин и содержит 5,8 единиц ферментативной активности.
Гидратация СO2 в эритроцитах - важный этап в процессе переноса СO2 от тканей, в которых она образуется, к легким, где она освобождается и выделяется в окружающую среду при выдохе (разд. 4.11. гл. 24).