Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Ферменты проявляют специфичность по отношению к своим субстратам
Некоторые ферменты обладают почти абсолютной специфичностью по отношению к определенным субстратам и не взаимодействуют даже с очень близкими по строению молекулами. Хорошим примером этого может служить фермент аспартаза, обнаруживаемый во многих растениях и бактериях. Он катализирует обратимое присоединение аммиака по двойной связи фумаровой кислоты с образованием L-аспартата (рис. 9-8). Однако под действием аспартазы аммиак не присоединяется ни к какой другой ненасыщенной кислоте. Аспартаза обладает также строгой специфичностью по отношению к оптическим и геометрическим изомерам: она не действует на D-аспартат и не присоединяет аммиак к малеату - геометрическому цис-изомеру фумарата.
С другой стороны, известны ферменты, которые проявляют относительно широкую специфичность и взаимодействуют со многими веществами, имеющими общие структурные особенности. Например, химотрипсин катализирует гидролиз многих пептидов и полипептидов, но разрывает только те пептидные связи, в которых карбонильная группа принадлежит остаткам фенилаланина, тирозина или триптофана (табл. 6-6). Несколько иная ситуация имеет место в случае кишечной фосфатазы, катализирующей гидролиз самых разных эфиров фосфорной кислоты, хотя скорости их расщепления сильно различаются. Изучение субстратной специфичности ферментов привело к возникновению идеи о комплементарности молекулы субстрата и специфического участка на поверхности молекулы фермента, которые подходят друг к другу, как ключ к замку. К этому участку. называемому активным, или каталитическим, центром присоединяется молекула субстрата, претерпевающая превращение в ходе каталитического акта.
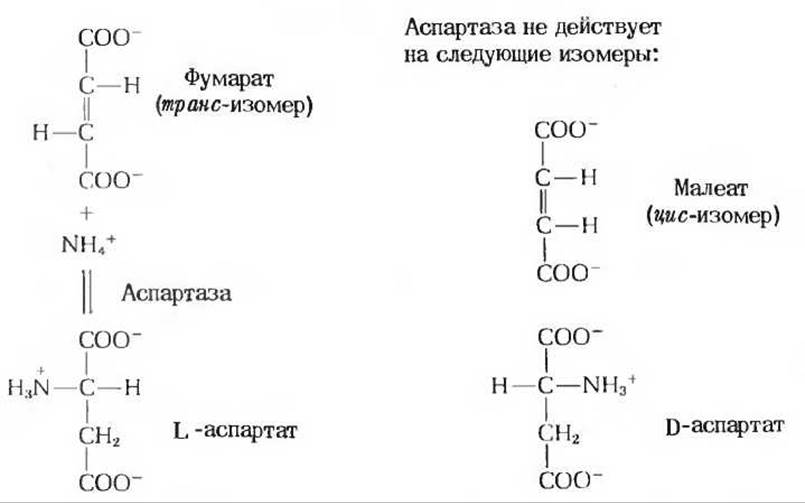
Рис. 9-8. Реакция, катализируемая аспартазой, и субстратная специфичность фермента.
Аспартаза абсолютно специфична по отношению к фумарату в прямой реакции и к L-аспартату - в обратной. Она не атакует ни малеат (цис-изомер фумарата) ни D-аспартат.
При исследовании специфичности ферментов выяснилось, что молекула субстрата должна обладать двумя основными структурными особенностями. Во-первых, она должна содержать специфическую химическую связь, которую фермент мог бы атаковать, и, во-вторых, в ней должна присутствовать та или иная функциональная группа, называемая связывающей группой, которая способна связываться с ферментом и ориентировать молекулу субстрата в активном центре таким образом, чтобы атакуемая связь субстрата была правильно расположена по отношению к каталитической группе фермента. На рис. 9-9 показана субстратная специфичность химотрипсина гидролизующего обычно только те пептидные связи в белках и простых пептидах, в которых карбонильная группа принадлежит остаткам ароматических аминокислот, т. е. остаткам триптофана, тирозина и фенилаланина. Однако при проверке десятков различных синтетических субстратов выяснилось, что химотрипсин может расщеплять также простые амидные и сложно - эфирные связи. Более того, оказалось, что ароматические R-группы тирозина, триптофана и фенилаланина, по отношению к которым химотрипсин проявляет специфичность в полипептидах, служат только гидрофобными связывающими группами. Это подтверждается тем, что химотрипсин способен расщеплять синтетические пептиды, в которых ароматические кольца природных аминокислот заменены на большие по размерам гидрофобные алкильные группы.
Исследования субстратной специфичности ферментов, а также ингибирования ферментативных реакций дают информацию о строении активных центров.