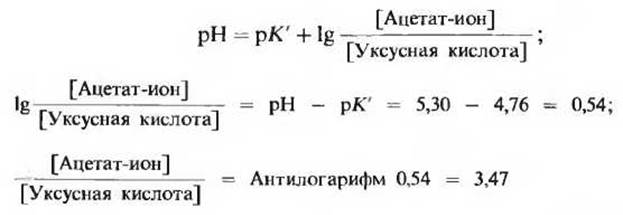Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Буферы - это смеси слабых кислот и сопряженных с ними оснований
Буферы представляют собой водные системы, способные препятствовать изменению их pH при добавлении небольших количеств кислоты (Н+) или основания (ОН-). Буферная система состоит из слабой кислоты (донор протона) и сопряженного с ней основания (акцептор протона). Примером буферной системы может служить смесь уксусной кислоты и ацетат-иона в равных концентрациях; она образуется в растворе при достижении средней точки кривой титрования, показанной на рис. 4-10. Видно, что кривая титрования уксусной кислоты имеет относительно прямой участок, распространяющийся примерно на одну единицу pH по обе стороны от средней точки, которая соответствует pH 4,76. При увеличении концентрации ионов Н+ (или ОН-) в титруемом растворе на данном участке происходит лишь небольшое изменение величины pH. Этот относительно плоский участок представляет собой буферную область сопряженной кислотно-основной пары уксусная кислота-ацетат. В средней точке буферной области, где концентрация донора протона (уксусной кислоты) точно равна концентрации сопряженного основания (ацетата), буферная емкость системы максимальна. Это означает, что увеличение концентрации ионов Н+ (или ОН-) вызывает в этой точке минимальное изменение pH. Особенность этой точки кривой титрования уксусной кислоты состоит также в том, что величина pH в ней численно равна значению рК' уксусной кислоты. Очень важно отметить, что величина pH ацетатной буферной системы хотя и слабо, но все же изменяется при добавлении небольшого количества ионов ОН- (или Н+). Однако эти изменения очень малы по сравнению с теми изменениями pH, которые имели бы место при добавлении того же количества ионов ОН- (или Н+) к чистой воде или к раствору соли сильной кислоты и сильного основания, например NaCl, поскольку ни вода, ни растворы таких солей не обладают буферной емкостью.
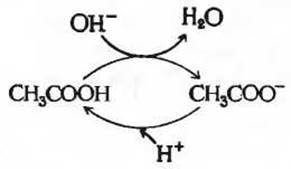
Рис. 4-12. Система уксусная кислота - ацетат может действовать в качестве буфера, способного поглощать либо Н+ либо ОН- -ионы вследствие обратимой диссоциации уксусной кислоты (см. текст).
Буферная емкость - это не результат черной магии, а просто естественное следствие равновесий двух обратимых реакций, которые протекают в растворе, содержащем донор протонов и сопряженный с ним акцептор протонов при условии, что оба они присутствуют в приблизительно равных концентрациях. Посмотрим, как работает буферная система, используя для этого схему, приведенную на рис. 4-12. Один из двух компонентов такой системы - донор протона, или cлабая кислота (НА), содержит резервные связанные ионы Н+, которые могут высвобождаться, чтобы нейтрализовать добавленные к системе ионы ОН- с образованием Н2O. Это происходит потому, что равновесие на какой-то момент нарушается, и член [Н+][ОН-] становится больше 1∙10-14. Нарушенное равновесие быстро восстанавливается, так что произведение [Н+] [ОН-] опять оказывается равным 1∙10-14 (при 25°С), что сразу же приводит к снижению концентрации ионов Н+. Однако теперь отношение [Н+] [ОН-] становится меньше величины К', и в результате происходит дальнейшая диссоциация кислоты НА, чтобы восстановить нарушенное равновесие. Аналогичным образом другой компонент буферной системы, а именно сопряженное основание - анион А-, способно связываться с добавленными к буферному раствору ионами Н+ и превращаться в НА. И в этом случае обе реакции ионизации регулируют друг друга и приходят в состояние равновесия. Теперь мы можем понять, почему сопряженная кислотно-основная пара способна препятствовать изменению pH раствора при добавлении к нему небольших количеств основания или кислоты. Способность раствора функционировать в качестве буфера - это просто автоматическое следствие протекающих в нем двух обратимых реакций и установления соответствующих равновесий, определяемых константами равновесия этих реакций, Kw и К’. Если мы добавляем к буферному раствору ионы ОН- (или Н+), то в результате возникает небольшое изменение в соотношении относительных концентраций слабой кислоты и ее аниона, а следовательно, и незначительное изменение pH. Уменьшение концентрации одного из компонентов буферной системы при добавлении небольшого количества основания (или кислоты) точно уравновешивается повышением концентрации другого компонента. Сумма компонентов буферной системы при этом не изменяется, меняется лишь их соотношение.
Укажем еще на одну важную особенность буферных систем. Как следует из сказанного выше, способность системы уксусная кислота - ацетат функционировать в качестве эффективного буфера вблизи pH 4,76 - это автоматическое следствие того факта, что величина рК' уксусной кислоты равна 4,76. Очевидно, что эта система не может служить буфером при pH крови (около 7,4). Приведенные на рис. 4-11 кривые титрования показывают, что для каждой сопряженной кислотно-основной пары характерна своя область pH, в которой она может служить эффективной буферной системой. Видно, что пара Н2РO-4 — НРО2-4 имеет рК 6,86 и, следовательно, может служить буферной системой в области pH 6,86, тогда как пара NH+4 - NH3, для которой величина рК' равна 9,25, ведет себя как буфер вблизи pH 9,25. Из всех этих сопряженных систем только пара Н2РО; - НРО2-4 может быть использована в качестве эффективного буфера при pH крови (pH 7,4).
Количественное соотношение между величиной pH, способностью смеси слабой кислоты и сопряженного с ней основания функционировать в качестве буферной системы и величиной рК' этой слабой кислоты может быть охарактеризовано уравнением Хендерсона Хассельбаха. Это простое уравнение, которое можно использовать при выборе буферной системы, рассмотрено в дополнении 4-2.
Кривые титрования уксусной кислоты, Н2РО4 и NH4 (см. рис. 4-11) мало различаются по форме. Это позволяет предположить, что все они отражают какую-то общую закономерность, характерную для процесса титрования слабых кислот. Так оно и есть на самом деле. Форма кривой титрования любой слабой кислоты описывается уравнением Хендерсона Хассельбаха, анализ которого помогает понять буферные свойства крови и тканей в организмах млекопитающих (т. е. свойства, обеспечивающие поддержание в них требуемых кислотно-основных равновесий). Ниже приведен простой вывод этого уравнения и даны несколько задач, которые можно решить с его помощью.
Уравнение Хендерсона-Хассельбаха - это по существу одна из форм выражения константы диссоциации кислоты:
![]()
Сначала мы решим это уравнение относительно [Н+]:
![]()
Теперь напишем выражение для отрицательных логарифмов членов, стоящих слева и справа:
![]()
Заменяя — lg К' на pH и — lg рК' на рК', получаем
![]()
Если поменять местами числитель и знаменатель в выражении — lg [НА]/[А-] (что приведет к изменению знака этого выражения), то получится уравнение Хендерсона-Хассельбаха:
![]()
В более общей форме это уравнение выглядит так:
![]()
Уравнение Хендерсона Хассельбаха описывает кривые титрования всех слабых кислот и позволяет вывести ряд важных количественных соотношений. Из него можно понять, например, почему величина рК слабой кислоты численно равна величине pH раствора этой кислоты в средней точке титрования. В этой точке [НА] = [А] и, следовательно,
pH = р К' + lg 1,0 = р К' + 0; pH = рК'.
Уравнение Хендерсона-Хассельбаха дает также возможность вычислить величину рК' любой кислоты при данном pH (если известно отношение молярных концентраций донора и акцептора протонов), определить величину pH сопряженной кислотно-основной пары при данном молярном соотношении (если известна величина рК') и рассчитать соотношение между молярными концентрациями донора и акцептора протонов при любом значении pH (если известна величина рК' слабой кислоты).
Ниже приведены конкретные примеры задач всех трех указанных типов вместе с их решениями.
1) Вычислите величину рК' молочной кислоты, если при концентрации свободной молочной кислоты, равной 0,010 М, и концентрации лактат-иона, равной 0,087 М, величина pH равна 4,80.

2) Вычислите величину pH смеси, состоящей из 0,1 М раствора уксусной кислоты и 0,2 М раствора ацетата натрия, если известно, что величина рК' уксусной кислоты равна 4,76.
![]()
3) Рассчитайте, каким должно быть соотношение между концентрациями ацетат-иона и уксусной кислоты в буферной системе при pH 5.30.