Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Фосфат и бикарбонат - важные биологические буферные системы
У всех живых организмов внутриклеточные и внеклеточные жидкости обычно имеют характерную и постоянную величину pH, которая поддерживается с помощью различных биологических систем. Однако первая линия защиты живых организмов, препятствующая изменениям их внутреннего pH, обеспечивается буферными системами. Две наиболее
важные буферные системы у млекопитающих - это фосфатная и бикарбонатная системы. Фосфатная буферная система, играющая важную роль в поддержании pH внутриклеточной жидкости, представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО-4 (донора протона) и иона НРО4 (акцептора протона).
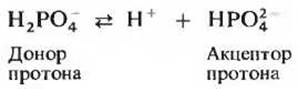
Фосфатная буферная система работает точно так же, как ацетатная, с той разницей, что она функционирует в другом интервале значений pH. Эта система обладает максимальной эффективностью вблизи pH 6,86, поскольку величина рК' ионов Н2РО-4 равна 6,86 (см. табл. 4-4 и рис. 4-11). Фосфатная буферная пара Н2РО-4 — НРО2-4 способна сопротивляться изменениям pH в интервале между 6,1 и 7,7 и может, следовательно, обеспечивать достаточную буферную емкость внутриклеточной жидкости, величина pH которой лежит в пределе 6,9-7,4.
Главной буферной системой плазмы крови служит бикарбонатная система, представляющая собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты (Н2СО3), выполняющей роль донора протона и бикарбонат-иона (НСО-3), выполняющего роль акцептора протона:
![]()
Эта система, которая имеет свою собственную константу равновесия
![]()
функционирует в качестве буфера так же, как и другие сопряженные кислотно-основные пары. Ее уникальная особенность состоит, однако, в том, что один из ее компонентов, а именно угольная кислота (Н2СО3), образуется в результате взаимодействия растворенной в воде (р) двуокиси углерода с водой в соответствии с обратимой реакцией:
![]()
константа равновесия которой равна
![]()
Поскольку при нормальных условиях двуокись углерода представляет собой газ, величина [СО2(р)], т.е. концентрация растворенной СО2, определяется равновесием с СО2 газовой фазы (г):
![]()
характеризуемым константой равновесия К3, равной
![]()
Величина pH бикарбонатной буферной системы зависит от концентрации растворенных в ней компонентов Н2СО3 и НСО-3, выполняющих роль донора и акцептора протонов. Поскольку, однако, концентрация Н2СО3 в свою очередь зависит от концентрации растворенной СО2, а последняя - от парциального давления СО2 в газовой фазе, величина pH бикарбонатного буфера, находящегося в контакте с газовой фазой, в конечном счете определяется концентрацией ионов НСО3 в водной фазе и парциальным давлением СО2 в газовой фазе (см. дополнение 4-3).
Бикарбонатная буферная система функционирует как эффективный физиологический буфер вблизи pH 7,4, потому что донор протона Н2СО3 в плазме крови находится в подвижном равновесии с большим резервным объемом газообразной СО2 в воздушном пространстве легких. В любых условиях, когда кровь почему-либо вынуждена поглощать избыток ионов ОН- и pH повышается, количество угольной кислоты (Н2СО3), частично превратившейся в НСO3 в результате взаимодействия с ионами ОН-, быстро восстанавливается за счет большого запаса газообразной СО2 в легких.
Дополнение 4-3. Как работает бикарбонатная система крови
Буферная система крови включает три взаимосвязанных обратимых равновесия между газообразной СО2 в легких и бикарбонат-ионом (НСО-3) в плазме крови (рис. 1). Когда ионы Н+ попадают в кровь при ее протекании через сосуды тканей, их концентрация сразу же повышается. Это приводит к тому, что равновесие реакции 3 (рис. 1) смещается и устанавливается новое равновесие, соответствующее более высокой концентрации Н2СО3, что в свою очередь приводит к повышению концентрации СО2 (р) в крови. В результате давление СО2 в газовой фазе легких тоже повышается и лишняя СО2 выдыхается. Наоборот, когда в плазму крови поступает некоторое количество ионов ОН-, события происходят в обратной последовательности. Понижение концентрации ионов Н+ вызывает диссоциацию части молекул Н2СО3 на ионы Н+ и НСО-3, а это в свою очередь приводит к растворению в плазме крови некоторого дополнительного количества СО2 (г), содержащегося в легких. Таким образом, высокая интенсивность процесса дыхания, т.е. высокая скорость вдыхания воздуха и выдыхания СO2, может обеспечить достаточно быстрые сдвиги этих равновесий, что обусловливает сохранение постоянной величины pH в крови.
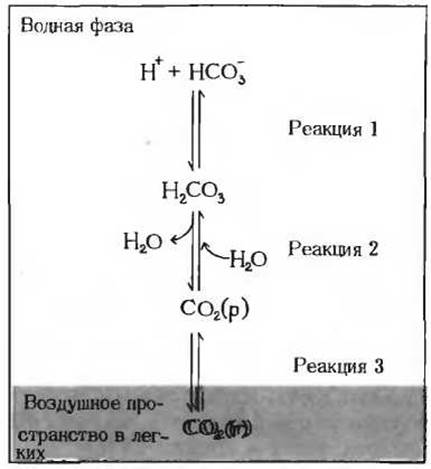
Рис. 1. Между СО2 в воздушном пространстве легких и бикарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается равновесие. Так как концентрация растворенной СО2 может быть быстро отрегулирована путем изменений скорости дыхания, бикарбонатная буферная система крови находится почти в равновесии с обширным потенциальными резервуаром СО2.
СО2 (г) растворяется в крови, образуя СО2 (р), которая вступает в реакцию с водой, что приводит к образованию Н2СО3 (см. дополнение 4-3). И наоборот, когда величина pH крови почему-либо уменьшается, некоторое количество НСО3 буферной системы связывается с избытком ионов Н+ и образуется избыток Н2СО3. Эта Н2СО3 распадается, выделяя растворенную СО2, которая в свою очередь переходит в газовую фазу в легких и в конце концов выдыхается организмом. По мере того как кровь протекает через многочисленные капиллярные сосуды в легких, ее бикарбонатная буферная система быстро приходит почти в равновесное состояние с СO2 в газовом пространстве легких. Совместное функционирование бикарбонатной буферной системы и легких представляет собой очень ответственный механизм, обеспечивающий поддержание постоянной величины рH крови.
Величина pH плазмы крови поддерживается на удивительно постоянном уровне. В норме плазма крови имеет pH, близкий к 7.40. Нарушения механизмов, регулирующих величину pH, наблюдающиеся, например, при тяжелых формах диабета вследствие ацидоза, обусловленного «перепроизводством» метаболических кислот, вызывают падение pH крови до величины 6,8 и ниже, что в свою очередь, может приводить к непоправимым последствиям и смерти. При некоторых других заболеваниях величина pH крови иногда достигает столь высоких значений, что она уже не поддается нормализации. Поскольку повышение концентрации ионов Н+ всего лишь на 1,18∙10-7 М (приблизительная разница между кровью при pH 7,4 и кровью при pH 6,8) может оказаться опасным для жизни, возникает вопрос: какие молекулярные механизмы обеспечивают поддержание величины pH в клетках со столь высокой точностью? Величина pH влияет на многие структурные и функциональные свойства клетки, однако к изменениям pH особенно чувствительна каталитическая активность ферментов. На рис. 4-13 приведены типичные кривые, характеризующие зависимость активности некоторых ферментов от pH. Видно, что каждый из этих ферментов проявляет максимальную активность при определенном значении pH, которое называется оптимумом pH. Отклонение величины pH в любую сторону от этого оптимального значения часто сопровождается резким падением активности фермента. Таким образом, небольшие сдвиги pH могут приводить к значительным изменениям скорости некоторых жизненно важных для организма ферментативных реакций, протекающих, например, в скелетных мышцах или в мозгу. Биологический контроль, обеспечивающий постоянство pH в клетках и жидкостях организма, имеет, следовательно, исключительно важное значение для всех аспектов метаболизма и клеточной активности.

Рис. 4-13. Влияние pH на активность некоторых ферментов. Каждый фермент имеет характерную для него кривую зависимости pH - активность.

Рис. 4-14. Клоп-водомерка (семейство Gerridae) использует высокое поверхностное натяжение воды. Это насекомое, которое живет на поверхности прудов, имеет специальные волоски на своих первых и третьих парах ног, благодаря которым оно держится на поверхностном слое воды, не продавливая его. Средняя пара ног, проникающая через этот слой, действует как весла.