Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Белки: ковалентная структура и биологические функции
Инсулин - это первый белок, для которого была установлена аминокислотная последовательность
Мы теперь знаем принципиальную схему определения аминокислотной последовательности полипептидных цепей. Рассмотрим результаты, полученные Сэнгером при установлении аминокислотной последовательности бычьего инсулина; эта последовательность приведена на рис. 6-11. Бычий инсулин имеет молекулярную массу около 5700. Его молекула состоит из двух полипептидных цепей: A-цепи, содержащей 21 аминокислотный остаток, и В-цепи, содержащей 30 аминокислотных остатков. Эти две цепи соединены двумя дисульфидными (—S—S—) поперечными связями, причем в одной из цепей имеется еще одна внутренняя дисульфидная связь. При определении последовательности вначале были разорваны поперечные дисульфидные связи, что позволило разделить цепи. Для этой цели Сэнгер использовал в качестве окислителя надмуравьиную кислоту, которая расщепляет каждый остаток цистина на два остатка цистеиновой кислоты (рис. 6-12), по одному в каждой цепи. После разделения цепей в них были определены аминокислотные последовательности. При этом не удалось обнаружить никаких закономерностей в расположении какой-либо аминокислоты, никаких периодических повторений того или иного аминокислотного остатка. Более того, последовательности двух цепей оказались совершенно разными.

Рис. 6-11. Первичная структура бычьего инсулина. Показаны аминокислотные последовательности каждой из двух цепей и поперечные связи. A-цепи в молекулах инсулина человека, свиньи, собаки, кролика и кашалота идентичны. Идентичны также В-цепи инсулинов коровы, свиньи, собаки, козы и лошади. Аминокислотные замены в A-цепи обычно наблюдаются в положениях 8,9 и 10 (выделены красным цветом).
Успешное определение аминокислотной последовательности в цепях инсулина способствовало интенсивному изучению взаимосвязи между структурой инсулинов, выделенных из различных видов, и их биологической активностью, связанной с регуляцией обмена глюкозы. Для биологической активности инсулина необходимы обе цепи-А и В. Более того, необходимо, чтобы обе поперечные дисульфидные связи оставались нерасщепленными. Удаление части остатков из той или другой цепи путем их избирательного отщепления приводит к частичной или полной потере активности. Хотя инсулины, выделенные из поджелудочной железы нескольких видов животных - коровы, свиньи, овцы и кашалота, сохраняют гормональную активность в организме человека и могут быть использованы для лечения больных диабетом, они все же не идентичны инсулину человека. Тем не менее весьма существенно то, что в каждой цепи инсулина в определенных положениях всегда присутствуют одни и те же аминокислоты независимо от вида, из которого был выделен данный инсулин. Однако в других положениях аминокислоты могут различаться у разных видов. Эти наблюдения убедительно свидетельствуют о том, что биологическая активность инсулина зависит от аминокислотной последовательности его цепей, а также от наличия в определенных положениях поперечных связей между цепями.
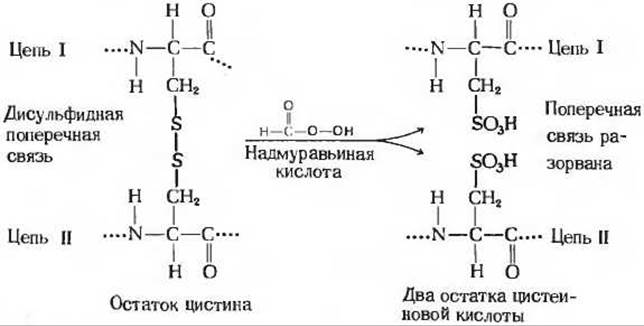
Рис. 6-12. Расщепление дисульфидных поперечных связей надмуравьиной кислотой.