Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Белки: ковалентная структура и биологические функции
Белки претерпевают структурные изменения, называемые денатурацией
На протяжении всей этой главы мы подчеркивали взаимосвязь между аминокислотной последовательностью, биологической активностью и видоспецифичностью белков. Однако характеристика белков далеко не исчерпывается их первичной структурой - так обычно называют ковалентную структуру белка и его аминокислотную последовательность. Об этом ясно свидетельствует давно и хорошо известное свойство белков, о котором мы пока не упоминали. Если раствор белка, например яичного альбумина, медленно нагревать до температуры 60-70°С, он постепенно мутнеет и наконец превращается в вязкий сгусток. Этот процесс хорошо всем знаком, поскольку он происходит при варке яиц. Яичный белок, содержащий альбумин, при нагревании свертывается (коагулирует), превращаясь в упругую белую массу. Свернувшийся таким образом яичный белок после охлаждения оказывается нерастворимым, и из него уже невозможно получить исходный прозрачный раствор. Нагревание яичного альбумина приводит к изменениям, носящим, по-видимому, необратимый характер. Такое же явление наблюдается при нагревании практически всех глобулярных белков независимо от размеров их молекул и биологической функции, хотя температура, при которой осуществляется этот процесс, неодинакова у разных белков. Изменения, происходящие с белками при нагревании, в совокупности называются денатурацией. Белки в их естественном состоянии носят название нативных белков, а после денатурации - денатурированных белков.
Еще одно важное следствие денатурации белка заключается в том, что белок почти всегда утрачивает характерную для него биологическую активность. Так, если водный раствор фермента кипятить в течение нескольких минут, а затем охладить, то фермент, как правило, становится нерастворимым и, что особенно важно, уже не обладает каталитической активностью. Денатурацию белков вызывает не только нагревание, но и воздействие экстремальных значений pH, добавление к раствору белка некоторых органических растворителей, таких, как спирт или ацетон, обработка мочевиной или детергентами и даже сильное взбалтывание белкового раствора на воздухе до тех пор, пока он не вспенится. Каждый из этих способов денатурации можно рассматривать как относительно мягкую обработку. В самом деле, прямые эксперименты показывают, что денатурация не сопровождается разрывом ковалентных связей в полипептидной цепи. Следовательно, аминокислотная последовательность белка после денатурации не изменяется; тем не менее большинство белков при этом утрачивает биологическую активность. Отсюда мы должны заключить, что биологическая активность белка зависит не только от аминокислотной последовательности.
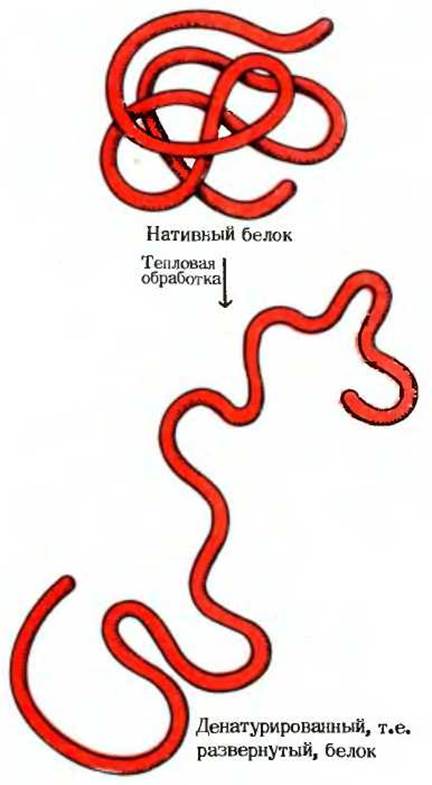
Рис. 6-16. Тепловая обработка нативных глобулярных белков, а также некоторые другие виды воздействия приводят к денатурации этих белков, г.е. к развертыванию цепей без разрушения их ковалентной структуры. Денатурированный белок может принимать множество случайных конформаций и обычно не обладает биологической активностью.
В чем же здесь разгадка? Ответ довольно прост: помимо первичной структуры белки обладают более высокими уровнями структурной организации. Если пояснить эту мысль коротко, то можно сказать, что ковалентно связанная полипептидная цепь нативного белка свертывается в пространстве определенным образом, вследствие чего возникает характерная для данного типа белка укладка полипептидной цепи. Благодаря специфическому способу свертывания цепи в пространстве белок наделен характерной для него биологической активностью (рис. 6-16). В процессе денатурации белка свойственная ему трехмерная организация нарушается, полипептидная цепь развертывается и приобретает беспорядочную структуру, хотя ковалентные связи при этом остаются неповрежденными. Иными словами, нативные молекулы белка очень непрочны и легко утрачивают свою структуру при нагревании или других, казалось бы мягких, воздействиях. Если мы хотим заниматься изучением биологической активности какого-нибудь белка, мы должны при выделении и очистке этого белка обращаться с ним очень осторожно, чтобы избежать его денатурации.
В следующих двух главах будет показано, каким образом полипептидные цепи нативных белков свертываются и приобретают характерную для них специфическую конформацию и как эта конформация зависит от аминокислотной последовательности.