Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Белки: ковалентная структура и биологические функции
Краткое содержание главы
Белки - это самый многочисленный класс присутствующих в клетках макромолекул; они составляют свыше половины сухого веса клеток. Белки представляют собой очень длинные полипептидные цепи, содержащие от 100 до 1 000 и более аминокислотных звеньев, соединенных друг с другом пептидными связями. Простые белки в процессе гидролиза распадаются только на аминокислоты; сложные белки содержат еще и другие дополнительные компоненты - ионы металлов или органические простетические группы. Одни белки имеют волокнистую (фибриллярную) структуру и нерастворимы, тогда как другие состоят из плотно свернутых полипептидных цепей и имеют глобулярную форму.
Клетки содержат сотни и тысячи различных белков, предназначенных для выполнения самых разных биологических функций. Тем не менее все они построены из набора одних и тех же 20 аминокислот, расположенных в различной, но строго определенной для каждого белка последовательности. Аминокислотную последовательность полипептидной цепи можно установить путем расщепления ее на более мелкие фрагменты с последующим определением аминокислотной последовательности каждого фрагмента при помощи отщепления N-концевых аминокислотных остатков по Эдману. Затем пептидные фрагменты располагают в правильном порядке, находя в них участки с перекрывающимися последовательностями. Для этой цели исходный полипептид расщепляют на фрагменты каким-нибудь другим способом так, чтобы места расщепления цепи не совпадали с местами ее расщепления при использовании первого способа фрагментации. Аминокислотные последовательности второго набора фрагментов должны перекрывать места расщепления цепи, полученные первым способом.
Гомологичные белки, выделенные из организмов различных видов, обнаруживают гомологию последовательностей; это означает, что наиболее важные положения в полипептидных цепях гомологичных белков заняты одними и теми же аминокислотами независимо от вида организмов. В других положениях гомологичные белки могут содержать разные аминокислоты. Чем ближе в эволюционном отношении виды, тем более сходны аминокислотные последовательности их гомологичных белков. Таким образом, последовательности гомологичных белков указывают, что содержащие их организмы произошли от общего предка, но в ходе эволюции претерпели изменения и превратились в разные виды. Аналогичные выводы были сделаны исходя из результатов изучения специфичности антител по отношению к антигенам гомологичных видов.
Глобулярные белки при нагревании, под воздействием экстремальных значений pH и при обработке некоторыми реагентами обычно становятся нерастворимыми в воде и утрачивают свою биологическую активность, сохраняя, однако, неповрежденной ковалентную структуру полипептидной цепи. Этот процесс, называемый денатурацией, обусловлен развертыванием полипептидных цепей.
ЛИТЕРАТУРА
Многие полезные сведения содержатся в литературе к главе 5
Книги
Cooper T.G. The Tools of Biochemistry, Wiley, New York, 1977. Руководство по экспериментальным методам биохимии белков. Dayhoff М. О. Atlas of Protein Sequence and Structure, vol. 5, suppl. 1-3, National Biomedical Research Foundation, Washington, D. C., 1972-1979. Энциклопедия аминокислотных последовательностей белков. Dickerson R.E., Geis I. Proteins: Structure, Function, and Evolution, 2d ed., Benjamin/Cummings, Menlo Park, Calif., 1983. Прекрасно иллюстрированная книга о белках, которую можно рассматривать как введение в эту область.
Haschemeyer R., Haschemeyer А.Н. Proteins: A Guide to Study by Physical and Chemical Methods. Wiley, New York, 1973.
Neurath H., Hill R. L. The Proteins, 3d ed.. Academic, New York, 1977. Всестороннее и детальное изложение сведений о белках, представленное в виде многотомного сборника статей.
Schultz G. Е., Schirmer R. Н. Principles of Protein Structure, Springer, New York, 1979.
Статьи
Dickerson R.E. Structure and History of an Ancient Protein, Sсi. Am., 226, 58-72, April (1972).
Edelman G.M. The Structure and Function of Antibodies, Sсi. Am., 223,34-42, August (1970). Moore S., Stein W. H. Chemical Structures of Pancreatic Ribonuclease and Deoxyribonuclease, Science, 180, 458-464 (1973).
O'Farrell P.H. High Resolution Two-Dimensional Analysis of Proteins, J. Biol. Chem., 250, 4007-4021 (1975). Интересная попытка пересчитать все белки, присутствующие в клетке Е. coli.
Srinavasan P.R., Fruton J.S., Edsall J.T. (eds.) The Origins of Modern Biochemistry. A Retrospective on Proteins, Ann. N.Y. Acad. Sсi, 325 (1979). Сборник очень интересных статей по истории исследования белков.
Вопросы и задачи
1. Сколько молекул β-галактозидазы присутствует в клетке Е. coli? Е coli - это палочкообразная бактерия длиной 2 мкм и диаметром 1 мкм. Если при выращивании клеток Е. coli питательной средой служит лактоза (сахар молока), то бактерии синтезируют фермент ß-галактозидазу (мол. масса 450 000), который катализирует реакцию расщепления лактозы. Средняя плотность бактериальной клетки составляет 1,2 г/мл; 14% всей массы клетки приходится на долю растворимых белков, среди которых ß-галактозидаза составляет 1,0%. Подсчитайте число молекул ß-галактозидазы в клетке Е. coli, выросшей на лактозе.
2. Число остатков триптофана в сывороточном альбумине быка. По данным количественного аминокислотного анализа в сывороточном альбумине быка содержится 0,58% (по весу) триптофана, мол. масса которого равна 204.
а) Рассчитайте минимальную молекулярную массу сывороточного альбумина быка.
б) По данным гель-фильтрации молекулярная масса сывороточного альбумина быка составляет приблизительно 70000. Сколько остатков триптофана присутствует в молекуле сывороточного альбумина?
3. Молекулярная масса рибонуклеазы. Содержание лизина в рибонуклеазе составляет 10,5% (по весу). Рассчитайте минимальную молекулярную массу рибонуклеазы. Молекула рибонуклеазы содержит 10 остатков лизина. Рассчитайте молекулярную массу рибонуклеазы.
4. Суммарный электрический заряд полипептидов. Полипептид, выделенный из мозга, имеет последовательность
Glu—His—Тrр—Ser—Туr—
Gly—Leu—Arg—Pro—Gly
Определите суммарный заряд молекулы при pH 3. Каков ее суммарный заряд при pH 5,5? При pH 8? При pH 11? Значения рК’ для R-групп Glu, His, Ser, Туr и Arg равны соответственно 4,3, 6,0, 13,6, 10 и 12,48. Рассчитайте изоэлектрическую точку этого полипептида.
5. Изоэлектрическая точка пепсина. Пепсин желудочного сока (pH 1,5) имеет изоэлектрическую точку около 1, т.е. намного ниже, чем другие белки (см. табл. 6-5). Какие функциональные группы должны присутствовать в пепсине в относительно большом числе, чтобы этот фермент мог иметь такую низкую изоэлектрическую точку? Какие аминокислоты имеют эти группы в своем составе?
6. Изоэлектрическая точка гистонов. Гистоны - это белки, содержащиеся в ядрах эукариотических клеток. Они прочно связаны с дезоксирибонуклеиновой кислотой (ДНК), которая содержит много фосфатных групп. Изоэлектрическая точка гистонов очень высока (около 10,8). Какие аминокислотные остатки должны присутствовать в гистонах в относительно больших количествах? Каким образом эти остатки обеспечивают прочное связывание гистонов с ДНК?
7. Растворимость полипептидов. В одном из методов разделения полипептидов используется различие в их растворимости. Как уже было сказано в тексте, растворимость крупных полипептидов в воде зависит от степени полярности их R-групп, особенно от числа ионизируемых групп: чем больше ионизируемых групп, тем выше растворимость полипептида. Какой полипептид из каждой пары приведенных ниже полипептидов более растворим в указанных условиях?
а) (Gly)20 или (G1u)20 при pH 7,0;
б) (Lys—Аlа)3 или (Phe—Met)3 при pH 7,0;
в) (Ala—Ser—Gly)5или (Asn—Ser—His)5 при pH 9,0;
г) (Ala—Asp—Gly)5или (Asn—Ser—His)5 при pH 3,0.
8. Расщепление полипептидной цепи на фрагменты под действием протеолитических ферментов. Трипсин и химотрипсин - это специфические ферменты, катализирующие гидролитическое расщепление полипептидов в определенных местах их цепи (табл. 6-6). Ниже приведена последовательность В-цепи полипептидного гормона инсулина. Учтите, что цистиновый поперечный мостик между А- и В-цепями уже разорван под действием надмуравьиной кислоты (см. рис. 6-12).
Phe — Val — Asn — Gln — His — Leu — CySO3H — Gly — Ser — His — Leu — Val — Glu — Ala — Leu — Tyr — Leu — Val — CySO3H — Gly — Glu — Arg — Gly — Phe — Phe — Tyr — Thr — Pro — Lys — Ala
Укажите те места в В-цепи, в которых происходит ее расщепление под действием
а) трипсина и б) химотрипсина.
9. Определение аминокислотной последовательности лей-энкефалина - выделенного из мозга пептида. Из нормальной мозговой ткани была выделена группа полипептидов, влияющих на передачу нервного импульса в определенных участках мозга. Эти полипептиды известны под названием опиоидов, поскольку они присоединяются к специфическим рецепторам, которые связывают опиаты (алкалоиды опиума), такие, как морфин и налоксон. Таким образом, опиоиды имитируют некоторые свойства опиатов. Некоторые исследователи рассматривают эти полипептиды как содержащиеся в мозгу собственные средства обезболивания. Используя приведенные ниже сведения, определите аминокислотную последовательность опиоида лей-энкефалина. Объясните, как согласуется полученная вами структура с указанными ниже
а) Полный гидролиз под действием 1 М НСl при 110°С с последующим аминокислотным анализом выявил присутствие Gly, Leu, Phe и Туr в молярном отношении 2:1 :1 :1.
б) После обработки полипептида 2,4-динитрофторбензолом с последующим полным гидролизом и хроматографическим разделением продуктов было выявлено присутствие 2,4-динитрофенильного производного тирозина. Свободного тирозина при этом не было обнаружено.
в) Частичный гидролиз полипептида химотрипсином с последующим хроматографическим разделением полученных продуктов дал Leu, Туr и более короткий пептид. Полный гидролиз последнего с последующим аминокислотным анализом выявил присутствие Gly и Phe в отношении 2:1.
10. Электрофорез пептидов. Если ионизированные аминокислоты и пептиды поместить в электрическое поле, то в зависимости от pH они движутся в сторону катода или анода (см. рис. 6-5). Этот метод широко используется для разделения пептидов, различающихся по величине суммарного заряда. Возможности метода особенно велики благодаря тому, что суммарный заряд пептида можно изменять, изменяя pH среды.
а) Определите направление миграции (к аноду или катоду) для всех выписанных ниже аминокислот и пептидов при заданном значении pH
1) Glu (pH 7)
2) Glu (pH 1)
3) Asp—His (pH 1)
4) Asp—His (pH 10)
б) При каком значении pH можно легко разделить с помощью электрофореза следующие три дипептида: Gly—Lys, Asp—Val и Ala—His?
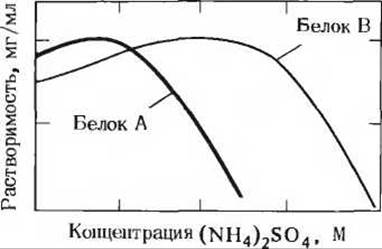
11. Растворимость: высаливание
а) Чистые белки большей частью нерастворимы в дистиллированной воде, но растворяются в разбавленных солевых растворах. Однако при добавлении к водному раствору белка нейтральных солей в высокой концентрации белок выпадает в осадок. Это явление называют высаливанием. Например, большая часть белков растворяется в 0,1 М (NH4)2SO4, но выпадает в осадок, если концентрация (NH4)2SO4 повышается до 3М. После удаления избытка (NH4)2SO4 путем диализа белки снова растворяются. Попытайтесь объяснить на молекулярном уровне, почему добавление солей в высоких концентрациях приводит к понижению растворимости белка.
б) На графике показана зависимость растворимости двух белков от концентрации (NH4)2SO4. Как можно использовать эти данные для разделения белков А и В?
Задача 11
12. Аффинная хроматография: высокоспецифичный и эффективный метод выделения специфических белков. Вследствие того что молекулы большинства белков легко разрушаются при использовании для их выделения и очистки многих традиционных методов, применяемых в органической химии, таких, как возгонка и экстрагирование различными растворителями, биохимики вынуждены были разработать для этой цели специальные методы. Нередко удается выделить какой-нибудь один белок, присутствующий в смеси, содержащей несколько тысяч других биомолекул, в концентрации 10-3∙10-6 М. Один из таких методов, известный под названием аффинной хроматографии, сыграл решающую роль при выделении и очистке ряда ферментов, иммуноглобулинов и рецепторных белков. В основе метода лежит тот хорошо известный факт, что белки, выполняя свойственные им биологические функции, обратимо связываются с другими специфическими видами молекул, называемых лигандами. В результате образуются прочные нековалентные белковолигандные комплексы.

По этому методу лиганд, специфически связывающийся с белком, который нам нужно выделить, ковалентно присоединяют к нерастворимым полимерным гранулам диаметром 10-50 мкм.

Для выделения этого белка из клеточного экстракта последний вносят в колонку, заполненную полимерными гранулами с присоединенным к ним лигандом, после чего колонку промывают несколько раз буферным раствором. При этом на колонке удерживаются лишь те белки, которые имеют высокое сродство к закрепленному на полимере лиганду; остальные же белки просто вымываются буфером. Поскольку сродство и специфичность белка к лиганду очень высоки, таким путем зачастую можно в один прием выделить и очистить чрезвычайно малые количества белка из клеточного экстракта, содержащего сотни других белков.
Каким образом можно получить белок, оставшийся на аффинной колонке, в чистом виде? Объясните, какие принципы лежат в основе предлагаемой операции.
13. Структура полипептидного антибиотика, выделенного из Bacillus brevis. Экстракты, полученные из бактериальной культуры Bacillus brevis, содержат пептид со свойствами антибиотика. Этот пептид образует комплексы с ионами металлов и, по-видимому, нарушает систему ионного транспорта через клеточную мембрану, убивая таким образом определенные виды бактерий. Структура полипептида была установлена на основе следующих наблюдений:
а) Полный кислотный гидролиз пептида, как показал последующий аминокислотный анализ, привел к образованию эквимолярных количеств Leu, Orn, Phe, Pro и Val. Orn - сокращенное обозначение орнитина - аминокислоты, не встречающейся в белках, но присутствующей в некоторых пептидах. Он имеет следующее строение:

б) Измерения молекулярной массы дали приблизительную величину 1200.
в) Пептид не подвержен гидролизу под действием фермента карбоксипептидазы.
г) Обработка исходного полипептида фтординитробензолом с последующим полным гидролизом образовавшегося производного и хроматографированием полученных продуктов дает лишь свободные аминокислоты и производное следующего строения:
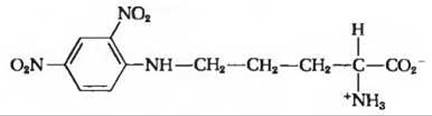
(Подсказка: учтите, что 2,4-динитрофенильная группа присоединилась не к а-азоту, как это обычно имеет место, а к аминогруппе боковой цепи.)
д) Частичный гидролиз полипептида с последующим хроматографическим разделением полученных продуктов и определением в них аминокислотных последовательностей дал следующие ди- и трипептиды (N-концевая аминокислота всегда расположена слева);
![]()
Исходя из приведенной выше информации, попытайтесь восстановить аминокислотную последовательность полипептидного антибиотика. Поясните ваши рассуждения. После того как у вас будет готов ответ, вернитесь назад и проверьте, насколько установленная вами структура согласуется с каждым из описанных выше наблюдений.