Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Окислительное расщепление аминокислот. Цикл мочевины
Перенос а-аминогрупп катализируется трансаминазами
Большую часть метаболической энергии, вырабатываемой в тканях, поставляют процессы окисления углеводов и триацилглицеролов; у взрослого мужчины до 90% всей потребности в энергии покрывается из этих двух источников. Остальную энергию (в зависимости от рациона от 10 до 15%) дает окисление аминокислот.
Хотя роль аминокислот в организме определяется в первую очередь тем, что они служат строительными блоками для биосинтеза белков, в известных условиях они могут претерпевать и окислительное расщепление. Это возможно в трех случаях. 1) Если аминокислоты, высвобождающиеся при обычном динамическом обновлении белков, не используются для синтеза новых белков, то они подвергаются окислительному расщеплению. 2) Если организм получает с пищей больше аминокислот, чем это ему необходимо для белкового синтеза, то избыточное их количество расщепляется, потому что аминокислоты не откладываются в организме в запас. 3) Во время голодания или при сахарном диабете, т.е. тогда, когда углеводов нет или когда их утилизация нарушена, в качестве топлива используются белки. Во всех этих ситуациях аминокислоты теряют свои аминогруппы и превращаются в соответствующие а-кетокислоты, которые затем окисляются до СО2 и воды; частично это окисление идет через цикл лимонной кислоты.
В этой главе мы познакомимся с метаболическими путями, по которым идет окислительное расщепление двадцати обычных аминокислот, входящих в состав белков. Мы узнаем также, что у разных видов животных отщепляемый от аминокислот аммиак выводится из организма в различной химической форме.
а-Аминогруппы двадцати обычных L-аминокислот, обнаруживаемых в белках, отщепляются на одной из стадий окислительного расщепления аминокислот. Если эти аминогруппы не используются повторно для синтеза новых аминокислот или других азотсодержащих соединений, то они собираются в одной форме, превращаются в конце концов в один общий конечный продукт и в таком виде выводятся из организма. У человека и у большинства других наземных позвоночных таким конечным продуктом является мочевина. Отщепление а-аминогрупп от большей части L-аминокислот катализируется ферментами, которые называются трансаминазами или аминотрансферазами. В таких ферментативных реакциях трансаминирования а-аминогруппа переносится от аминокислоты на а-углеродный атом а-кетоглутарата, в результате чего образуется а-кетоаналог исходной аминокислоты и L-глутамат, представляющий собой продукт аминирования а-кетоглутарата (рис. 19-1).
![]()
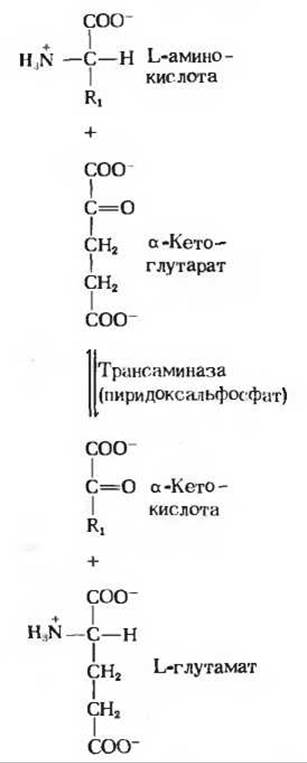
Рис. 19-1. Реакция трансаминирования Переносимая аминогруппа выделена красным. В большей части реакций трансаминирования акцептором аминогрупп служит а-кетоглутарат.
Отметим, что реального дезаминирования, т.е. потери аминогрупп, в таких реакциях не происходит, поскольку дезаминирование а-аминокислоты сопровождается аминированием а-кетоглутарата. Смысл трансаминирования состоит в его коллекторной функции, иными словами, в том, что аминогруппы от многих разных аминокислот собираются в одной форме - в виде L-глутаминовой кислоты. Таким образом, катаболизм различных аминокислот приводит в конечном итоге к одному-единственному продукту.
Большинство трансаминаз проявляет специфичность в отношении акцептора аминогрупп: таким акцептором в приведенной выше реакции служит для них а-кетоглутарат. Менее специфичны трансаминазы в отношении другого субстрата, т.е. той аминокислоты, которая играет роль донора аминогрупп. Ниже приведено несколько реакций, в которых участвуют наиболее важные трансаминазы (в названии ферментов указывается аминокислота, играющая роль донора аминогрупп):

Итак, общим акцептором, принимающим аминогруппу от большинства аминокислот, является а-кетоглутарат. Образовавшийся L-глутамат служит для того, чтобы направлять аминогруппы на определенные биосинтетические пути (гл. 22) и в ту конечную последовательность реакций, посредством которой образуются продукты азотистого обмена, выводимые затем из организма. Реакции, катализируемые трансаминазами, легко обратимы, поскольку их константы равновесия близки к 1,0. Это означает, что величина ∆G0' для таких реакций близка к нулю (разд. 14.3).
У всех трансаминаз имеется прочно связанная простетическая группа, и механизм их действия одинаков. Простетической группой трансаминаз служит пиридоксальфосфат - производное пиридоксина, или витамина В6 (разд. 10.8). Пиридоксальфосфат действует как промежуточный переносчик аминогрупп в активном центре трансаминаз (рис. 19-2). Во время каталитического цикла он претерпевает обратимые переходы между альдегидной формой (пиридоксальфосфат), способной присоединять аминогруппы, и аминированной формой (пиридоксаминфосфат), способной передавать аминогруппы на а-кетоглутарат. Таким образом, эта простетическая группа действует как обратимый переносчик аминогрупп от а-аминокислоты на а-кетоглутарат (рис. 19-2). Tрансаминазы - классический пример ферментов, катализирующих бимолекулярные реакции, протекающие по механизму типа «пинг-понг» (разд. 9.8). В таких реакциях первый субстрат должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться. Сначала с активным центром фермента связывается приходящая аминокислота, которая отдает свою аминогруппу пиридоксальфосфату и в форме а-кетокислоты покидает активный центр. Затем с активным центром связывается приходящая а-кетокислота; она принимает аминогруппу от пиридоксаминфосфата и отделяется от активного центра, теперь уже в форме аминокислоты.
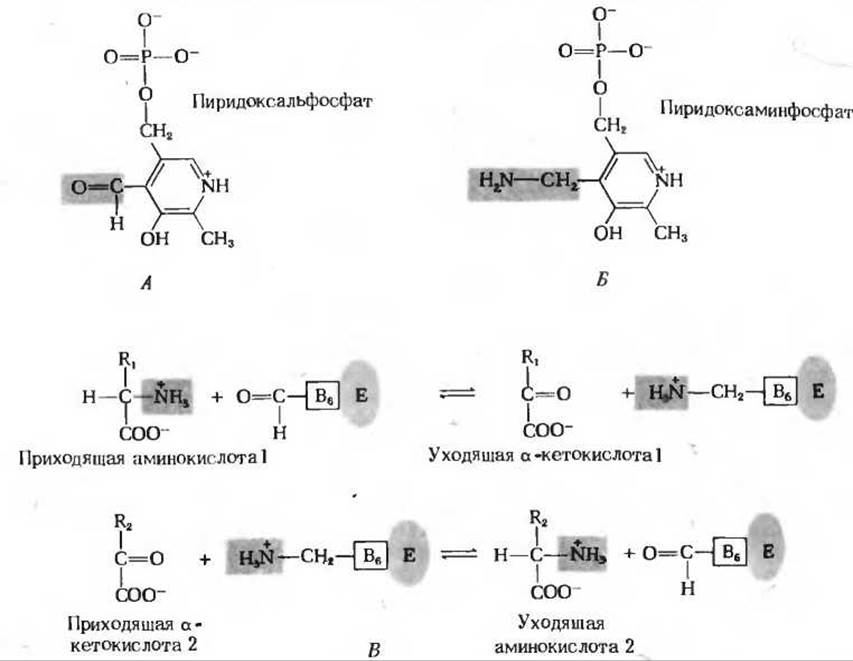
Рис. 19-2. Простетическая группа трансаминаз. Пиродоксальфосфат (А) и его аминированная форма - пиридоксаминфосфат (Б) - это прочно связанные коферменты трансаминаз. Функциональные группы, от которых зависит их действие, показаны на красном фоне. В. Пиридоксальфосфат играет роль промежуточного переносчика аминогрупп при действии трансаминаз. Е означает здесь ферментный белок, а - прочно связанный пиридоксальфосфат.
![]()
Трансаминазы катализируют бимолекулярные реакции, протекающие по механизму типа «пинг-понг». Первый субстрат - а-аминокислота I, отдав свою аминогруппу, покидает фермент в виде а-кетокислоты до того, как к ферменту присоединится второй субстрат-а-кетокислота 2.
На рис. 19-3 видно, что карбонильная группа связанного с ферментом пиридоксальфосфата взаимодействует с а-аминогруппой приходящей аминокислоты, в результате чего образуется промежуточный продукт, представляющий собой ковалентное соединение - шиффово основание. Затем происходит сдвиг двойной связи C=N и гидролитическое отщепление углеродного скелета аминокислоты; при этом ее аминогруппа остается ковалентно связанной с простетической группой в форме пиридоксаминфосфата. Пиридоксаминфосфат образует теперь шиффово основание с приходящим а-кетоглутаратом, на который и переносится аминогруппа; перенос совершается, по сути, путем обращения тех реакций, в которых образовался пиридоксаминфосфат.
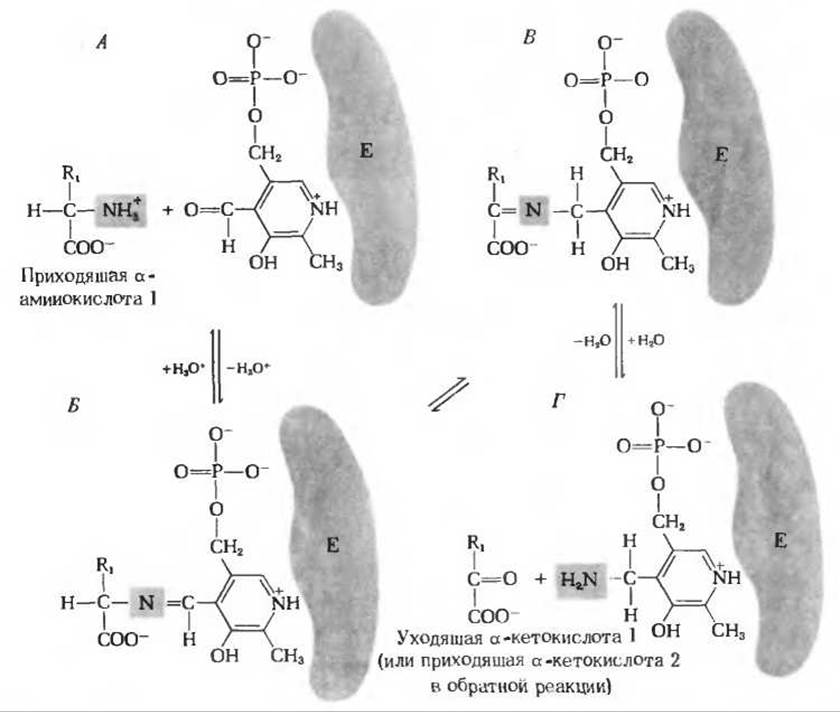
Рис. 19-3. Схема, поясняющая действие пиридоксальфосфата в трансаминазах. Аминогруппа приходящей а-аминокислоты (А) взаимодействует с карбонильной группой пиридоксальфосфата, прочно связанного с ферментом. При этом в качестве промежуточного продукта образуется шиффово основание (Б), которое переходит затем в свою таутомерную форму (В). Последняя гидролизуется с образованием соответствующей а-кетокислоты, которая удаляется, в то время как аминогруппа остается ковалентно связанной с трансаминазой в форме пиридоксаминфосфата (Г). Поскольку эти реакции обратимы, аминированная форма трансаминазы передает затем свою аминогруппу на приходящую а-кетокислоту 2, в результате чего образуется новая аминокислота.
В медицине определение аланин-трансаминазы и аспартат-трансаминазы в сыворотке крови служит важным методом диагностики и оценки результатов лечения при инфаркте миокарда. Этот же метод используется и для обнаружения токсического действия некоторых химических реактивов (дополнение 19-1).