Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Окислительное расщепление аминокислот. Цикл мочевины
Аммиак образуется из глутамата
Мы уже видели, что почти все а-аминокислоты отдают свои аминогруппы в реакции трансаминирования с а-кетоглутаратом, приводящей к образованию L- глутамата. Каким образом эти аминогруппы отщепляются от глутамата и в какой форме они выводятся из организма?
Дополнение 19-1. Определение содержания трансаминаз и других ферментов в крови используется в медицине для диагностики
Аланин-трансаминаза (называемая также глутамат-пируват—транс-аминазой, ГПТ) и аспартат-трансаминаза (называемая также глутамат-оксалоацетат—трансаминазой, ГОТ) играют важную роль в диагностике заболеваний сердца и печени. Тромбоз какой-либо из ветвей коронарной артерии вызывает местную аноксию и в конечном итоге отмирание одного из участков сердечной мышцы, так называемый инфаркт миокарда. При этом заболевании аланин-трансаминаза и аспартат-трансаминаза вместе с другими ферментами выходят из поврежденных клеток миокарда и попадают в кровоток. Определение в сыворотке крови концентрации этих двух трансаминаз и еще одного фермента миокарда, креатинкиназы, может дать ценную информацию о степени тяжести и о стадии повреждения сердечной мышцы. Креатинкиназа - первый фермент миокарда, появляющийся в крови после приступа ишемической болезни. Он также быстро исчезает из крови. Во вторую очередь появляется ГОТ, а затем ГПТ. Из поврежденных клеток миокарда или из клеток, испытывающих недостаток кислорода, выходит наружу и попадает в кровоток также и лактатдегидрогеназа.
Определение ГОТ и ГПТ в сыворотке крови играет важную роль и в диагностике профзаболеваний. Таким путем выявляются повреждения печени у лиц, работающих с различными органическими растворителями (четыреххлористым углеродом, хлороформом и т.п.), применяемыми в химической и других отраслях промышленности, а также, например, для сухой чистки одежды. Эти растворители вызывают дегенерацию ткани печени, в результате чего из поврежденных клеток поступают в кровь различные ферменты. Удобнее всего при систематических анализах крови у лиц, соприкасающихся с такими химическими веществами, определять содержание трансаминаз, так как активность этих ферментов в печени очень высока и даже самые малые их количества легко поддаются обнаружению.
Определение уровня различных ферментов в сыворотке крови служит источником важной информации при целом ряде заболеваний.
Окислительное дезаминирование глутамата катализируется L-глутаматдегидрогеназой, для которой акцептором восстановительных эквивалентов служит NAD+:
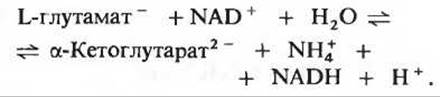
Этот фермент присутствует только в митохондриях, где он содержится в матриксе. Именно глутаматдегидрогеназа ответственна за большую часть аммиака, образующегося в животных тканях, потому что глутамат - это единственная аминокислота, способная таким путем с большой скоростью отщеплять свою а- аминогруппу. Понятно поэтому, что глутамат и глутаматдегидрогеназа играют совершенно особую роль в обмене аминогрупп.
Глутаматдегидрогеназа - сложный аллостерический фермент. Молекулярная масса глутаматдегидрогеназы равна приблизительно 300 000. Молекула этого фермента состоит из шести идентичных субъединиц, каждая из которых представляет собой одну полипептидную цепь, построенную из 500 аминокислотных остатков. Положительным модулятором фермента, оказывающим на него сильное активирующее действие, служит ADP и ингибитором - GTP (продукт сукцинил-СоА-синтетазной реакции в цикле лимонной кислоты; разд. 16.5,д). Всякий раз, когда клеткам печени требуется больше топлива для цикла лимонной кислоты, С тем чтобы они могли образовать больше АТР, активность глутаматдегидрогеназы повышается, вследствие чего появляется а-кетоглутарат, который может быть использован в цикле лимонной кислоты, и высвобождается аммиак - для выведения из организма. Если же в митохондриях в результате усиленной работы цикла лимонной кислоты накапливается GTP, то окислительное дезаминирование глутамата подавляется.
Аммиак может и сохраняться, а затем использоваться для синтеза аминокислот. В этом случае глутаматдегидрогеназа действует в обратном направлении, т. е. катализирует восстановление аммиака и а-кетоглутарата с образованием глутамата. Эта реакция, однако, не является простым обращением NAD-зависимой реакции, представленной выше; вместо NAD в ней участвует NADP:
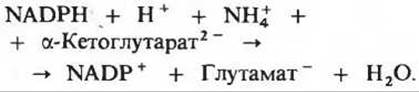
То обстоятельство, что глутаматдегидрогеназа использует разные коферменты для отщепления и присоединения аммиака, обеспечивает независимую регуляцию этих двух реакций - дезаминирования глутамата и аминирования а-кетоглутарата, хотя обе реакции катализируются одним и тем же ферментом.
Обратимся теперь в соответствии с темой предыдущих глав к рассмотрению окислительных путей, на которые направляются дезаминированные аминокислоты. Речь пойдет о катаболических путях, обеспечивающих окисление главных питательных веществ и их использование в качестве источника энергии. Позже мы еще вернемся к вопросу о судьбе аминогрупп.