Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
ATP-Цикл и биоэнергетика клетки
Первый и второй законы термодинамики
В наши дни человек особенно остро ощущает, насколько энергия (т. е. способность производить работу) необходима для поддержания всей нашей современной цивилизации. Энергия требуется нам для производства различных товаров, для перевозки людей и материалов, для отопления жилых и рабочих помещений, а также для многих и многих других менее важных дел. Точно так же необходима энергия и микрокосмосу живой клетки. В живых клетках непрерывно синтезируются новые вещества, выполняется механическая работа, связанная с движением, происходит транспорт веществ и вырабатывается тепло. За миллиарды лег эволюции клетки научились использовать энергию более экономно и более эффективно, чем использует ее большинство машин, созданных человеком. Действительно, на живые клетки мы смотрим теперь, как на модели, с помощью которых нам следует создавать новые, более совершенные устройства для преобразования энергии, и в первую очередь для улавливания энергии Солнца.
Раздел биохимии, занимающийся вопросами преобразования и использования энергии в живых клетках, носит название биоэнергетики. Мы начнем эту главу с рассмотрения нескольких основных принципов термодинамики, т. е. той области физики, которая имеет дело с превращениями энергии. После этого мы обратимся к системе АТР, чтобы выяснить, как с ее помощью совершается в клетках перенос энергии от катаболических реакций, в которых энергия выделяется, к тем клеточным процессам, для которых она необходима.
Энергия известна нам в различных формах; мы знаем электрическую, механическую. химическую, тепловую и световую энергию. Мы знаем также, что энергия может переходить из одной формы в другую. Так, в электромоторе электрическая энергия преобразуется в механическую, в аккумуляторе происходит преобразование химической энергии в электрическую, а в паровой турбине в механическую энергию преобразуется тепло. Различные формы энергии связаны друг с другом определенными количественными соотношениями: например, 1 кал тепловой энергии теоретически соответствует 4,185∙107 механической энергии.
Известно, однако, что любой переход энергии из одной формы в другую сопровождается некоторыми потерями. Электрический мотор, преобразующий электрическую энергию в механическую, вырабатывает всегда меньше полезной энергии, чем потребляет, потому что из- за трения часть энергии переходит в тепло, которое рассеивается в окружающем пространстве, и уже не может быть использовано. Практически всякий раз, когда энергия используется для производства работы или когда она переходит из одной формы в другую, часть полезной энергии теряется. Во многих машинах на выполнение полезной работы расходуется менее 25% потребляемой энергии. Многочисленные количественные исследования по взаимопревращению различных форм энергии, выполненные физиками и химиками, позволили сформулировать два фундаментальных закона термодинамики. Мы попытаемся изложить здесь их суть в наиболее простой и доступной форме.
а. Первый закон
При любом физическом или химическом изменении общее количество энергии во Вселенной остается постоянным.
Первый закон - это закон сохранения энергии; его можно сформулировать и так: энергия не появляется и не исчезает. Всякий раз, когда энергия используется для выполнения работы или же переходит из одной формы в другую, общее количество энергии остается неизменным.
б. Второй закон
Все физические или химические процессы стремятся идти в направлении, соответствующем необратимому переходу полезной энергии в хаотическую, неупорядоченную форму. Мерой такого перехода служит величина, которая носит название энтропии. Процесс останавливается, когда наступает состояние равновесия, при котором энтропия имеет максимально возможное при данных условиях значение.
Эта упрощенная и в какой-то мере абстрактная формулировка требует некоторых пояснений. Прежде всего необходимо более точно определить понятия «полезная энергия» и «энтропия». Есть два вида полезной энергии: 1) свободная энергия, которая может производить работу при постоянной температуре и постоянном давлении, и 2) тепловая энергия, способная производить работу только при изменении температуры и давления. Энтропия является количественной характеристикой или мерой неупорядоченной (в известном смысле бесполезной) энергии в данной системе. Строгое определение понятия энтропии требует математического рассмотрения понятия «неупорядоченность». Поскольку мы не имеем здесь такой возможности, попробуем на нескольких простых примерах качественно охарактеризовать понятие энтропии (дополнение 14.1).
Дополнение 14-1. Понятие энтропии
Термин «энтропия», буквально означающий «внутреннее изменение» или «внутреннее превращение», впервые был введен в 1851 г. немецким физиком Рудольфом Клаузиусом, которому принадлежит одна из первых формулировок второго закона термодинамики. Строгая количественная интерпретация энтропии может быть дана на основе статистических и вероятностных представлений. Качественный смысл этого понятия можно проиллюстрировать на трех примерах, каждый из которых характеризует определенный аспект энтропии. Главное, что всегда связывают с энтропией, - это неупорядоченность системы, которая в разных случаях может проявляться по-разному.
Случай 1. Чайник и рассеяние тепла. Известно, что пар, образующийся при кипении воды, может совершать полезную работу. Представим себе, однако, что, как только температура воды в чайнике (т. е. в «системе») достигнет 100 ˚С, мы выключим под ним огонь и дадим ему просто остыть в кухне (т. е. в «окружающей среде»). При этом не будет произведено никакой работы. Вместо этого из чайника в окружающую среду будет переходить тепло, постепенно повышая температуру среды (т. е. кухни) до тех пор, пока, наконец, не будет достигнуто полное тепловое равновесие. В этот момент все части нашего чайника и кухни будут иметь практически одну и ту же температуру. Свободная
энергия, которая была сконцентрирована в чайнике, когда он был заполнен водой, нагретой до 100 ˚С, и которая потенциально могла производить работу, исчезла. Эквивалентное ей количество тепловой энергии после охлаждения чайника осталось в системе «чайник + кухня» (т. е. во «Вселенной»), но оно перераспределилось между разными частями системы беспорядочно, или, иначе говоря, равномерно. Эта энергия уже недоступна и не может производить работу, потому что в пределах кухни уже нет перепада температур. Более того, возрастание энтропии в кухне (в «окружающей среде»), обусловленное охлаждением чайника, необратимо. Действительно, из повседневного опыта нам хорошо известно, что тепло самопроизвольно никогда не перейдет обратно, т. е. от кухни к остывшему чайнику, и не нагреет в нем воду до 100 ˚С.
Случай 2. Окисление глюкозы. Энтропия характеризует состояние не только энергии, но и вещества. Аэробные организмы извлекают свободную энергию из глюкозы, которую они получают из окружающей среды. Для того чтобы добыть эту энергию, они окисляют глюкозу молекулярным кислородом, также поступающим из среды. Конечные продукты окислительного метаболизма глюкозы, СО2 и Н2О, возвращаются в окружающую среду. При этом процессе энтропия окружающей среды возрастает, а сам организм остается в стационарном состоянии и степень его внутренней упорядоченности не изменяется. Возрастание энтропии и в этом случае отчасти связано с рассеянием тепла, но здесь возникает неупорядоченность и другого рода, иллюстрируемая суммарным уравнением окисления глюкозы в живых организмах: С6Н12О6 + 6О2→ 6СО2 + 6Н2О. Схематически этот процесс можно изобразить следующим образом:
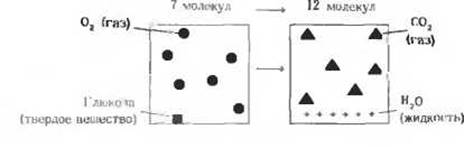
Атомы, входившие ранее в состав одной молекулы глюкозы и шести молекул кислорода, т. е. составлявшие в общей сложности семь молекул, распределились в результате реакции более равномерно, поскольку из семи молекул теперь образовалось двенадцать (6СО2 + 6Н2О).
Всякий раз, когда в результате химической реакции увеличивается число молекул или когда какое-нибудь твердое вещество, например глюкоза, превращается в жидкие или газообразные продукты, молекулы которых обладают большим числом степеней свободы и легче могут перемещаться в пространстве по сравнению с твердым веществом, степень молекулярной неупорядоченности возрастает и энтропия, следовательно, увеличивается.
Случай 3. Информация и энтропия. В «Юлии Цезаре» Шекспира (акт IV, сцена 3) Брут, узнав о том, что на него движется со своей армией Марк Антоний, произносит следующие слова:
There is a tide in the affairs of men,
Which taken at the flood, leads on to fortune;
Omitted, all the voyage of their life
Is bound in shallows and in miseries1.
Перед нами богатое информацией сообщение, записанное при помощи букв английского алфавита; всего их здесь 125. Помимо своего прямого смысла эти слова имеют еще и другой, скрытый смысл. В них отражается не только сложная последовательность событий в пьесе, но также и мысли автора о столкновении интересов, о честолюбии, о жажде власти. Чувствуется глубокое проникновение Шекспира в человеческую природу. Таким образом, объем заключенной в них информации очень велик.
Представим себе теперь, что 125 букв, составляющих эту цитату, рассыпаны в совершенном беспорядке, как показано здесь на рисунке

Весь смысл оказался утрачен. В такой форме эти 125 букв практически не несут никакой информации, но их энтропия весьма велика. Из этого следует вывод, что информация представляет собой одну из форм энергии; ее иногда называют «отрицательной энтропией». Действительно, теория информации, т. е. та область математики, на которой базируется программная логика компьютеров, весьма тесно связана с термодинамической теорией. Живые организмы - это высокоупорядоченные структуры, содержащие колоссальное количество информации и соответственно бедные энтропией.
1 В делах людей прилив есть и отлив,
С приливом достигаем мы успеха,
Когда ж отлив наступит, лодка жизни
По отмелям несчастий волочится.
(У. Шекспир. Полное собрание сочинений, «Искусство», т. 5, с. 303. Перевод М. Зенкевича.)
Есть и другой аспект второго закона, который следует учитывать для понимания того, как действует этот закон, особенно в биологических системах. Введем прежде всего понятие реакционной системы, под которой подразумевается совокупность веществ, обеспечивающих протекание данного химического или физического процесса.
Такой системой может быть, например, организм животного, отдельная клетка или два реагирующих друг с другом соединения. Далее мы должны ввести понятие окружающей среды, с которой реакционная система может обмениваться энергией. Совокупность реакционной системы и окружающей среды составляет то, что мы называем «Вселенной»
∆С = ∆Н - Т∆S
(рис. 14-1) и что. вообще говоря, включает в себя земной шар и космическое пространство. Некоторые химические или физические процессы могут, конечно, протекать в замкнутых системах, не способных к обмену энергией с окружающей средой. Однако в реальном мире, и особенно в мире биологическом, системы, в которых протекают химические и физические процессы, обмениваются энергией с окружающей средой. Мы скоро убедимся, насколько важно это разграничение между системой и окружающей средой, когда речь идет об обмене энергией.

Рис. 14-1. Схематическое изображение реакционной системы и окружающей среды. В реакциях, протекающих при постоянной температуре и постоянном давлении, между системой и окружающей средой возможен обмен энергией, однако такой обмен должен происходить в соответствии с законами термодинамики. Первый из них гласит, что общее количество энергии во «Вселенной» (система + окружающая среда) остается постоянным. Согласно второму закону, при физическом или химическом изменении в системе энтропия Вселенной увеличивается; одновременно уменьшается свободная энергия реакционной системы. Наряду с этими изменениями от системы к окружающей среде или от окружающей среды к системе может передаваться тепло, как это следует из соотношения
Изменения свободной энергии, теплоты и энтропии в химических реакциях, протекающих при постоянной температуре и постоянном давлении, т. е. в условиях, характерных именно для биологических систем, связаны друг с другом количественно следующим уравнением:
∆С = ∆Н — T∆S, (1)
где ∆С - изменение свободной энергии реакционной системы, ∆Н изменение ее теплосодержания, или энтальпии (от греч. «enthаlpо»-нагреваю). Т - абсолютная температура, при которой протекает данный процесс, и ∆S - изменение энтропии ((Вселенной», которая включает в себя и данную реакционную систему. По мере того как химическая реакция стремится к состоянию равновесия, энтропия Вселенной (система + окружающая среда) возрастает. Поэтому величина AS в реальном мире всегда имеет положительное значение. В принципе в некой идеальной системе реакция может протекать и без увеличения энтропии. Увеличению энтропии Вселенной при какой-либо реакции должно, согласно уравнению (1). соответствовать уменьшение свободной энергии реакционной системы. Поэтому величина AG реакционной системы имеет всегда отрицательное значение. Изменение энтальпии ∆Н определяется как количество тепла, которое данная реакционная система отдает окружающей среде или получает от нее при постоянной температуре и постоянном давлении. Если реакционная система теряет (т. е. отдает) тепло, то величина ∆Н имеет отрицательное значение; если же система получает тепло от окружающей среды, то ∆Н выражается положительной величиной.
Для биологических систем существенна еще одна важная особенность изменений энтропии. Согласно второму закону термодинамики, при химических реакциях или физических процессах энтропия Вселенной увеличивается. Из этого закона, однако, не следует, что возрастание энтропии должно происходить обязательно в самой реакционной системе; оно может произойти в любом другом участке Вселенной. В живых организмах метаболические процессы, т. е. те превращения, которым подвергаются в них пищевые вещества, не ведут к возрастанию внутренней неупорядоченности, или энтропии самих организмов. Из повседневных наблюдений мы знаем, что любой организм, будь то муха или слон (т. е. в нашем понимании «система»), при всех процессах жизнедеятельности сохраняет присущую ему сложную и упорядоченную структуру. В результате процессов жизнедеятельности возрастает энтропия не самих живых организмов, а окружающей среды. Живые организмы сохраняют внутреннюю упорядоченность, получая свободную энергию в виде пищевых веществ (или солнечного света) из окружающей среды и возвращая в нее такое же количество энергии в менее полезной форме, главным образом в форме тепла, которое рассеивается во всей остальной Вселенной.
В заключение следует подчеркнуть, что сам по себе рост энтропии, или увеличение степени неупорядоченности, нельзя считать совершенно бесполезным. Поскольку увеличение энтропии Вселенной при биологических процессах необратимо, оно создает движущую силу и задает направление всем видам биологической активности. Живые организмы непрерывно повышают энтропию в окружающей среде, и этим Вселенная расплачивается за поддержание в них внутреннего порядка.
Здесь, по-видимому, целесообразно рассмотреть какую-нибудь конкретную химическую реакцию из числа протекающих в клетке, для того чтобы получить представление о возможных величинах изменений разных форм энергии. В аэробных клетках происходит окисление глюкозы (С6Н12О6) до СО2 и Н2О при постоянной температуре и постоянном давлении
С6Н12О6 + 6О2→ 6СО2 + 6Н2О.
Если принять, что эта реакция протекает в стандартных условиях, а для термодинамических расчетов это значит, что температура равна 25 ˚С, или 298 К, и давление равно 1 атм (760 мм рт. ст.), то на 1 моль окисленной глюкозы

Увеличение степени молекулярной неупорядоченности, или энтропии, которым сопровождается окисление глюкозы, можно представить себе достаточно наглядно с помощью примера, приведенного в дополнении 14.1.