Основы биохимии Том 3 - А. Ленинджер 1985
Молекулярные механизмы передачи генетической информации
Синтез белка и его регуляция
Для активации аминокислот необходимы тРНК
Для того чтобы понять, каким образом тРНК выполняют роль адапторов при переводе с языка нуклеиновых кислот на язык белков, нам следует сначала познакомиться с их структурой. тРНК представляют собой сравнительно небольшие одноцепочечные молекулы. тРНК бактерий и внемитохондриального цитозоля эукариот состоят из 73-93 нуклеотидов, что соответствует мол. массе 24 000-31000. (Митохондрии содержат особые тРНК несколько меньшего размера.) Каждой аминокислоте соответствует хотя бы одна тРНК; некоторым аминокислотам соответствуют две или большее число специфических тРНК. Чтобы распознать все аминокислотные кодоны, требуется по меньшей мере 32 тРНК (разд. 29.20), однако в некоторых клетках присутствует намного больше разных вариантов тРНК.
Многие тРНК выделены в гомогенном виде. В 1965 г. после нескольких лет работы Роберт У. Холли и его сотрудники из Корнелльского университета установили полную нуклеотидную последовательность аланиновой тРНК дрожжей. Эта тРНК, ставшая самой первой нуклеиновой кислотой, которую удалось полностью секвенировать, содержит 76 нуклеотидных остатков, в том числе 10 модифицированных. Ее полная нуклеотидная последовательность приведена на рис. 29-3. С тех пор была установлена нуклеотидная последовательность для десятков других тРНК, выделенных из разных видов организмов и обладающих разной аминокислотной специфичностью; при их сравнении удалось выявить много общих черт, характерных для структуры тРНК. Во всех тРНК 8 или больше нуклеотидов содержат необычные, модифицированные основания, многие из которых представляют собой метилированные производные главных
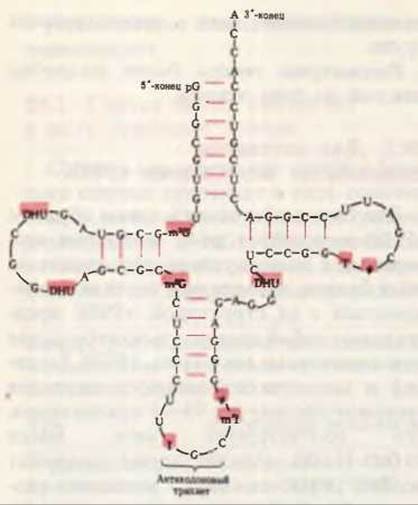
Рис. 29-3. Нуклеотидная последовательность дрожжевой аланиновой тРНК, определенная Холли и его сотрудниками и изображенная в форме клеверного листа. В дополнение к A, G,
U и С использованы следующие символы для модифицированных нуклеозидов: ψ - псевдоуридин, I - инозин, Т - риботимидин, DHU - 5,6-дигидроуридин, m2I-1-метилинозин, m1G-1-Meтилгуанозин, m2G-N2-диметилгуанозин. Модифицированные нуклеозиды даны на красном фоне. Красные линии между параллельными участками молекулы обозначают комплементарные пары оснований. Антикодон обладает способностью “узнавать” аланиновые кодоны в мРНК. Другие особенности структуры тРНК отмечены в тексте и на рис. 29-4. В РНК G может образовывать пары и с С, и с U, хотя пара G-U не так стабильна, как уотсон-криковская пара G-C.
оснований. В большинстве тРНК на 5'-конце находится остаток гуаниловой кислоты (pG), а на 3'-конце всех тРНК присутствует тринуклеотидная последовательность —С—С—А (3'). Если изобразить структурную формулу тРНК в таком виде, чтобы число внутримолекулярных комплементарных пар (т, е. А—U, G—С и G—U) было максимальным, то такая формула будет иметь вид “клеверного листа”. В “клеверном листе” различают четыре ветви; более длинные тРНК содержат, кроме того, короткую пятую, или дополнительную, ветвь (рис. 29-3 и 29-4). Две из этих ветвей непосредственно участвуют в функционировании тРНК в качестве адаптера. Акцепторная ветвь присоединяет специфическую аминокислоту (АК), карбоксильная группа которой эфирной связью прикрепляется к 2'- или 3'-гидроксильной группе 3'-концевого остатка А в тРНК. Антикодоновая ветвь содержит антикодон, т. е. специфический триплет нуклеотидов, который комплементарен в антипараллельном направлении соответствующему триплету (кодону) мРНК и может образовывать с ним пары оснований.
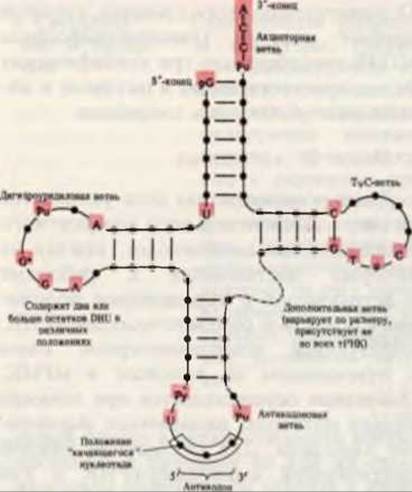
Рис. 29-4. Обобщенная вторичная структура, характерная для всех тРНК. Если изобразить структурные формулы тРНК с учетом принципа образования максимального числа внутримолекулярных пар, то для всех тРНК они принимают форму клеверного листа. Черные кружки на остове молекулы обозначают нуклеозидные остатки, а красные линии проведены между комплементарными основаниями. Положения, занимаемые во всех тРНК одними и теми же основаниями, выделены красным фоном. Размеры тРНК варьируют от 73 до 93 нуклеотидов. Добавочные нуклеотиды встречаются в дополнительной и дигидроуридиловой ветвях. На вершине антикодоновой ветви расположена антикодоновая петля, которая всегда содержит семь неспаренных нуклеотидов. В состав дигидроуридиловой ветви обычно входит до трех остатков DHU.
В некоторых тРНК дигидроуридиловая ветвь состоит всего из трех пар оснований, соединенных водородными связями. Обозначения: Рипуриновый нуклеозид, Ру - пиримидиновый нуклеозид, ψ - псевдоуридин, G* - гуанозин или 2'- О-метилгуанозин, Т - риботимидин, DHU - дигидроуридин.
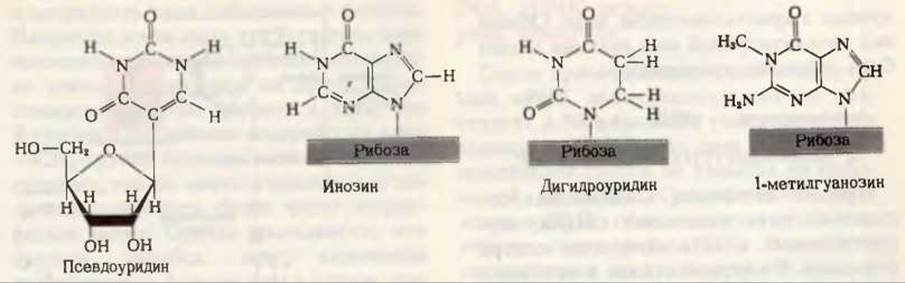
Рис. 29-5. Некоторые из необычных или модифицированных нуклеозидов, обнаруженных в тРНК.
Каждая тРНК имеет свой особый антикодон. Две ее другие главные ветви — дигидроуридиловая ветвь, которая содержит необычный нуклеозид дигидроуридин, и Т'РС-ветвь; в последней находятся нуклеозид риботимидин (Т), как правило, не присутствующий в РНК, и нуклеозид псевдоуридин (П в котором основание и пентоза соединены необычной углерод-углеродной связью (рис. 29-5).
Дрожжевая фенилаланиновая тРНК была получена в кристаллическом виде и подвергнута рентгеноструктурному анализу, который подтвердил, что в тРНК соблюдается принцип максимального внутримолекулярного спаривания оснований при помощи водородных связей. Однако трехмерная структура тРНК напоминает скорее перевернутую латинскую букву L, нежели клеверный лист (рис. 29-6). В дополнение к водородным связям между парами оснований в поддержании третичной структуры тРНК принимают участие и водородные связи другого рода. Поскольку спаривание оснований в РНК осуществляется не столь строго, как в ДНК, спаренным участкам тРНК не свойственна строгая регулярность, поэтому структура тРНК в отличие от двойной спирали ДНК не имеет формы жесткой палки и характеризуется значительной гибкостью.
Рассмотрим теперь, как к молекуле тРНК с помощью фермента присоединяется специфическая аминокислота.
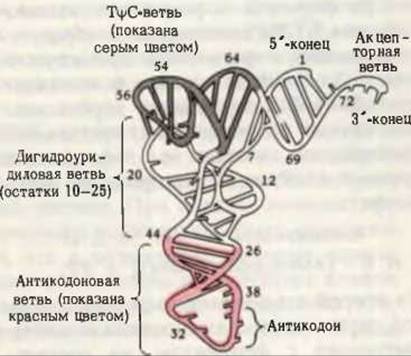
Рис. 29-6. Трехмерная структура дрожжевой фенилаланиновой тРНК, установленная методом рентгеноструктурного анализа с разрешением 3 Å. Она напоминает перевернутую латинскую букву L. [Из работы Кима и др., Science, 185, 436 (1974).]