Основы биохимии Том 3 - А. Ленинджер 1985
Молекулярные механизмы передачи генетической информации
Синтез белка и его регуляция
Аминоацил-тРНК - синтетазы присоединяют к тРНК соответствующую ей аминокислоту
На первом этапе биосинтеза белка, протекающем в цитозоле клетки, двадцать различных аминокислот присоединяются эфирной связью к соответствующим тРНК. Эти процессы катализируются двадцатью различными активирующими ферментами, называемыми аминоацил-тРНК-синтетазами, каждый из которых специфичен по отношению к какой-то одной аминокислоте и к соответствующей тРНК. Почти все аминоацил-тРНК-синтетазы E.coli были выделены в чистом виде и многие из них были получены в кристаллическом виде. Общий вид катализируемой ими реакции может быть выражен уравнением
![]()
Процесс активации аминокислот состоит из двух отдельных стадий, осуществляемых в каталитическом центре фермента. На первой стадии в активном центре фермента в результате взаимодействия АТР и аминокислоты образуется связанное с ферментом промежуточное соединение - аминоациладенилат (рис. 29-7). В ходе реакции карбоксильная группа аминокислоты соединяется ангидридной связью с 5'-фосфатной группой АМР, вытесняя при этом пирофосфат:
![]()
На второй стадии аминоацильный остаток переносится с аминоациладенилата, связанного с ферментом, на соответствующую специфическую тРНК:
![]()
На этой последней стадии аминоацильный остаток связывается со свободной 2'- или 3'-гидроксильной группой концевого остатка А в молекуле тРНК (рис. 29-8); однако, присоединившись к одной из них, он может свободно “перепрыгивать” на другую гидроксильную группу и обратно. Эфирная связь между аминокислотой и тРНК является высокоэнергетической; величина ∆G0' ее гидролиза составляет приблизительно — 7 ккал/мол. Образующийся в процессе активации неорганический пирофосфат гидролизуется пирофосфатазой до ортофосфата (разд. 14.17). Таким образом, на активацию каждой аминокислоты затрачиваются в конечном счете две высокоэнергетические фосфатные связи, что делает суммарную реакцию активации аминокислоты практически необратимой:

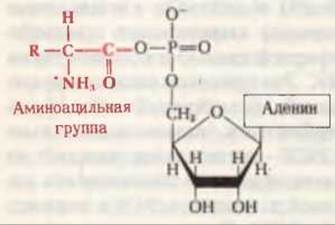
Рис. 29-7. Обобщенная структура аминоациладенилата, образующегося в активном центре аминоацил-тРНК-синтетаз.
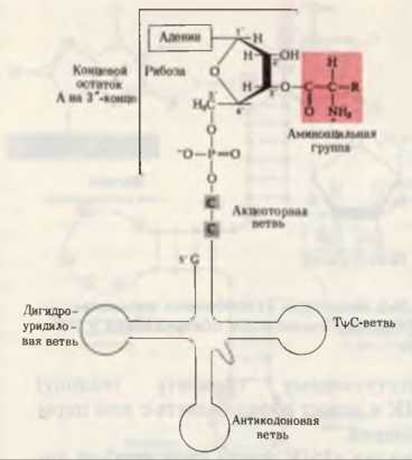
Рис. 29-8. Обобщенная структура аминоацил-тРНК. Аминоацильная группа, присоединенная в 3'-положении к концевому остатку А (аденилата), показана на красном фоне. R означает боковую группу аминокислоты. Аминоацильная группа может перемещаться из 2'-положения рибозы в 3'-положение и обратно.
Аминоацил-тРНК-синтетазы очень специфичны в отношении как тРНК, так и соответствующей ей аминокислоты. Если к тРНК присоединится неправильная аминокислота и образуется ошибочная аминоацил-тРНК, то неправильный аминокислотный остаток включится в полипептидную цепь. Однако некоторые аминоацил-тРНК - синтетазы - это “хитрые” ферменты; подобно ДНК-полимеразам, они способны находить и исправлять свои собственные ошибки. Например, из-за того, что R-группы аминокислот валина и изолейцина структурно очень похожи друг на друга (единственное различие состоит в том, что R-группа в изолейцине содержит на одну —СН2-группу больше), можно было бы ожидать, что на место изолейцина в полипептидную цепь будет часто встраиваться валин. Однако оказывается, что частота ошибок при включении изолейцина не больше, чем в случае других аминокислот,- около одной на 3000-4000 остатков; это объясняется тем, что изолейцил-тРНК-синтетаза способна находить и предотвращать такие ошибки. Она распознает образованный неправильный аминоациладенилат и исправляет ошибку, гидролизуя валил- АМР, когда тот находится еще в активном центре:
Е — [Валил-АМР] + Н2О →
→ Валин + АМР + Е
Затем изолейцил-тРНК - синтетаза начинает все сначала и образует правильный интермедиат изолейцил-АМР, который в свою очередь превращается в правильную изолейцил-тРНКIle:
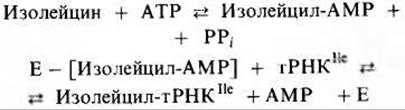
Поскольку R-группа у валина чуть меньше, чем у изолейцина, создается впечатление, что валил-AMP соответствует гидролитическому участку изолейцил-тРНК-синтетазы, а изолейцил-АМР не соответствует. По-видимому, у аминоацил-тРНК-синтетаз есть четыре специфических участка, которые участвуют в узнавании, катализе и исправлении ошибок: один для аминокислоты, второй для тРНК, третий для АТР и четвертый для Н2О, необходимой для гидролиза неправильных аминоациладенилатов.