ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
25. МЕТАБОЛИЗМ ДНК
25.3. Рекомбинация ДНК
Перестройка заключенной в молекулах ДНК генетической информации осуществляется благодаря протеканию многих разнообразных процессов, обобщенно называемых генетической рекомбинацией. В настоящее время генетические перегруппировки находят практическое применение для модификаций все большего числа геномов (гл. 9 в т. 1)
Выделяют три основных типа генетической рекомбинации. Гомологичная генетическая рекомбинация (общая рекомбинация) представляет собой обмен генами между двумя любыми молекулами ДНК (или участками одной и той же молекулы), которые содержат протяженные отрезки почти идентичной последовательности. Последовательности могут быть любыми, главное, чтобы они были похожими. При сайт-специфической рекомбинации происходят обмен только определенных последовательностей ДНК. Транспозиция ДНК отличается от двух других типов генетической рекомбинации тем, что в ней обычно участвует короткий участок ДНК, обладающий способностью перемещаться по хромосоме с одного сайта на другой. Такие «прыгающие» гены впервые были обнаружены Барбарой МакКлинток в 1940-х гг. в геноме кукурузы. Кроме того, существуют и разные другие необычные генетические перестройки, механизм и значение которых пока не установлены. В этой книге мы рассмотрим только три основных типа рекомбинации.

Функции систем генетической рекомбинации так же разнообразны, как и их механизмы. К ним относится участие в специализированных системах репарации ДНК, определенная активность при репликации ДНК, регуляция экспрессии некоторых генов, облегчение расхождения хромосом при делении эукариотических клеток, поддержание генетического разнообразия и реализация запрограммированных генетических перестроек в ходе эмбрионального развития. В большинстве случаев генетическая рекомбинация тесно связана с другими процессами метаболизма ДНК, и эта связь будет рассмотрена далее.
Гомологичная генетическая рекомбинация выполняет несколько функций
У бактерий гомологичная генетическая рекомбинация служит для репарации ДНК и, как отмечалось в разд. 25.2, называется рекомбинационной репарацией ДНК. Обычно она направлена на восстановление репликативных вилок, застопорившихся на месте повреждений в ДНК. Гомологичная генетическая рекомбинация также может происходить при конъюгации (скрещивании), когда хромосомная ДНК переносится из одной бактериальной клетки (клетки донора) в другую (клетку реципиента). Рекомбинация в ходе конъюгации, хотя и редко происходит в популяциях бактерий, вносит вклад в генетическое разнообразие.
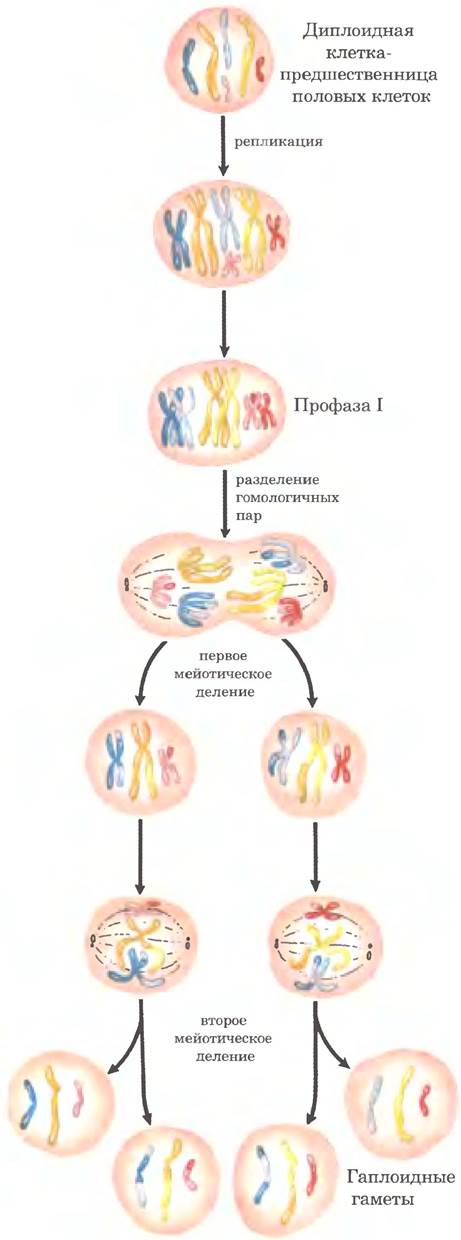
У эукариот гомологичная генетическая рекомбинация выполняет несколько функций в процессах репликации и деления клеток, включая репарацию застопорившихся репликативных вилок. Чаще всего рекомбинация происходит в ходе мейоза — процесса, с помощью которого зародышевые клетки с двойным набором хромосом делятся с образованием гаплоидных гамет (сперматозоидов или яйцеклеток у животных или гаплоидных спор у растений); каждая гамета получает по одной хромосоме из каждой пары (рис. 25-31). Мейоз начинается с репликации ДНК в родительской клетке, так что в какой-то момент каждая молекула ДНК присутствует в четырех копиях. Затем клетки проходят две стадии клеточного деления без промежуточной стадии репликации ДНК. В результате в каждой гамете оказывается гаплоидное количество ДНК.
Рис. 25-31. Мейоз в зародышевой линии клеток животных. Хромосомы гипотетической диплоидной клетки зародышевой линии (шесть хромосом; три пары гомологов) реплицируются и остаются соединенными центромерами. Реплицированные двухцепочечные молекулы ДНК называются хроматидами (сестринские хроматиды). В профазе I непосредственно перед первым мейотическим делением три набора гомологичных хроматид выстраиваются в линию с образованием тетрад и остаются соединенными вместе ковалентными связями в местах гомологичных соединений (хиазм). В хиазмах происходит кроссинговер (рис. 25-32). Такие временные ассоциации между гомологами обеспечивают правильность расхождения хромосом на следующей стадии, когда они смещаются к противоположным полюсам делящейся клетки в первом мейотическом делении. Продуктами такого деления являются две дочерние клетки, каждая из которых содержит по три пары хроматид. Затем пары выстраиваются на экваторе клетки и подготавливаются к разделению хроматид (теперь они называются хромосомами). В результате второго мейотического деления образуются четыре гаплоидные дочерние клетки, которые могут выступать в роли гамет. Каждая из этих клеток содержит по три хромосомы — половинный набор диплоидной клетки-предшественницы. Хромосомы подверглись перераспределению и рекомбинации.
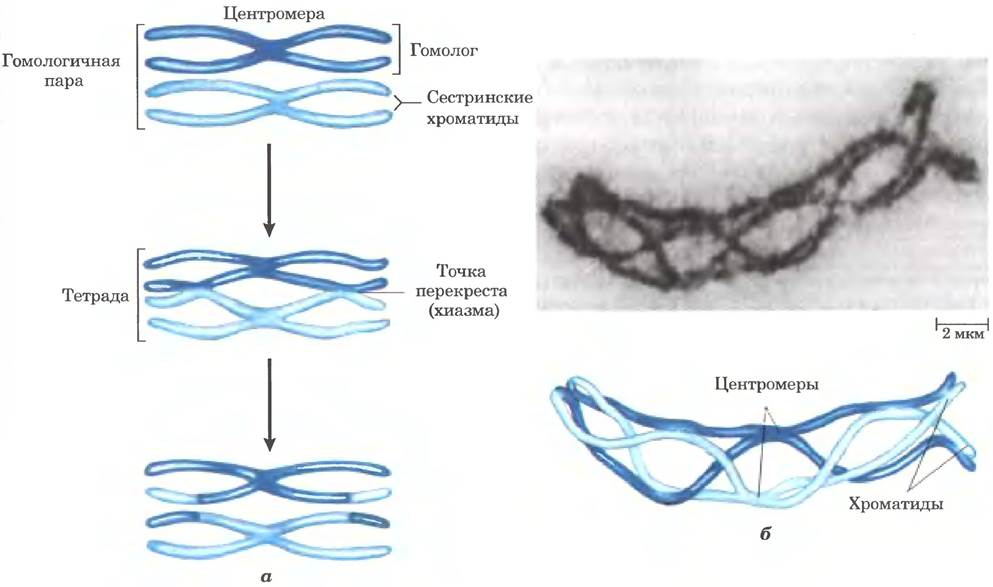
После репликации ДНК в профазе первого мейотического деления образовавшиеся сестринские хроматиды остаются связанными своими центромерами. На этой стадии каждый набор из четырех гомологичных хромосом (тетрада) существует в виде двух пар хроматид. Между тесно связанными гомологичными хроматидами происходит обмен генетической информацией путем гомологичной генетической рекомбинации, в ходе которой происходят разрывы и воссоединение последовательностей ДНК (рис. 25-32). Этот процесс, который иначе называют кроссинговером, можно наблюдать в световой микроскоп. Кроссинговер связывает вместе две пары сестринских хроматид в точках, называемых хиазмами.
Рис. 25-32. Кроссинговер. а — кроссинговер часто приводит к обмену генетическим материалом. б — гомологичные хромосомы кузнечиков показаны на стадии профазы I мейоза. Между двумя гомологичными парами хроматид видно несколько точек контакта (хиазм). Эти хиазмы ясно указывают на произошедшую перед этим гомологичную рекомбинацию (кроссинговер).
Кроссинговер эффективно физически связывает вместе все четыре гомологичные хроматиды, что важно для правильного расхождения хромосом в последующих мейотических клеточных делениях. Совершенно ясно, что кроссинговер - неслучайный процесс, его «горячие точки» были обнаружены на многих эукариотических хромосомах. Однако представление о том, что кроссинговер может происходить почти в любой точке гомологичных хромосом, вполне допустимо как приближение при генетическом картировании. Вероятность гомологичной рекомбинации на любом участке, разделяющем две точки на хромосоме, примерно пропорциональна расстоянию между этими точками, и это позволяет определить относительное положение генов и расстояние между разными генами.
Итак, гомологичная рекомбинация, выполняет по меньшей мере три функции: (1) она используется в репарации нескольких типов повреждений ДНК; (2) в эукариотических клетках она обеспечивает временную физическую взаимосвязь между хроматидами, необходимую для точного расхождения хромосом на первой стадии мейотического деления; и (3) усиливает генетическое разнообразие в популяции.
Рекомбинация в ходе мейоза начинается с двухцепочечных разрывов
Возможный путь гомологичной рекомбинации в ходе мейоза рассмотрен на рис. 25-33, а. В этой модели отражены четыре ключевых момента. Во-первых, гомологичные хромосомы выравниваются. Во-вторых, экзонуклеаза увеличивает двухцепочечный разрыв в молекуле ДНК. оставляя одноцепочечные участки с 3'-гидроксильной группой на конце (стадия ①). В-третьих, эти 3'-концы захватывают интактную дуплексную ДНК гомолога, после чего происходит миграция ветви (рис. 25-34) и/или репликация для создания пары кроссинговерных структур (структур Холлидея; рис. 25-33, а, стадии ②-④). В-четвертых, расщепление двух таких структур приводит к образованию двух конечных рекомбинантных продуктов (стадия ⑤).
Рис. 25-33. Рекомбинация в ходе мейоза. а — модель репарации двухцепочечного разрыва в ходе гомологичной генетической рекомбинации. Две гомологичные хромосомы (одна показана голубым, другая красным цветом), участвующие в рекомбинации, имеют похожие последовательности. Каждый из двух показанных генов присутствует на двух хромосомах в виде разных аллелей. Стадии процесса описаны в тексте, б — между двумя бактериальными плазмидами in vivo образовалась структура Холлидея; фотография сделана с помощью электронного микроскопа. Эти структуры названы в честь Робина Холлидея, впервые предсказавшего их существование в 1964 г.
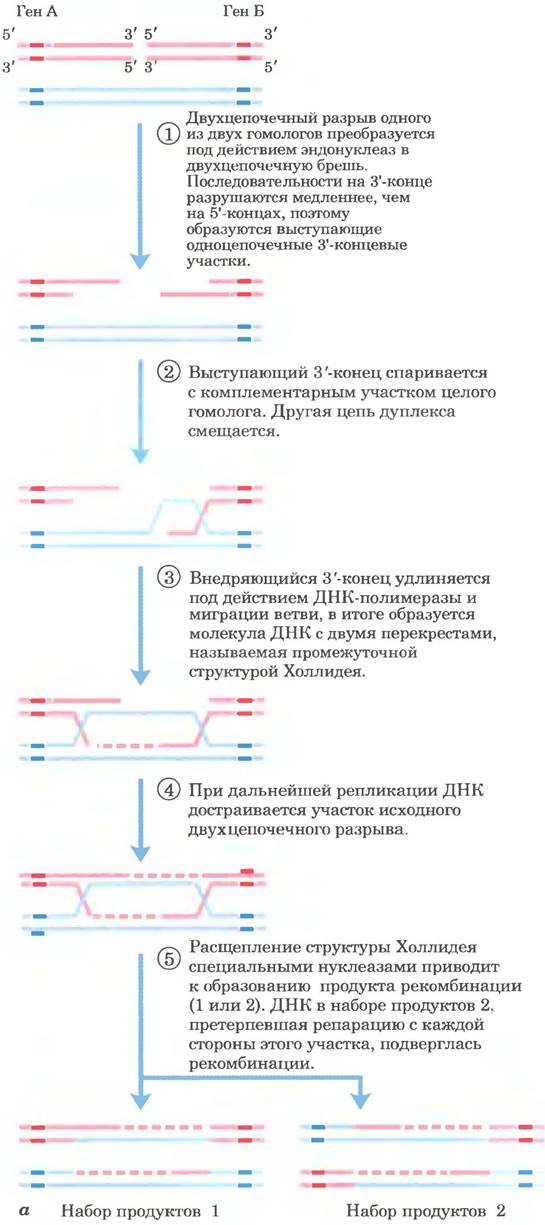
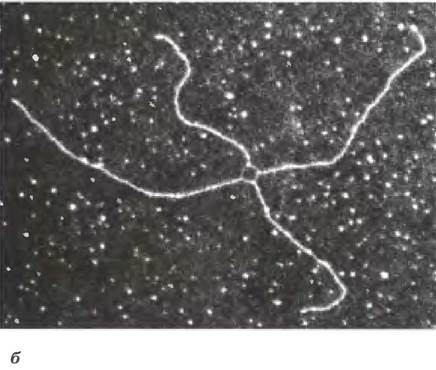
В данной модели репарации двухцепочечных разрывов 3'-концы выполняют функцию инициаторов генетического обмена при рекомбинации. При их спаривании с комплементарной цепью интактного гомолога создается область гибридной ДНК, которая содержит комплементарные цепи от двух разных родительских ДНК (продукт стадии ② на рис. 25-33, а). Затем каждый и 3'-концов может действовать в качестве праймера для репликации ДНК. Образующиеся при этом структуры, называемые структурами Холлидея (рис. 25-33, б), — признак гомологичной генетической рекомбинации во всех организмах.
У разных видов гомологичная рекомбинация может различаться только в некоторых деталях, большинство же описанных выше стадий обычно присутствует в том или ином виде. Существуют два способа расщепления, или «разрешения», структуры Холлидея, приводящие к тому же порядку расположения генов после рекомбинации, что и в исходных хромосомах (стадия (⑤ на рис. 25-33, а). При одном способе расщепления область, фланкирующая гибридную ДНК, оказывается рекомбинантной; при другом способе - нерекомбинантной. Оба результата наблюдаются in vivo у эукариот и прокариот.
Гомологичная рекомбинация, изображенная на рис. 25-33, — сложный процесс, который вносит вклад в генетическое разнообразие. Чтобы понять, каким образом это происходит, следует вспомнить, что две подвергающиеся рекомбинации гомологичные хромосомы не обязательно идентичны. Линейный порядок генов в них может быть одинаковым, но в некоторых генах последовательности оснований могут незначительно отличаться (в разных аллелях). Например, у человека одна хромосома может содержать аллель гемоглобина А (обычный гемоглобин), а другая — аллель гемоглобина S (серповидно-клеточная мутация). Различие может быть всего в одной паре оснований на миллион. Гомологичная рекомбинация не изменяет линейного порядка генов, но она может определять, какие аллели окажутся связанными друг с другом в одной хромосоме и вместе передадутся следующему поколению.
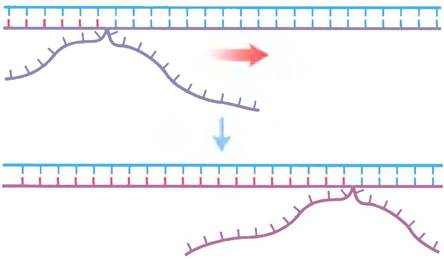
Рис. 25-34. Миграция ветви. Когда матричная цепь спаривается с двумя разными комплементарными цепями, в точке соединения трех цепей образуется разветвление. Это разветвление «мигрирует» по мере того, как нарушается спаривание между основаниями в комплементарных цепях и возникает спаривание между одной из комплементарных цепей и новой цепью. В отсутствие направляющего фермента ветвь может двигаться самопроизвольно в любом направлении. Такая самопроизвольная миграция ветви продолжается до тех пор, пока в одной из комплементарных цепей не встречается неидентичная последовательность.
В рекомбинации участвует множество ферментов и других белков
Ферменты, стимулирующие разные стадии гомологичной рекомбинации, были выделены как у прокариот, так и у эукариот. У Е. coli гены rесВ, rесС и recD кодируют гетеротримерный фермент recBCD, который проявляет и хеликазную, и нуклеазную активности. Белок RecA стимулирует все ключевые стадии гомологичной рекомбинации: спаривание двух ДНК, образование промежуточных структур Холлидея и миграцию ветви (как описано ниже). Белки RuvA и RuvB (от англ. repair of UV damage) образуют комплекс, который связывается с промежуточными структурами Холлидея, вытесняют белок RecA и стимулируют миграцию ветви с большей скоростью, чем это делает белок RecA. Нуклеазы, которые специфически разделяют структуры Холлидея, часто называют резолвазами; они были выделены из бактерий и дрожжей, белок RuvC — один из двух, по меньшей мере, таких нуклеаз у Е. coli.
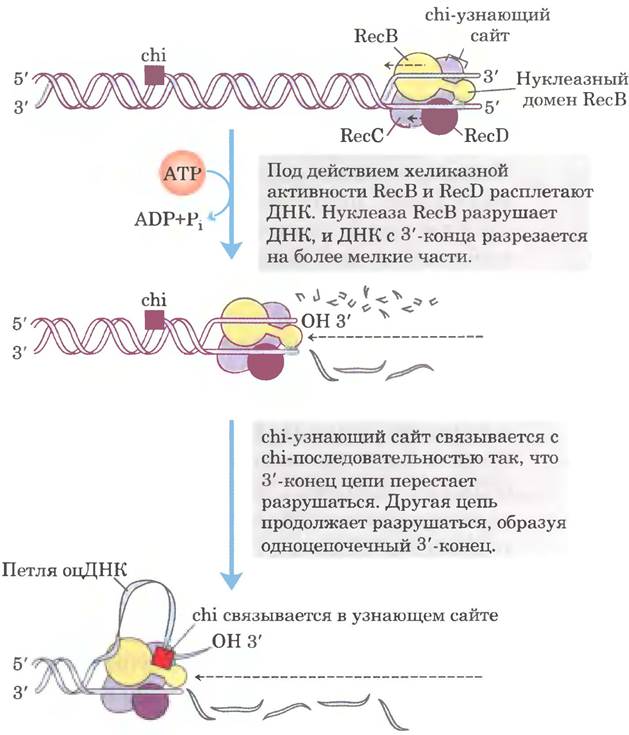
Фермент RecBCD связывается с линейной ДНК со стороны свободного (расщепленного) конца и движется вдоль двойной спирали, раскручивая и расщепляя ДНК в реакции, сопряженной с гидролизом АТР (рис. 25-35). Субъединицы RecB и RecD — это моторы геликазы: RecB движется по одной цепи в направлении 3' —> 5', a RecD — по другой цепи в направлении 5' —> 3'. Активность фермента изменяется, когда он взаимодействует с последовательностью (5') GCTGGTGG, называемой сhi-последовательностью. С этого момента расщепление цепи со свободным 3'-концом существенно замедляется, а разрушение цепи со свободным 5'-концом ускоряется. В результате образуется одноцепочечная ДНК со свободным 3'-концом, которая используется в последующих стадиях рекомбинации (рис. 25-33). В геноме Е. coli рассредоточено 1009 сhi-последователыюстей, которые в 5-10 раз повышают частоту рекомбинации па расстояниях до 1000 п. н. вокруг. По мере удаления от chi-последовательности их влияние ослабевает. У некоторых других организмов тоже были идентифицированы последовательности, увеличивающие частоту рекомбинации.
Рис. 25-35. Хеликазная и нуклеазная активности фермента RecBCD. Начиная с двухцепочечного конца, RecBCD раскручивает и расщепляет последовательность ДНК. Нуклеазный домен субъединицы RecB располагается так, что может разрушать либо одну цепь ДНК, либо другую. Субъединица RecB движется в направлении 3' —> 5' по одноцепочечной ДНК со свободным 3'-концом, действуя как АТР-зависимая хеликаза. Субъединица RecD сходным образом движется по второй цепи в направлении 5' —> 3'. Активный центр субъединицы RecC узнает и связывает chi-последовательности. Цепь, содержащая chi-последовательность, образует петлю, и для нуклеазного домена RecB остается доступной только цепь со свободным 5'-концом. Предполагается, что RecBCD инициирует генетическую рекомбинацию у Е. coli. Он также участвует в репарации двухцепочечных разрывов в местах разрушения репликативных вилок.
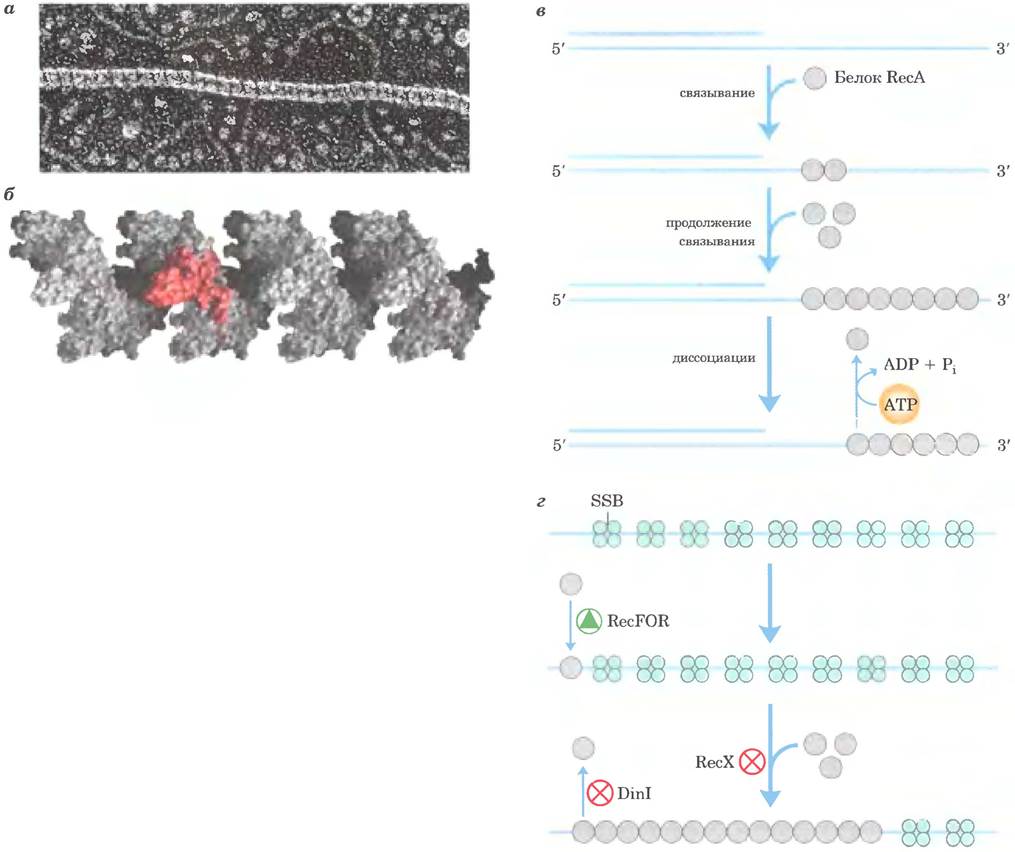
Белок RecA выделяется среди других белков метаболизма ДНК тем, что его активная форма представляет собой упорядоченную спиральную нить, содержащую до нескольких тысяч мономеров RecA, которые собираны вместе на ДНК (рис. 25-36). Нить белка RecA в норме образуется на одноцепочечной ДНК, например, под действием фермента RecBCD, но также может быть собирана на двухцепочечной ДНК с одноцепочечной брешью; в этом случае первые мономеры RecA связываются с одноцепочечной ДНК в бреши, после чего образующаяся нить быстро закручивается вокруг прилегающей дуплексной ДНК. Сборку и разборку нитей RecA регулируют другие белки, включая RecX, DinI, RecF, RecO и RecR.
Рис. 25-36. Белок RecA. а — нуклеопротеиновый комплекс белка RecA с одноцепочечной ДНК (электронная микрофотография). Поперечные черточки свидетельствуют о том, что структура нити имеет вид правозакрученной спирали, б — объемная модель нити из 24 субъединиц RecA. Нить содержит шесть субъединиц на виток. Одна субъединица окрашена в красный цвет, чтобы ее можно было разглядеть на фоне остальных (по PDB ID 2REB). в — после лимитирующей стадии посадки комплекса RecA на одноцепочечной ДНК нити удлиняются в направлении 5' —> 3'. Разборка происходит также в направлении 5' —> 3' со стороны, противоположной приращению цепи, г — в сборке нитей участвуют белки RecF. RecO и RecR (общее обозначение RecFOR). Белок RecX ингибирует удлинение нитей RecA. Белок DinI стабилизирует RecA, предотвращая разборку.
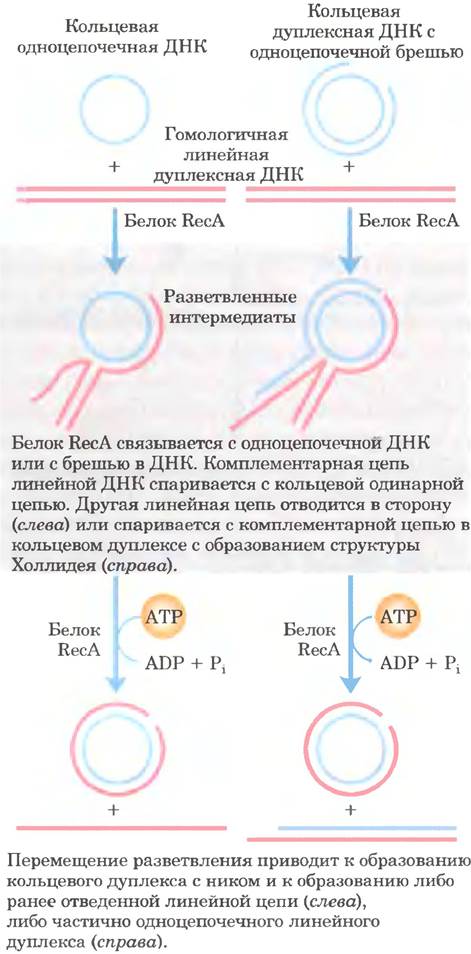
Роль нити RecA в рекомбинации можно проиллюстрировать на модели замены цепи ДНК in vitro (рис. 25-37). Сначала RecA связывает одиночную цепь ДНК с образованием нуклеопротеиновой нити. Затем нить RecA захватывает гомологичную двухцепочечную ДНК и соединяет ее со связанной одиночной цепью. Для образования активной нити RecA, которая соединяет две молекулы ДНК, необходимо связывание (но не гидролиз) АТР. После этого две молекулы ДНК обмениваются цепями, и в результате возникает гибридная ДНК. Обмен происходит со скоростью 6 п. н./с в направлении 5' —> 3' относительно одноцепочечной ДНК в составе нити RecA. В этой реакция могут участвовать три или четыре цепи ДНК (рис. 25-37); в последнем случае в ходе процесса образуются структуры Холлидея.
Рис. 25-37. Обмен цепей ДНК, индуцируемый белком RecA in vitro. Замена цепи включает отделение одной цепи дуплекса от комплементарной цепи и ее перенос на другую комплементарную цепь для формирования нового дуплекса (гетеродуплекса) ДНК. В этом процессе образуется разветвленная промежуточная структура. Образование конечного продукта зависит от миграции ветви, которой способствует RecA. В реакции могут участвовать три цепи (слева) или при взаимообмене между двумя гомологичными дуплексами четыре цепи (справа). В последнем случае интермедиат представляет собой структуру Холлидея. Белок RecA способствует миграции ветви, используя энергию гидролиза АТР.
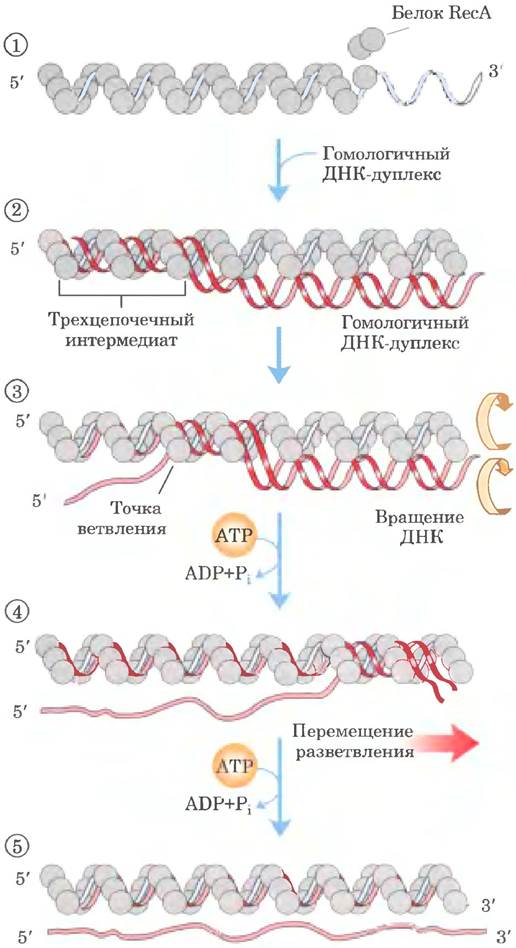
Когда ДНК-дуплекс включается в состав нити RecA и выравнивается рядом со связанной одиночной цепыо ДНК на участке протяженностью в сотни пар оснований, одна из цепей дуплекса может поменять партнера (рис. 25-38, стадия ②). Поскольку ДНК обладает спиральной структурой, непрерывный обмен цепей требует упорядоченного вращения двух соседних ДНК. Это осуществляется путем перемотки (стадии ③ и ④), в результате чего точка ветвления смещается вдоль спирали. Заключительные стадии обмена цепей ДНК, во время которых происходит удлинение гибридной ДНК, образовавшейся на первой стадии, происходят за счет гидролиза АТР. Механизм сопряжения реакций пока неясен.
Рис. 25-38. Модель RecA-опосредованного обмена цепей ДНК. Показана реакция с участием трех цепей ДНК. Размер шариков, которыми обозначены молекулы белка RecA, непропорционально мал по сравнению с толщиной ДНК, что позволяет продемонстрировать происходящие в ДНК изменения. ① Белок RecA образует спираль вокруг одноцепочечной ДНК. ② В комплекс включается гомологичный ДНК-дуплекс. ③ По мере того, как в результате вращения начало трехцепочечного участка смещается слева направо, одна из цепей дуплекса занимает место одиночной цепи, исходно связанной с нитью белка. Другая цепь дуплекса вытесняется, а внутри нити белка формируется новый дуплекс. По мере продолжения вращения (④ и ⑤) вытесненная цепь полностью высвобождается. В данной модели гидролиз АТР белком RecA приводит к повороту двух молекул ДНК относительно друг друга и тем самым продвигает обмен цепей в направлении слева направо.
После образования структуры Холлидея для завершения рекомбинации необходима целая группа ферментов: топоизомеразы, белок миграции витка RuvAB, резолваза и другие нуклеазы, ДНК-полимераза I или III и ДНК-лигаза. В клетках Е. coli белок RuvC (Мr = 20 000) расщепляет структуры Холлидея с образованием полноразмерных неразветвленных хромосом.
Для репарации заблокированных репликативных вилок используются все возможности метаболизма ДНК
Как и во всех других клетках, у бактерий уровень повреждений ДНК достаточно высокий даже в нормальных условиях роста. Большинство повреждений ДНК быстро репарируется путем эксцизионной репарации оснований, нуклеотидов и другими описанными ранее способами. Тем не менее почти каждая бактериальная репликативная вилка наталкивается на нерепарированное повреждение ДНК или разрыв на пути от точки начала репликации до точки ее окончания (рис. 25-30). ДНК-полимераза III не может пройти мимо многих типов повреждений ДНК, что вынуждает ее оставить эти повреждения в виде одноцепочечной бреши. Когда полимераза встречается с разрывом цепи ДНК, возникает двухцепочечный разрыв. В обеих ситуациях необходима рекомбинационная репарация ДНК (рис. 25-39). В нормальных условиях роста застопорившиеся репликативные вилки реактивируются с помощью сложного пути репарации, включающего рекомбинационную репарацию ДНК, повторный старт репликации и репарацию всех пропущенных повреждений. В этом процессе объединяются все пути метаболизма ДНК.
Рис. 25-39. Модели рекомбинационной репарации для восстановления застопорившихся репликативных вилок. Репликативная вилка застопоривается при столкновении с повреждением ДНК (слева) или с разрывом ДНК (справа). Для воссоздания разветвленной структуры ДНК в репликативной вилке необходимы ферменты рекомбинации, облегчающие обмен цепями ДНК. Одноцепочечные разрывы устраняются с помощью белков RecF, RecO и RecR. Двухцепочечные разрывы требуют участия фермента RecBCD. В обоих процессах задействован белок RecA. Промежуточные продукты рекомбинации процессируются благодаря активности дополнительных ферментов (например, для разрешения структур Холлидея нужны белки RuvA, RuvB и RuvC). Повреждения в двухцепочечной ДНК восстанавливаются с помощью эксцизионной репарации нуклеотидов или другими способами. Репликативная вилка перестраивается с привлечением ферментов, катализирующих повторный старт репликации, независимый от точки начала репликации, и репликация хромосомы завершается. Весь процесс требует точной координации всех путей метаболизма бактериальной ДНК.
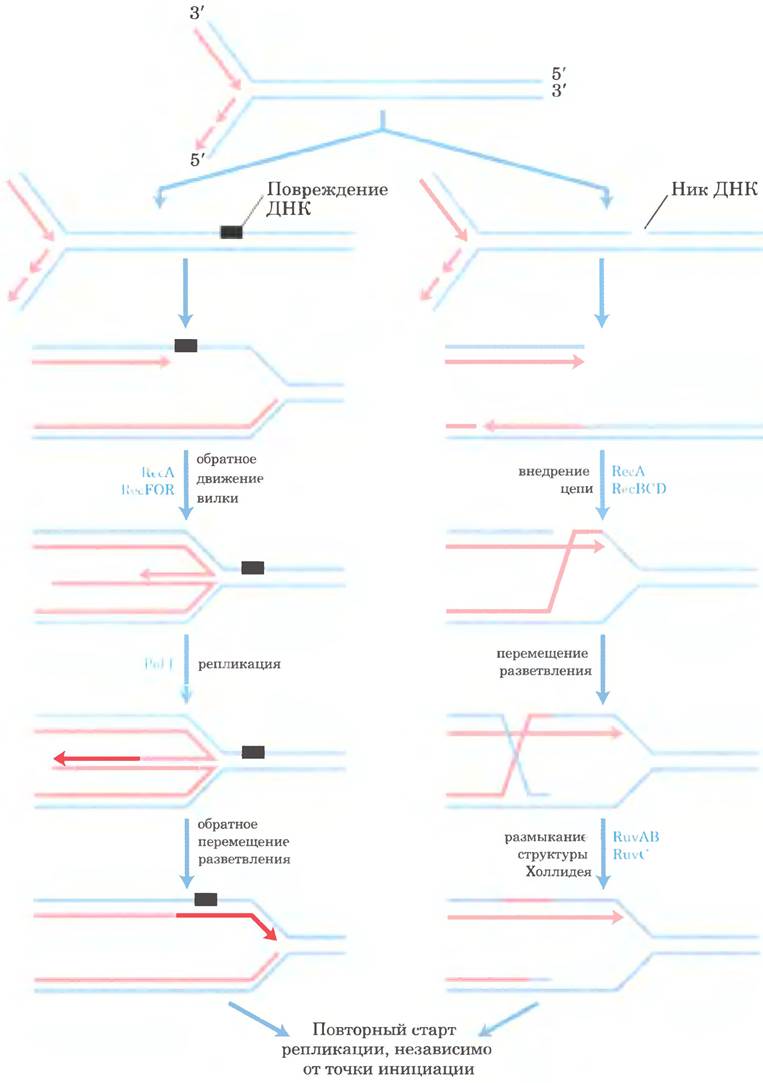
Остановившаяся репликативная вилка может быть снова запущена по меньшей мере двумя сложными способами, для каждого из которых требуется белок RecA. Путь репарации повреждений, содержащих бреши в ДНК, задействует также белки RecF, RecO и RecR. Для репарации двухцепочечных разрывов необходим фермент RecBCD (рис. 25-39). После дополнительных стадий рекомбинации следует процесс, называемый возобновлением репликации, независимым от точки инициации репликации, когда с помощью комплекса из семи белков (PriA, В и С, а также DnaB, С, G и Т) снова собирается репликативная вилка. Этот комплекс, первоначально открытый в процессе репликации ДНК фага φХ174 in vitro, теперь называется праймосомой восстановления репликации. Для восстановления репликативной вилки необходима также ДНК-полимераза II, причем ее роль пока не установлена; активность ДНК-полимеразы II открывает дорогу ДНК-полимеразе III для репликации протяженных участков, что необходимо для завершения построения хромосомы. Иногда происходит возобновление репликации ниже точки повреждения еще до репарации поврежденного участка.
Репарация застопорившихся вилок предусматривает координированный переход между репликацией и рекомбинацией. Стадии рекомбинации нужны для заполнения бреши в ДНК или соединения разорванной цепи, чтобы воссоздать разветвленную структуру ДНК в репликативной вилке. Повреждения, оставшиеся позади дуплекса ДНК, устраняются при помощи эксцизионной репарации оснований или нуклеотидов. Таким образом, в репарации застопорившихся репликативных вилок участвует широкий круг ферментов, действующих на каждой стадии метаболизма ДНК. Этот способ репарации, очевидно, является главной функцией системы гомологичной рекомбинации в каждой клетке, и нарушения рекомбинационной репарации ДНК играют важную роль в возникновении заболеваний человека (доп. 25-1).
Сайт-специфическая рекомбинация приводит к точным перестройкам ДНК
Гомологичная генетическая рекомбинация, которую мы обсуждали, может происходить между любыми двумя гомологичными последовательностями. Второй тип рекомбинации, сайт- специфическая рекомбинация, принципиально отличается тем, что ограничивается только специфическими последовательностями. Реакции рекомбинации данного типа происходят почти в каждой клетке, и их функции различны в разных видах организмов. Например, таков механизм регуляции экспрессии некоторых генов и механизм активации программируемых перестроек ДНК при эмбриональном развитии или в циклах репликации некоторых вирусных и плазмидных ДНК. Каждая система сайт-специфической рекомбинации состоит из фермента рекомбиназы и короткой (от 20 до 200 п. н.) уникальной последовательности ДНК, с которой взаимодействует рекомбиназа (сайт рекомбинации). Ход и результат реакции регулирует один или несколько вспомогательных белков.
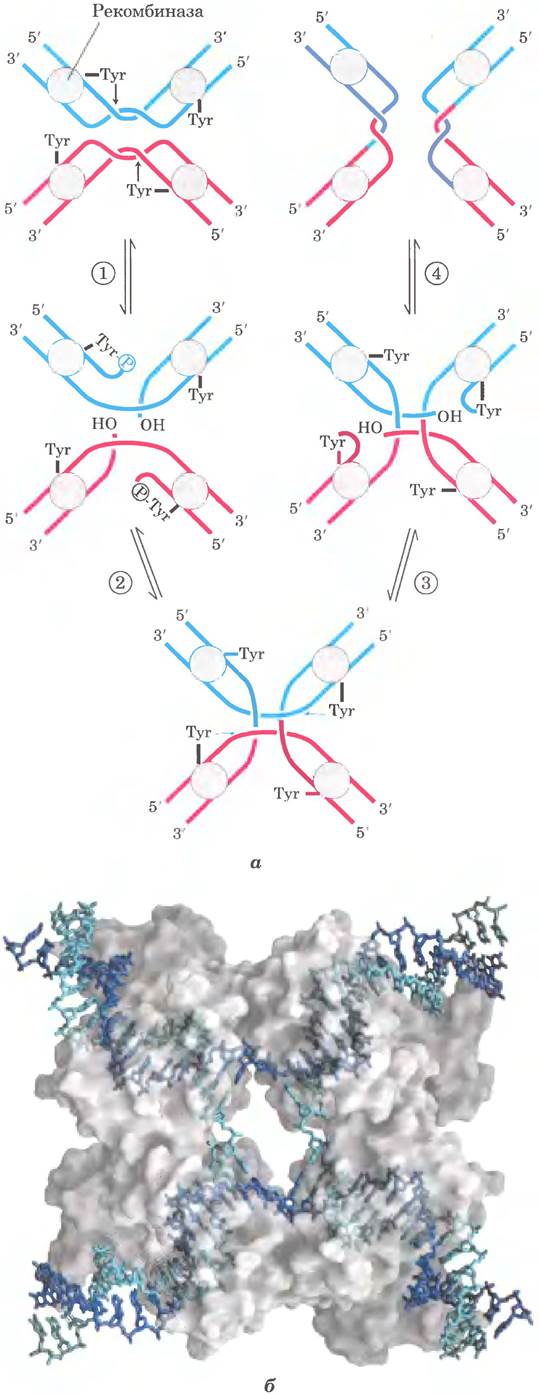
Существуют два основных класса систем сайт-специфической рекомбинации, различающихся наличием в активном центре ферментов остатков Туr или Ser. При изучении многих систем сайт-специфической рекомбинации тирозинового класса in vitro удалось выявить основные механизмы и общие принципы процесса (рис. 25-40, а). Некоторые из ферментов были получены в кристаллической форме, что позволило детально исследовать их структуру. Выделенная рекомбиназа распознает и связывает каждый из двух сайтов рекомбинации на двух разных молекулах ДНК или в одной и той же ДНК. В каждом сайте одна цепь ДНК расщепляется в специфической точке, после чего рекомбиназа ковалентно связывается с ДНК в месте расщепления через фосфотирозиновую связь (стадия ①). Временная связь белок -ДНК сохраняет фосфодиэфирную связь, которая утрачивается при расщеплении ДНК, поэтому на последующих стадиях не требуются богатые энергией кофакторы, такие как АТР. Расщепленные цепи ДНК соединяются с новыми партнерами с образованием структуры Холлидея, в которой новые фосфодиэфирные связи создаются за счет связи белок-ДНК (стадия ②). Для завершения реакции процесс должен повториться во второй точке в каждом из двух сайтов рекомбинации (стадии ③ и ④). В системах с остатком Ser в активном центре обе цепи в каждом сайте рекомбинации одновременно разрезаются и заново объединяются в новые пары без образования структур Холлидея. Но в обоих случаях обмен всегда обоюдный и точный, и при завершении реакции сайты рекомбинации восстанавливаются. Рекомбиназа, таким образом, выступает в качестве сайт-специфической эндонуклеазы и лигазы одновременно.
Рис. 25-40. Реакция сайт-специфической рекомбинации. а — показанная здесь реакция характерна для сайт-специфических рекомбиназ класса интеграз (названы после открытия интегразы бактериофага λ — первой описанной рекомбиназы). Этот фермент имеет в активном центре остатки Туг, которые играют роль нуклеофилов. Рекомбиназа представляет собой тетрамер, состоящий из идентичных субъединиц, которые связываются со специфической последовательностью — сайтом рекомбинации. ① Одна цепь каждой молекулы ДНК разрезается в определенных точках этой последовательности. Нуклеофильным агентом является группа -ОН остатка тирозина в активном центре, и в результате реакции возникает ковалентная фосфотирозиновая связь между белком и ДНК. ② Расщепленные цепи связываются с новыми партнерами, образуя структуру Холлидея. Завершающие стадии ③ и ④ напоминают две первые. Исходная последовательность сайта рекомбинации восстанавливается после рекомбинации ДНК, фланкирующей сайт. Эти стадии происходят при участии муль- тисубъединичного комплекса рекомбиназы, а иногда и других, не показанных здесь белков, б — объемная модель четырехсубъединичной Сrе-рекомбиназы класса интеграз, связанной с структурой Холлидея (изображена в виде голубых и синих спиралей). Белок изображен прозрачным, чтобы сквозь него была видна ДНК (по PDB ID 3CRX). В активном центре рекомбиназ, относящихся к семейству резолваз-инвертаз, роль нуклеофила исполняет остаток серина.
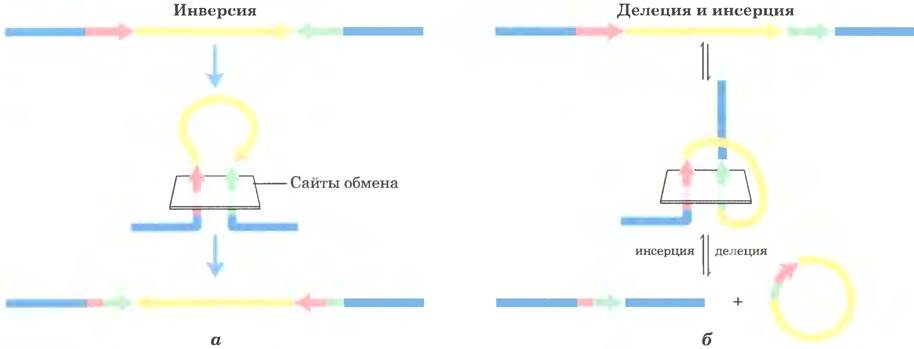
Последовательности сайтов рекомбинации, распознаваемые сайт-специфическими рекомбиназами, частично асимметричны (не являются палиндромами); в ходе реакции два сайта рекомбинации выстраиваются в одной и той же ориентации. Результат зависит от локализации и ориентации сайтов рекомбинации (рис. 25-41). Если два сайта находятся в одной и той же молекуле ДНК, реакция либо инвертирует, либо делетирует промежуточную ДНК в зависимости от того, имеют сайты рекомбинации противоположную или одинаковую ориентацию соответственно. Если сайты расположены на разных молекулах ДНК, рекомбинация становится межмолекулярной; если одна или обе ДНК кольцевые, происходит инсерция. Некоторые рекомбиназные системы специфичны для одного из этих типов реакций и действуют только на сайты в определенной ориентации.
Рис. 25-41. Результат сайт-специфической рекомбинации. Результат сайт-специфической рекомбинации зависит от локализации и ориентации сайтов рекомбинации (красные и зеленые) в молекуле двухцепочечной ДНК. В данном случае под ориентацией (показана стрелками) понимают порядок расположения нуклеотидов в сайте рекомбинации, а не направление 5' —> 3'. а — сайты рекомбинации с противоположной ориентацией в одной и той же молекуле ДНК. В результате происходит инверсия, б — сайты рекомбинации с одинаковой ориентацией, расположенные в одной молекуле ДНК (результат — делеция) или в двух молекулах ДНК (результат — инсерция).
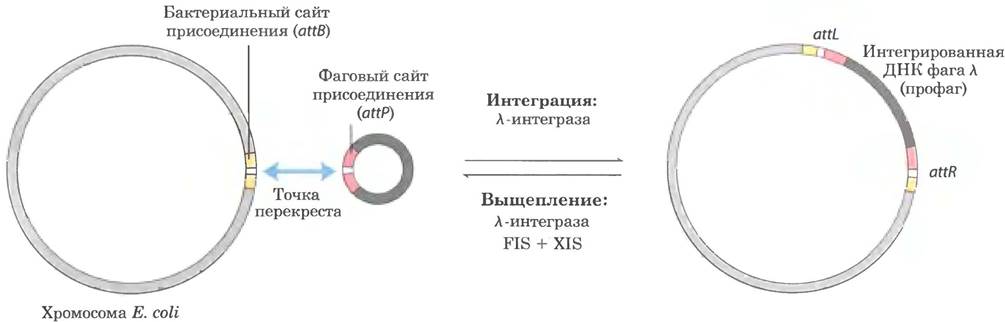
Первой исследованной in vitro системой сайт-специфической рекомбинации была система, колируемая бактериофагом λ. Когда ДНК фага λ попадает в клетку Е. coli, сложная регулируемая последовательность стадий приводит к одному из двух результатов. Либо ДНК фага реплицируется и образует больше бактериофагов (разрушающих клетку хозяина), либо она встраивается в хромосому хозяина (в виде профага) и пассивно реплицируется в составе хромосомы на протяжении многих клеточных генераций. Интеграцию осуществляет кодируемая фагом рекомбиназа (λ-интеграза), которая действует в сайтах рекомбинации в фаговой и бактериальной ДНК - - в сайтах присоединения attP и attB соответственно (рис. 25-42). Роль сайт-специфической рекомбинации в регуляции экспрессии рассматривается в гл. 28.
Рис. 25-42. Интеграция и выщепление ДНК бактериофага λ в специфическом сайте хромосомы. Сайт присоединения в ДНК фага λ (attP) имеет лишь 15 п. н., полностью гомологичных нуклеотидам в бактериальной ДНК (attB) в области перекреста. В результате реакции образуются два новых сайта присоединения (attR и attL) с двух сторон от интегрированной ДНК фага. Рекомбиназа фага является λ-интегразой (белок INT). Для интеграции и выщепления используются разные сайты присоединения и различные вспомогательные белки. В выщеплении участвуют белки XIS, кодируемые бактериофагом, и белки FIS, кодируемые бактериями. Для обеих реакций нужен белок IHF (от англ. integration host factor — клеточный фактор интеграции), кодируемый бактериями.
Для полной репликации хромосомы может потребоваться сайт-специфическая рекомбинация
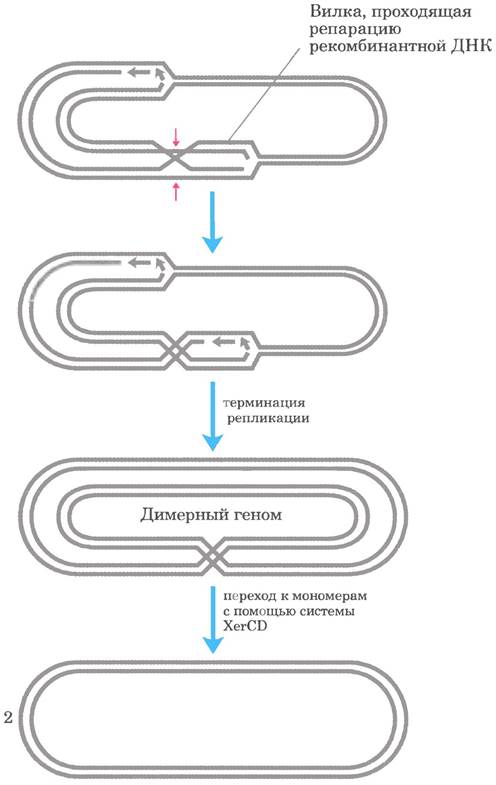
При рекомбинационной репарации ДНК кольцевой бактериальной хромосомы иногда образуются вредные побочные продукты. При разрешении структуры Холлидея с помощью нуклеазы, например, RuvC, и последующем завершении репликации могут образоваться либо две обычные мономерные хромосомы, либо сцепленная димерная хромосома (рис. 25-43). В последнем случае ковалентно связанные хромосомы не могут при клеточном делении разойтись в дочерние клетки, и деление клетки блокируется на этой стадии цикла. У Е. coli существует специальная система сайт-специфической рекомбинации XerCD, которая превращает димерные хромосомы в мономерные и обеспечивает нормальное клеточное деление. Эта сайт-специфическая делеция (рис. 25-41, 6) является еще одним примером тесной связи между рекомбинацией ДНК и другими процессами метаболизма ДНК.
Рис. 25-43. Делеция ДНК для ликвидации опасных последствий рекомбинационной репарации ДНК. Разрешение структуры Холлидея в ходе рекомбинационной репарации ДНК (места расщепления указаны красными стрелками) может приводить к образованию димерной хромосомы. У Е. coli специализированная сайт- специфическая рекомбиназа XerCD превращает димер в мономеры, способствуя расхождению хромосом и нормальному клеточному делению.
Подвижные генетические элементы перемещаются из одного участка ДНК в другой
Теперь рассмотрим третий важный тип рекомбинации, при котором происходит перенос подвижных элементов, или транспозонов. Эти участки ДНК, обнаруженные практически во всех клетках, движутся или «прыгают» из одной точки хромосомы (донорский сайт) в другую точку на той же или другой хромосоме (целевой сайт). Гомология последовательностей ДНК не обязательное условие для этого перемещения, называемого транспозицией; новое расположение транспозона определяется более или менее случайно. Встраивание транспозона в ген может привести к гибели клетки, поэтому транспозиция жестко регулируется и обычно происходит очень редко. Вероятно, транспозоны - самые простые молекулярные паразиты, которые приспособились к пассивной репликации в хромосомах клеток хозяина. В некоторых случаях они несут гены, полезные для клетки хозяина, и, таким образом, существуют в симбиотической связи с ней.
У бактерий есть два класса транспозонов. Инсерционные последовательности(IS- элементы или простые транспозоны) содержат только последовательности, необходимые для транспозиции, и гены белков (транспозаз), которые осуществляют этот процесс. Сложные транспозоны содержат один или несколько дополнительных генов помимо тех, которые необходимы для транспозиции. Эти избыточные гены могут, например, отвечать за устойчивость к антибиотикам и тем самым повышать вероятность выживания клетки хозяина. Транспозиция — одна из причин распространения устойчивости к антибиотикам в популяциях бактерий, вызывающих болезни, в результате чего применение некоторых антибиотиков становится неэффективным (с. 10). ■
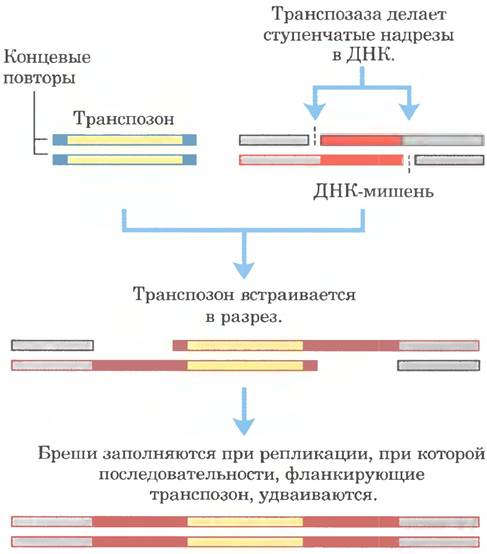
Бактериальные транспозоны различны по структуре, но большинство на каждом конце содержит короткие повторы, которые связывают транспозазы. При транспозиции короткая последовательность в целевом сайте (от 5 до 10 п. н.) удваивается с образованием дополнительного короткого повтора, который фланкирует встроенный транспозон с двух сторон (рис. 25-44). Эти повторы образуются благодаря расщеплению нуклеотидной последовательности и встраиванию транспозона на новом месте.
Рис. 25-44. Удвоение последовательности ДНК в целевом участке при встраивании транспозона. Удвоенные после встраивания транспозона последовательности показаны красным цветом. Обычно эти последовательности содержат только несколько пар оснований здесь их размер сильно увеличен по сравнению с размером типичного транспозона.
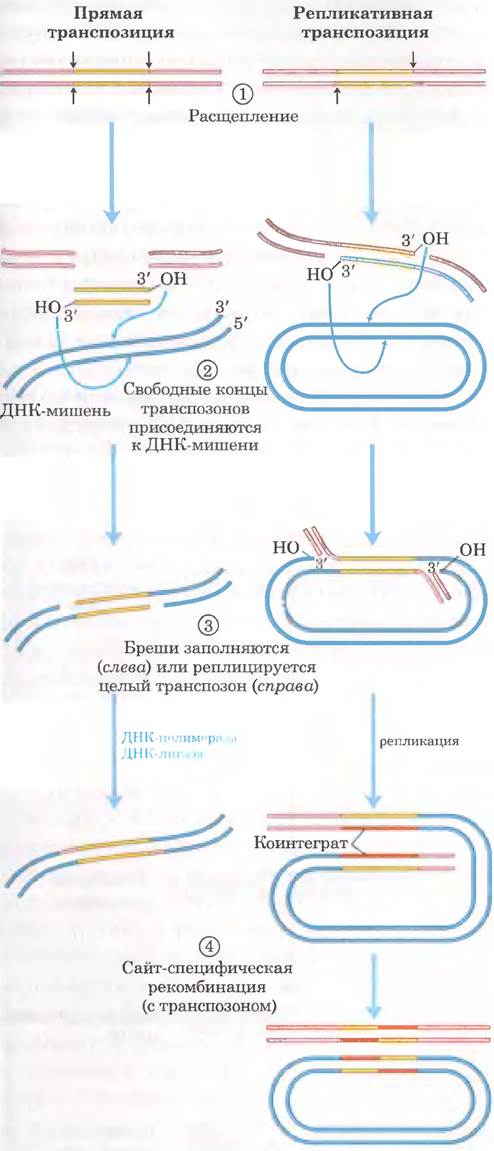
У бактерий существуют два основных пути транспозиции. При прямой (простой) транспозиции (рис. 25-45, слева) расщепление ДНК с двух сторон от транспозона приводит к его вырезанию, и транспозон перемещается на новое место. В ДНК донора остается двухцепочечный разрыв, который должен быть ликвидирован. В целевом сайте производится ступенчатый разрез (как на рис. 25-44), в который встраивается транспозон, а бреши заполняются в процессе репликации, что приводит к удвоению последовательности целевого сайта. При репликативной транспозиции (рис. 25-45, справа) реплицируется целый транспозон, оставляя в ДНК донора одну свою копию. Промежуточная структура, в составе которой имеется донор, ковалентно связанный с ДНК в целевом сайте, называется коинтегратом. В коинтеграте содержатся две полные копии транспозона в одинаковой ориентации. В случае некоторых хорошо изученных транспозонов промежуточное коинтегратное соединение превращается в продукты путем сайт-специфической рекомбинации, при которой делению осуществляют специализированные рекомбиназы.
Рис. 25-45. Два основных способа транспозиции: прямой (простой) и репликативный. ① Сначала происходит расщепление ДНК с каждой стороны от транспозона (стрелки). ② Освободившиеся 3'-гидроксильные группы на концах транспозона действуют как нуклеофилы, напрямую атакуя фосфодиэфирные связи в ДНК-мишени. Эти фосфодиэфирные связи располагаются в двух цепях ДНК ступенчато (не непосредственно друг под другом). ③ Транспозон связывается с ДНК-мишенью. При прямой транспозиции (слева) репликация заполняет бреши на каждом конце. При репликативной транспозиции (справа) реплицируется весь транспозон, и образуется коинтеграт. ④ Коинтеграт часто разрушается позднее с помощью особой системы сайт-специфической рекомбинации. Хозяйская ДНК, оставшаяся расщепленной после прямой транспозиции, либо восстанавливается путем соединения концов ДНК, либо разрушается (не показано). В последнем случае последствия могут быть летальными для организма.
У эукариот тоже есть транспозоны, которые по структуре напоминают бактериальные транспозоны, и некоторые из них используют похожий механизм транспозиции. Однако в других случаях в качестве посредников в транспозиции участвует РНК. Эволюция таких транспозонов имеет много общего с эволюцией определенных классов РНК-вирусов. И те, и другие подробнее рассматриваются в следующей главе.
Сборка генов иммуноглобулинов происходит путем рекомбинации
Некоторые перегруппировки ДНК запрограммированы в развитии эукариотических организмов. Важный пример — сборка полных генов иммуноглобулинов из отдельных сегментов в геномах позвоночных. Человек, как и другие млекопитающие, способен производить миллионы различных иммуноглобулинов (антител) с разной специфичностью. несмотря на то что геном человека содержит лишь около 29 000 генов. Рекомбинация позволяет организму образовывать необыкновенное разнообразие антител при ограниченных возможностях ДНК в кодировании информации. При исследовании механизмов рекомбинации была выявлена ее тесная связь с транспозицией ДНК; возможно, эта система обеспечения разнообразия антител возникла в глубокой древности как результат проникновения в клетки транспозонов.
Рассмотрим механизм создания разнообразных антител па примере человеческих генов, кодирующих иммуноглобулины G (IgG). Иммуноглобулины состоят из двух тяжелых и двух легких полипептидных цепей (см. рис. 5-21 в т. 1). Каждая цепь содержит две области: вариабельную с последовательностью, которая значительно отличается от одного иммуноглобулина к другому, и константную, фактически постоянную для данного класса иммуноглобулинов. Существуют также два разных семейства легких цепей — к- и λ-, которые несколько различаются последовательностями константных областей. Разнообразие вариабельных областей всех трех типов полипентидной цепи (тяжелой цепи, легких к- и λ-цепей) возникает по схожему механизму. Гены этих полипептидов делятся на сегменты, а геном содержит кластеры с множеством версий каждого сегмента. Соединение по одной версии каждого из сегментов создает полный ген.
На рис. 25-46 показана организация ДНК, кодирующей легкие к-цепи IgG человека; механизм образования зрелой легкой к-цепи объясняется именно организацией ДНК. В недифференцированных клетках информация об этой полипептидной цепи разделена на три сегмента. Сегмент V (вариабельный) кодирует первые 95 аминокислотных остатков вариабельной области, сегмент J (соединяющий) кодирует оставшиеся 12 остатков вариабельной области, а сегмент С кодирует константную область. Геном содержит примерно 300 вариантов сегмента V, четыре варианта сегмента J и один сегмент С.
Рис. 25-46. Рекомбинация V и J сегментов гена легкой к-цепи IgG человека. Данный процесс обеспечивает разнообразие антител. Вверху показана организация кодирующих последовательностей IgG в стволовой клетке костного мозга. При рекомбинации происходит удаление последовательности ДНК между определенным сегментом V и определенным сегментом J. После транскрипции происходит сплайсинг РНК-транскрипта, как описано в гл. 26. В ходе трансляции образуется легкая цепь, которая может комбинироваться с любой из 5000 возможных тяжелых цепей с образованием готового антитела.
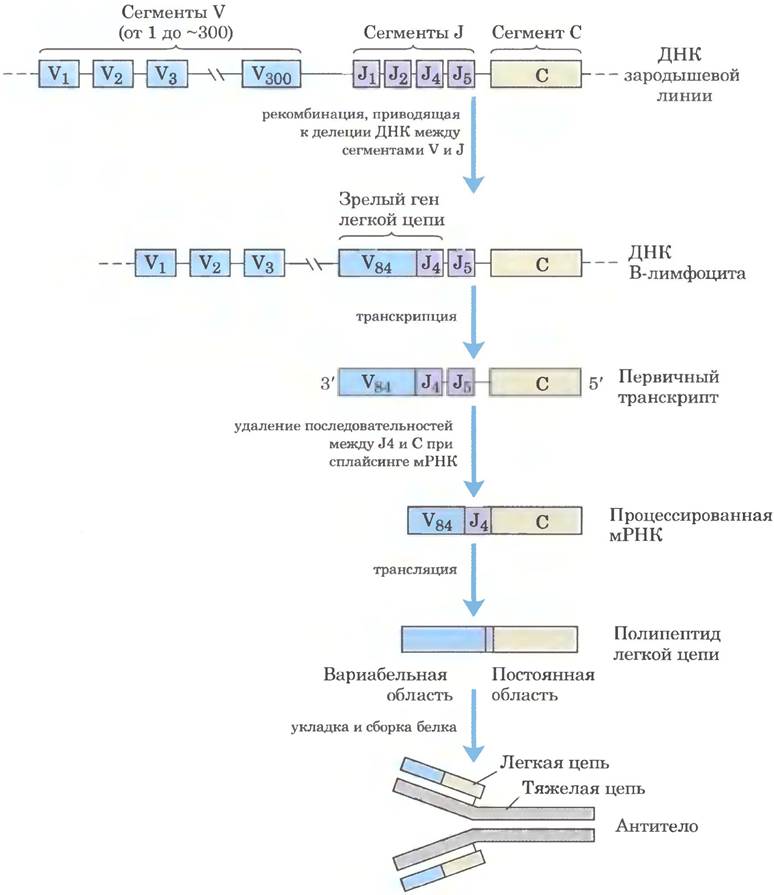
После дифференцировки стволовой клетки костного мозга в зрелый В-лимфоцит один сегмент V и один сегмент J соединяются с помощью специальной системы рекомбинации (рис. 25-46). В ходе этой запрограммированной делеции вся промежуточная ДНК отбрасывается. Существует примерно 300 • 4 = 1200 возможных комбинаций V-J. Процесс рекомбинации не так точен, как описанная выше сайт-специфическая рекомбинация, поэтому место соединения сегментов V и J может служить источником дополнительной вариабельности последовательности. Это увеличивает число возможных вариантов примерно в 2,5 раза, поэтому клетки могут образовывать примерно 2,5 • 1200 = 3000 различных комбинаций сегментов V-J. Наконец, после транскрипции процесс сплайсинга РНК приводит к соединению области V-J с областью С (эти процессы описаны в гл. 26).
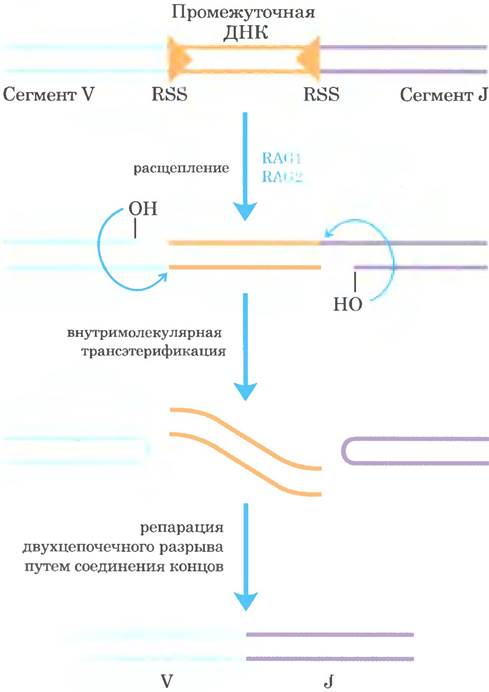
Механизм рекомбинации при соединении сегментов V и J показан на рис. 25-47. Непосредственно после каждого сегмента V и непосредственно перед каждым сегментом J находятся сигнальные последовательности рекомбинации (RSS; от англ. recombination signal sequences), с которыми связаны белки RAG1 и RAG2 (от англ. recombination activating gene). Белки RAG катализируют образование двухцепочечного разрыва между сигнальными последовательностями и сегментами V (или J), которые должны соединиться. Сегменты V и J затем соединяются с помощью второго комплекса белков.
Рис. 25-47. Механизм перестройки гена иммуноглобулина. Белки RAG1 и RAG2 связываются с сигнальными последовательностями рекомбинации (RSS) и расщепляют одну цепь ДНК между RSS и сегментами V (или J), которые будут впоследствии соединены. После этого высвобожденная 3'-гидроксильная группа действует в качестве нуклеофила, атакует фосфодиэфирную связь в другой цепи и создает двухцепочечный разрыв. Образующиеся шпильки в области сегментов V и J расщепляются, а их концы ковалентно связываются комплексом белков, специализирующихся на репарации путем соединения концов в двухцепочечных разрывах. Стадии образования двухцепочечного разрыва, катализируемые RAG1 и RAG2, напоминают стадии реакций транспозиции.
Гены тяжелых цепей и легких λ-цепей образуются в аналогичных процессах. Для тяжелых цепей существует больше генных сегментов, чем для легких цепей, и для них возможно более 5000 комбинаций. Поскольку при образовании иммуноглобулина любая тяжелая цепь может комбинироваться с любой легкой цепью, у каждого человека может быть по меньшей мере 3000 • 5000 = 1,5 • 107 различных IgG. Дополнительное разнообразие возникает из-за высокой частоты мутаций (механизм неизвестен) генов V-сегментов в ходе дифференцировки В-лимфоцитов. Каждый зрелый В-лимфоцит образует антитела только одного типа, но набор антител, образуемых разными клетками, очень большой.
Действительно ли иммунная система отчасти происходит от древних транспозонов? Механизм образования двухцепочечных разрывов с помощью RAG1 и RAG2 на самом деле идентичен нескольким стадиям транспозиции (рис. 25-47). Кроме того, вырезаемая ДНК с RSS на концах имеет структуру, обнаруженную в большинстве транспозонов. В эксперименте in vitro белки RAG1 и RAG2 могут взаимодействовать с этой вырезанной ДНК и встраивать ее, как транспозон, в другие молекулы ДНК (в В-лимфоцитах эта реакция, вероятно, происходит довольно редко). Мы не знаем точно, но система перестройки генов иммуноглобулинов, возможно, является результатом эволюционного процесса, уничтожившего различия между паразитом и хозяином.
Краткое содержание раздела 25.3 Рекомбинация ДНК
■ Последовательности ДНК подвергаются перестройкам в реакциях рекомбинации, которые обычно четко координированы с репликацией или репарацией ДНК.
■ Гомологичная генетическая рекомбинация может происходить между любыми двумя молекулами ДНК с гомологичными последовательностями. При мейозе (у эукариот) этот тип рекомбинации помогает обеспечить правильное расхождение хромосом и увеличить генетическое разнообразие. И у бактерий, и у эукариот рекомбинация служит для восстановления блокированных репликативных вилок. В процессе гомологичной рекомбинации формируется промежуточная структура Холлидея.
■ Сайт-специфическая рекомбинация происходит только на специфических последовательностях и может протекать также через образование структуры Холлидея. Рекомбиназы расщепляют ДНК в специфических точках и связывают цепи с новыми партнерами. Этот тип рекомбинации обнаружен практически во всех клетках; к его многочисленным функциям относятся в том числе интеграция ДНК и регуляция экспрессии.
■ Транспозоны, существующие практически во всех клетках, передвигаются внутри или между хромосомами посредством рекомбинации. У позвоночных с помощью запрограммированной рекомбинации, напоминающей транспозицию, происходит соединение сегментов генов иммуноглобулинов в ходе дифференцировки В-лимфоцитов.