ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
25. МЕТАБОЛИЗМ ДНК
Вопросы и задачи
1. Выводы из эксперимента Мезельсона-Сталя.
Эксперимент Мезельсона-Сталя (рис. 25-2) доказывает, что ДНК в клетках Е. coli претерпевает полуконсервативную репликацию. В «дисперсионной» модели репликации цепи родительской ДНК расщепляются на участки случайной длины, затем связываются с фрагментами заново реплицированной ДНК, что приводит к образованию дуплексов. Объясните, почему результаты эксперимента Мезельсона и Сталя исключают такую модель.
2. Анализ репликации ДНК с помощью тяжелых изотопов.
Культуру Е. coli, растущую на среде с 15NH4Cl, переносят на среду, содержащую 14NH4Cl, где клетки делятся три раза (т. е. численность клеток возрастает в восемь раз). Каково молярное соотношение гибридной ДНК (15N-14N) к легкой ДНК (14N-14N) в образовавшейся культуре?
3. Репликация хромосомы Е. coli.
Хромосома Е. coli содержит 4 639 221 п. н.
а) Сколько витков двойной спирали раскручивается при репликации хромосомы Е. coli?
б) Исходя из сведений, представленных в данной главе, определите, сколько времени потребуется для репликации хромосомы Е. coli при 37 °С, если две репликативные вилки начинают движение в точке начала репликации? Допустим, что скорость репликации составляет 1000 п. н./с. В этих условиях клетки Е. coli делятся каждые 20 мин. Возможно ли это?
в) Сколько (примерно) фрагментов Оказаки образуется при репликации хромосомы Е. coli? Какие факторы гарантируют правильную сборку многочисленных фрагментов Оказаки в новую ДНК?
4. Состав оснований ДНК, образованных на одноцепочечных матрицах.
Оцените состав оснований всей ДНК, синтезированной ДНК- полимеразой на матрицах из эквимолярной смеси двух комплементарных цепей бактериофага φХ 174 (кольцевые молекулы ДНК). Состав оснований одной цепи: А — 24,7%; G — 24,1%; С — 18,5%; Т — 32,7%. Какое допущение необходимо сделать, чтобы ответить на этот вопрос?
5. Репликация ДНК.
Корнберг с коллегами инкубировали растворимые экстракты Е. coli со смесью dATP, dTTP, dGTP и dCTP, меченных 32Р по α-фосфатным группам. Через некоторое время инкубационную смесь обрабатывали трихлоруксусной кислотой, которая осаждает ДНК, но не осаждает нуклеотиды-предшественники. Осадок собирали и по количеству радиоактивной метки в осадке определяли количество предшественников, встроившихся в ДНК.
а) Если из инкубационной смеси удалить один из четырех предшественников, будет ли радиоактивная метка обнаружена в осадке? Поясните ответ.
б) Может ли 32Р включаться в состав ДНК, если метку содержит только dTTP? Поясните ответ.
в) Будет ли обнаружена радиоактивность в осадке, если метку 32Р включать в β- или y-фосфатные, а не в α-фосфатные группы? Поясните.
6. Химия репликации ДНК.
Все ДНК-полимеразы синтезируют новую цепь ДНК в направлении 5' —> 3'. В определенном смысле репликация антипараллельных цепей ДНК-дуплекса была бы проще при наличии второго типа полимераз, способных синтезировать ДНК в направлении 3' —> 5'. В принципе два типа полимераз могли бы координировать синтез ДНК без тех сложных механизмов, которые требуются для репликации отстающей цепи. Однако таких 3' —> 5' синтезирующих ферментов не обнаружено. Предложите два возможных механизма синтеза ДНК в направлении 3' —> 5'. Одним из продуктов в обоих случаях был бы пирофосфат. Осуществимы ли эти механизмы в клетке? Почему да или почему нет? (Подсказка. Можете предположить существование предшественников ДНК, которых нет в современных клетках.)
7. Лидирующая и отстающая цепи.
Составьте таблицу, в которой сравните репликацию лидирующей и отстающей цепей ДНК у Е. соli. Перечислите названия и функции предшественников, ферментов и других необходимых белков.
8. Функция ДНК-лигазы.
Некоторые мутанты Е. coli содержат дефектную ДНК-лигазу. Если такие мутанты обработать 3Н-меченым тимином и осадить полученную ДНК в градиенте плотности щелочной сахарозы, появляются две радиоактивные полосы. Одна соответствует высокомолекулярной фракции, другая — низкомолекулярной фракции. Объясните эти данные.
9. Точность репликации ДНК.
Какие факторы увеличивают точность репликации во время синтеза лидирующей цепи ДНК? Можно ли ожидать, что отстающая цепь будет образовываться с такой же точностью. Поясните свой ответ.
10. Важная роль ДНК-топоизомераз в репликации ДНК.
Раскручивание ДНК, например, при репликации влияет на плотность сверх- спирализации ДНК. В отсутствие топоизомераз ДНК перед репликативной вилкой была
бы перекручена, поскольку позади вилки ДНК раскручена. Бактериальная репликативная вилка останавливается, когда плотность сверхспирализации (σ) ДНК перед вилкой достигает величины +0,14 (см. гл. 24).
Двунаправленная репликация плазмиды размером 6000 п. н. в условиях in vitro инициируется в точке начала репликации без участия топоизомераз. До начала репликации σ = -0,06. Сколько пар оснований раскрутит и реплицирует каждая репликативная вилка до остановки? Считайте, что все вилки движутся с одинаковой скоростью и имеют все необходимое для элонгации, кроме топоизомеразы.
11. Тест Эймса.
На тонкий слой агаризованной питательной среды, в которой отсутствовал гистидин, высеяли примерно 109 бактерий Salmonella typhimurium, ауксотрофных по гистидину (мутантные клетки, которые нуждаются в гистидине для выживания), и через двое суток инкубации при 37 °С получили примерно 13 колоний (рис. 25-21). Как могли появиться колонии на среде без гистидина? Эксперимент повторили в присутствии 0,4 мкг 2-аминоантрацена. Через двое суток образовалось более 10 000 колоний. Какой вывод можно сделать о свойствах 2-аминоантрацена? Что можно сказать о канцерогенности этого вещества?
12. Механизмы репарации ДНК.
Клетки позвоночных и растений часто метилируют цитозин в ДНК с образованием 5-метил цитозина (см. рис. 8-5, а). В тех же клетках специализированная система репарации распознает ошибочные пары G-Т и заменяет их парой G = C. Какую пользу клетке приносит такая система репарации? (Объясните, учитывая роль 5-ме- тилцитозина в ДНК).
■ 13. Репарация ДНК у людей с пигментной ксеродермой.
Пигментная ксеродерма (ХР) возникает в результате мутаций по меньшей мере в семи разных генах человека. Нарушения обычно затрагивают гены, кодирующие ферменты эксцизионной репарации нуклеотидов. Существует несколько типов заболевания, которые обозначают буквами от А до G (ХРА, ХРВ и т. д.), и отдельный тип XPV. Культуры фибробластов здоровых людей и больных ХР облучали УФ-светом. ДНК выделяли и денатурировали, а полученные одноцепочечные молекулы ДНК анализировали путем ультрацентрифугирования.
а) В образцах нормальных фибробластов после облучения существенно снижена средняя молекулярная масса одноцепочечных молекул ДНК, а в образцах фибробластов пациентов с XPG такого снижения не наблюдается. Почему?
б) Если считать, что в фибробластах действует система эксцизионной репарации нуклеотидов, какой этап нарушен в фибробластах пациентов с XPG? Объясните.
14. Структуры Холлидея.
Чем образование структур Холлидея при гомологичной генетической рекомбинации отличается от их образования при сайт-специфической рекомбинации?
15. Связь между репликацией и сайт- специфической рекомбинацией.
Большинство диких штаммов Saccharomyces cerevisiae несет множество копий кольцевой плазмиды 2μ (названной так из-за того, что длина ее окружности составляет около 2 мкм), состоящей из ~6300 п. н. Плазмида использует хозяйскую систему репликации, причем реплицируется под тем же строгим контролем, что и хозяйская хромосома, всего один раз за клеточный цикл. Репликация плазмиды идет в двух направлениях, а обе репликативные вилки возникают в одной и той же хорошо изученной точке начала репликации. Однако один цикл репликации плазмиды 2μ может привести к образованию более чем двух копий плазмиды, что способствует увеличению копийности плазмиды (увеличивается число копий плазмиды в одной клетке), чтобы при расхождении плазмид в ходе деления клетки ни одна из дочерних клеток не получила меньше копий плазмиды, чем должно быть в норме. Для амплификации требуется система сайт- специфической рекомбинации, закодированная в плазмиде, которая позволяет перевернуть одну часть плазмиды по отношению к другой части. Объясните, каким образом сайт-специфическая инверсия может приводить к увеличению копийности плазмиды. (Подсказка. Рассмотрите ситуацию, когда репликативные вилки удваивают только один из двух сайтов рекомбинации.)
Анализ экспериментальных данных
16. Мутагенез в клетках Escherichia coli.
Многие мутагенные соединения действуют путем алкилирования оснований ДНК. Алкилирующий агент R7000 (7-метокси-2-нитронафто [2.1-b] фуран) - очень мощный мутаген.
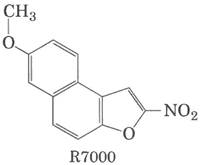
В условиях in vivo R7000 активируется ферментом нитроредуктазой, и возникающая более активная форма образует ковалентную связь с ДНК, главным образом с парами G = C, но не только. В 1996 г. Кийарде, Туати и Хофнунг изучали механизм мутагенного действия R7000 на клетки Е. coli. Они сравнили генотоксическую активность R7000 к двум штаммам Е. coli: штамму дикого типа (uvr+) и мутантному штамму, не имеющему активности uvrA (uvr; см. табл. 25-6). Сначала исследователи определяли степень мутагенности. Антибиотик рифампицин ингибирует РНК-полимеразу (см. гл. 26); в его присутствии клетки могут расти только при условии, что в гене РНК-полимеразы произошли определенные мутации. Таким образом, появление устойчивых к рифампицину колоний может являться мерой мутагенности.
Было проанализировано действие R7000 в разной концентрации; результаты эксперимента представлены ниже.
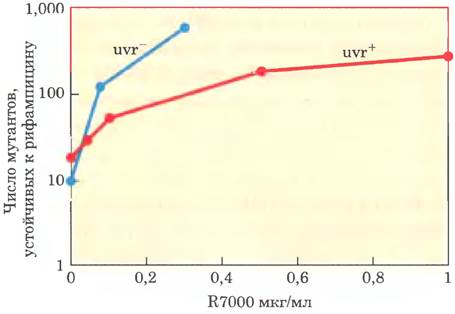
а) Почему мутации возникают даже при отсутствии R7000?
Кийарде с соавторами также определяли выживаемость бактерий, обработанных R7000 в различных концентрациях.
б) Объясните, почему обработка R7000 убивает клетки бактерий.
в) Объясните различия в степени мутагенности R7000 и выживаемости для двух штаммов бактерий — uvr+ и uvr (см. данные).
Далее исследователи стали измерять количество R7000, образовавшего ковалентную связь с ДНК в штаммах uvr+ и uvr-. Они инкубировали бактерии с [3Н] R7000 в течение 10 или 70 мин, экстрагировали ДНК и определяли в ней уровень 3Н в имп./мин в расчете на микрограмм ДНК.
3Н в ДНК, имп./мин • мкг |
||
Время, мин |
uvr+ |
uvr |
10 |
76 |
159 |
70 |
69 |
228 |
г) Объясните, почему со временем содержание 3Н уменьшается в штамме uvr+ и увеличивается в штамме uvr-.
Кийарде с коллегами исследовали также изменения последовательности ДНК, вызванные воздействием R7000 в штаммах uvr+ и uvr-. Для этого они использовали шесть различных штаммов Е. coli, каждый из которых содержал специфическую точечную мутацию в гене lacZ, который кодирует β-галактозидазу (этот фермент катализирует ту же реакцию, что и лактаза; см. рис. 14-10 в т. 2). Клетки с любой из этих мутаций имеют нефункциональную (5-галактозидазу и не могут метаболизировать лактозу (фенотип Lac-). Для восстановления функции гена lacZ и фенотипа Lac+ в каждом конкретном мутанте требовалась специфическая обратная мутация. Высевая клетки на среду, содержащую лактозу в качестве единственного источника углерода, можно производить селективный отбор таких Lас+-клеток, претерпевших обратную мутацию. Подсчет числа Lас+-клеток после мутагенеза каждого штамма позволяет определить частоту мутаций каждого типа.
Сначала исследователи проанализировали спектр мутаций в клетках uvr-. В таблице представлены результаты для шести штаммов - от СС101 до СС106 (в скобках указаны точечные мутации, необходимые для образования фенотипа Lac+ в каждом случае).
Количество клеток Lac+ (среднее ± стандартное отклонение) |
||||||
R7000, мкг/мл |
СС101 (А = Т на C = G) |
СС102 (G = C на А = Т) |
СС103 (G = C на C = G) |
СС104 (G = C на Т = А) |
СС105 (А = Т на Т = А) |
СС106 (А = Т на G = C) |
0 |
6 ± 3 |
11 ± 9 |
2 ±1 |
5 ± 3 |
2 ± 1 |
1 ± 1 |
0,075 |
24 ± 19 |
34 ± 3 |
8 ± 4 |
82 ± 23 |
40 ± 14 |
4 ± 2 |
0,15 |
24 ± 4 |
26 ± 2 |
9 ± 5 |
180 ± 71 130±50 |
3 ± 2 |
|
д) При каких мутациях количество клеток с фенотипом Lac' увеличивается в значительной степени в результате обработки препаратом R7000? Объясните, почему у одних штаммов частота возникновения такого фенотипа выше, чем у других.
е) Могут ли все перечисленные мутации объясняться ковалентным связыванием R7000 с парой GC? Поясните свой ответ.
ж) На рис. 25-28, б показано, как метилирование остатков гуанина может приводить к замене ОС на АТ. Используя тот же путь, покажите, каким образом аддукт G-R7000 мог бы приводить к замене GC на АТ или на ТА в приведенном выше примере. Какое основание образует пару с аддуктом G -R7000?
Результаты для штаммов uvr+ представлены ниже.
Количество клеток Lac+ (среднее ± стандартное отклонение) |
||||||
R7000, мкг/мл |
СС101 (А = Т на C = G) |
СС102 (G = С на А = Т) |
CC103 (G = C на C = G) |
СС104 (G = C на Т = А) |
СС105 (А = Т на Т = А) |
СС106 (А = Т на G = C) |
0 |
2 ± 2 |
10 ± 9 |
3 ± 3 |
4 ± 2 |
6 ± 1 |
0,5 ± 1 |
1 |
7 ± 6 |
21 ± 9 |
8 ± 3 |
23 ± 15 |
13 ± 1 |
1 ± 1 |
5 |
4 ± 3 |
15 ± 7 |
22 ± 2 |
68 ± 25 |
67 ± 14 |
1 ± 1 |
з) Указывают ли данные результаты на то, что все типы мутаций исправляются с одинаковой точностью? Объясните свой ответ.