Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Окислительное фосфорилирование и транспортные системы митохондрий
Митохондриальные транспортные системы
Митохондриальные мембраны и локализация важных ферментов в митохондриях
Митохондрии имеют наружную мембрану, проницаемую для большинства метаболитов, и избирательно проницаемую внутреннюю мембрану со множеством складок (крист), выступающих в сторону матрикса (внутреннего пространства митохондрии) (рис. 13.12). Наружная мембрана может быть удалена путем обработки дигитонином; она характеризуется наличием моноаминоксидазы и некоторых других ферментов (например, ацил-СоА-синтетазы, глицерофосфат-ацилтрансферазы, моноацилглицерофосфат-ацилтрансферазы, фосфолипазы А2). В межмембранном пространстве находятся аденилаткиназа и креатинкиназа. Во внутренней мембране локализован фосфолипид кардиолипин.
В матриксе находятся растворимые ферменты цикла лимонной кислоты и ферменты ß-окисления жирных кислот; в связи с этим возникает необходимость в механизмах транспорта метаболитов и нуклеотидов через внутреннюю мембрану. Сукцинатдегидрогеназа локализована на внутренней поверхности внутренней митохондриальной мембраны, где она передает восстановительные эквиваленты дыхательной цепи на уровне убихинона (минуя первую о/в петлю). 3-Гидроксибутиратдегидрогеназа также локализована на матриксной стороне внутренней митохондриальной мембраны. Глицерол-3-фосфат-дегидрогеназа находится на наружной поверхности внутренней мембраны, где она участвует в функционировании глицерофосфатного челночного механизма.
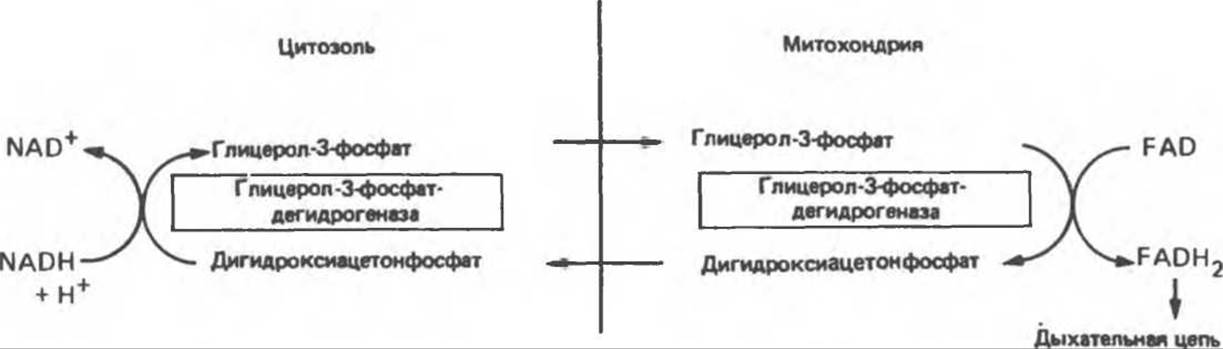
Рис. 13.14. Глицерофосфатный челночный механизм переноса восстановительных эквивалентов из цитозоля в митохондрию.
Окисление внемитохондриального NADH при участии субстратных челночных механизмов
NADH не может проникать через митохондриальную мембрану; он непрерывно образуется в цитозоле глицеральдегидфосфатдегидрогеназой, одним из ферментов гликолиза (см. рис. 18.2). Вместе с тем при аэробных условиях внемитохондриальный NADH не накапливается; он окисляется в дыхательной цепи митохондрий. Для объяснения этой ситуации предложено несколько механизмов. Они предполагают перенос восстановительных эквивалентов через митохондриальную мембрану при участии пар субстратов, связанных соответствующими дегидрогеназами. Необходимо, чтобы с обеих сторон митохондриальной мембраны находилась специфическая дегидрогеназа. Перенос восстановительных эквивалентов при участии глицерофосфатного челночного механизма показан на рис. 13.14. Следует отметить, однако, что, поскольку митохондриальный фермент связан с дыхательной цепью через флавопротеин, а не через NAD, на каждый потребленный атом кислорода образуется только две, а не три молекулы АТР. У некоторых видов животных активность FAD-зависимых ферментов понижается после тиреоидэктомии и повышается после введения тироксина. Такой челночный механизм работает в летательной мышце насекомых, в белых мышцах и играет важную роль в печени, однако в других тканях (например, в сердечной мышце) митохондриальная глицерол-3-фосфат-дегидрогеназа отсутствует. Полагают, что более универсальной является транспортная система, использующая малат и цитозольную и митохондриальную малатдегидрогеназы. Система «малатного челночного механизма» показана на рис. 13.15. Сложность этой системы обусловлена тем, что митохондриальная мембрана непроницаема для оксалоацетата, поэтому через митохондриальную систему в цитозоль транспортируются а-кетоглутарат и аспартат, которые образуются в результате реакции переаминирования оксалоацетата с глутаматом; в цитозоле из а-кетоглутарата вновь образуется оксалоацетат.
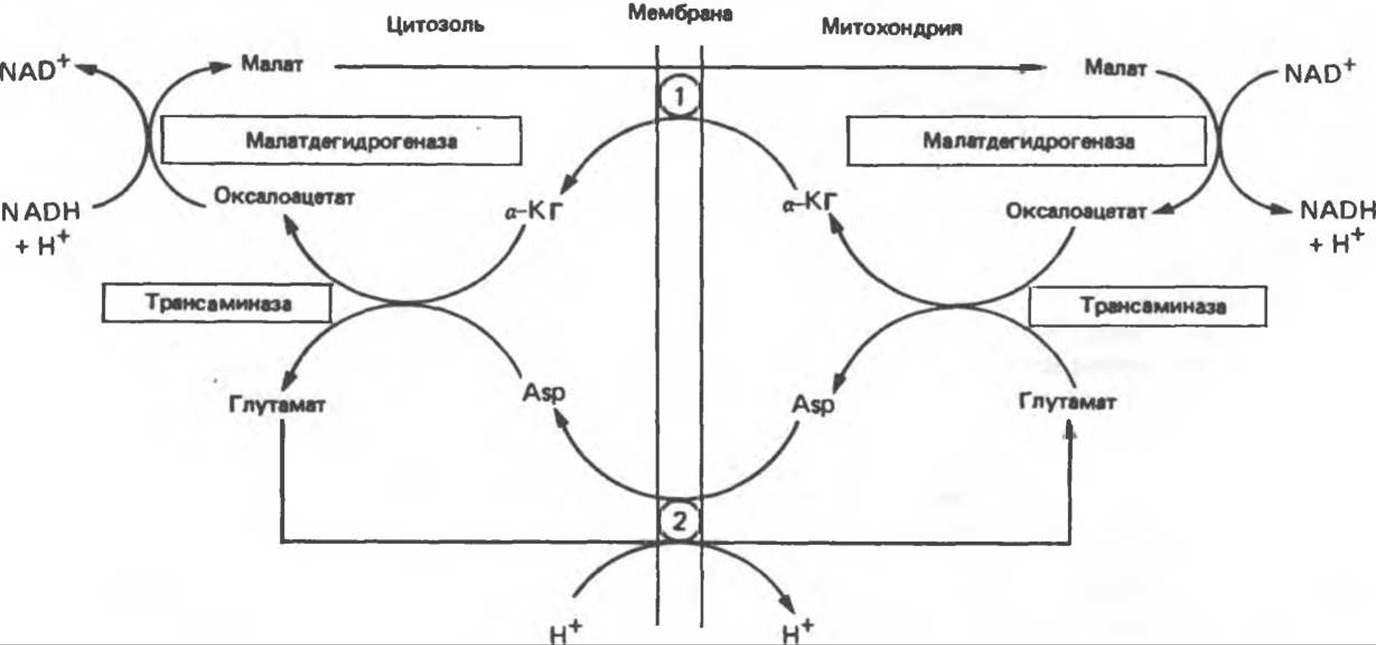
Рис. 13.15. Малатный челночный механизм переноса восстановительных эквивалентов из цитозоля внутрь митохондрии. 1 — переносчик кетоглутарата, 2 — переносчик аспартата и глутамата (обратите внимание на сопряженный перенос протонов).
Энергозависимый ионный транспорт в митохондриях
В активно дышащих митохондриях, в которых идет окислительное фосфорилирование, накапливаются и поддерживаются на определенном уровне катионы К+, Na+, Са2+ и Mg2+, а также Рi. Разобщение дыхания и фосфорилирования динитрофенолом приводит к потере ионов митохондриями; в то же время олигомицин не ингибирует накопление ионов — следовательно, этот процесс идет не за счет энергии, которая запасается путем фосфорилирования ADP. Можно полагать, что транспорт катионов осуществляется за счет работы протонной помпы.
Системы транспорта (рис. 13.16)
Внутренняя бислойная митохондриальная мембрана свободно проницаема для незаряженных небольших молекул, таких, как кислород, вода, СO2 и NH3, а также для монокарбоновых кислот, таких, как 3-гидроксимасляная, ацетоуксусная и уксусная. Длинноцепочечные жирные кислоты транспортируются в митохондрии с помощью карнитиновой системы (см. рис. 23.1); имеется также специальный переносчик пирувата, функционирующий по принципу симпорта, использующего градиент протонов с наружной на внутреннюю поверхность митохондриальной мембраны. Транспорт дикарбоксилатных и трикарбоксилатных анионов, а также аминокислот осуществляется с помощью специальных систем переноса, облегчающих их прохождение через мембрану. Монокарбоновые кислоты легче проникают через мембрану вследствие меньшей степени их диссоциации; недиссоциированная форма кислоты имеет большую растворимость в липидах, и, как полагают, именно в этой форме монокарбоновые кислоты проходят через липидную мембрану.
Транспорт ди- и трикарбоксилатных анионов тесно связан с транспортом неорганического фосфата, который легко проникает через мембрану в форме ионов Н2РО-4 в обмен на ОН-. Малат переносится системой транспорта дикарбоксилатов в обмен на перенос неорганического фосфата в обратном направлении. Перенос цитрата, изоцитрата и цис- аконитата системой транспорта трикарбоновых кислот происходит в обмен на перенос малата в обратном направлении. а-Кетоглутарат также поступает в обмен на малат. Таким образом, в результате работы обменных механизмов поддерживается осмотическое равновесие. Следует отметить, что перенос цитрата через митохондриальную мембрану зависит не только от транспорта малата, но также и от транспорта неорганического фосфата. Переносчик адениновых нуклеотидов обменивает АТР на ADP, но не на АМР. Жизненно важной задачей является обеспечение выхода АТР из митохондрий для последующего использования вне митохондрий и одновременного притока ADP для образования АТР внутри митохондрий (рис. 13.17). Ионы Na+ могут обмениваться на ионы Н+ за счет градиента протонов. Полагают, что при активном транспорте ионов Са2+ внутрь митохондрий происходит перенос единичного положительного заряда на каждый ион, что, возможно, связано с обменом Са2+/Н+. Выход кальция из митохондрии облегчается при обмене его на Na+.
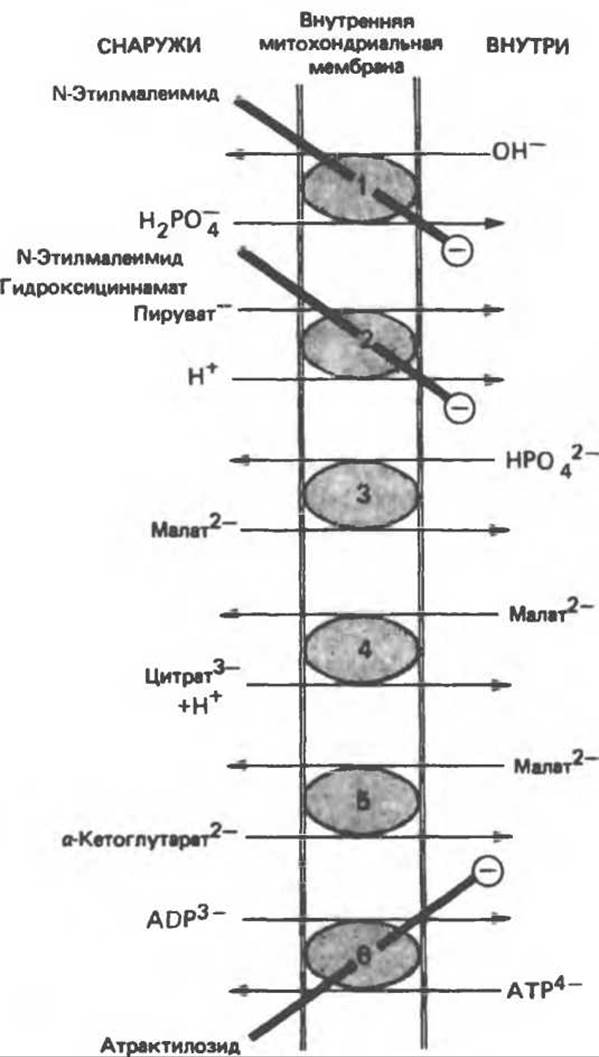
Рис. 13.16. Транспортные системы митохондриальной мембраны. 1 — переносчик фосфата, 2 — симпорт пирувата, 3 — переносчик дикарбоксилатов, 4 — переносчик трикарбоксилатов, 5 — переносчик а-кетоглутарата, 6 — переносчик адениновых нуклеотидов. N-Этилмалеимид, гидроксициннамат и атрактилозид ингибируют (⊝) указанные системы. Имеются также (на рисунке не показаны) системы переноса аспартата и глутамата (см. рис. 13.15), глутамина, орнитина, карнитина (см. рис. 23.1)
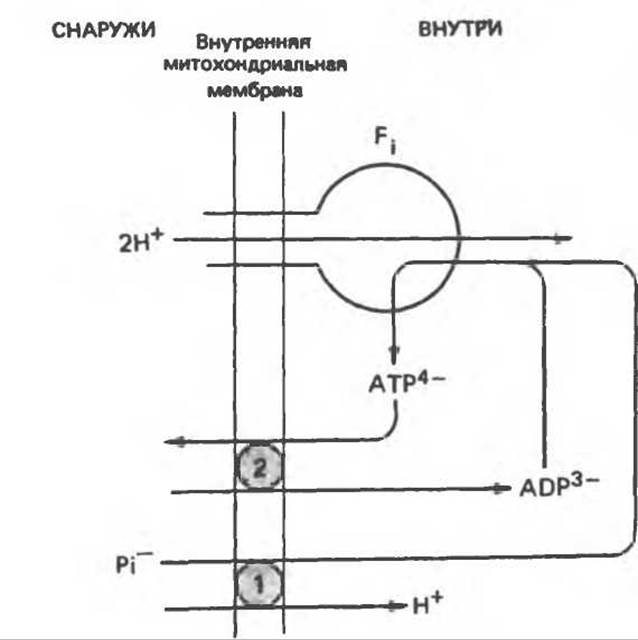
Рис. 13.17. Совместное действие переносчика фосфата (1) и переносчика адениновых нуклеотидов (2) в системе синтеза АТР. Симпорт H4/Рi эквивалентен антипорnу Рi/OII- показанному на рис. 13.16: На каждую экспортированную из митохондрии молекулу АТР в митохондрию поступают три протона. Если же АТР используется внутри митохондрии, то поступают только два протона. Эта модель предусматривает стехиометрическое соотношение: 3 перенесенных протона на электронную пару на каждом участке сопряжения (в отличие от гипотезы Кросса, предполагающей перенос только двух протонов); она не противоречит первоначальной гипотезе Митчелла (рис. 13.11) (2 протона на каждую электронную пару на каждом участке сопряжения) при значении отношения P/О, равном 2 для NАDH-зависимою окисления и 1,3 для окисления сукцината (по Хинклю).
Действие ионофоров
Соединения, о которых идет речь, получили свое название вследствие их способности специфически связывать определенные катионы и облегчать их транспорт через биологические мембраны. Эти свойства ионофоров обусловлены их липофильным характером, благодаря чему они проникают через липидные мембраны, в частности через митохондриальную мембрану. Примером служит антибиотик валиномицин, который переносит К+ через митохондриальную мембрану и тем самым снижает мембранный потенциал между внутренней и наружной сторонами. Нигерицин также действует как ионофор для ионов К+, но в обмен на Н+; в этом случае снижается градиент pH между сторонами мембраны. При одновременном присутствии валиномицина и нигерицина утрачиваются и мембранный потенциал, и градиент pH, что приводит к полному ингибированию фосфорилирования. Классические разобщители, такие, как динитрофенол, по сути дела являются протонными ионофорами.
Нарушения в работе дыхательной цепи
Состояние фатальной детской митохондриальной миопатии и дисфункции почек связано со снижением содержания или полным отсутствием большинства оксидоредуктаз дыхательной цепи.
Литература
Cross R. L. The mechanism and regulation of ATP synthesis by F,-ATPases, Annu. Rev. Biochem., 1981, 50, 681.
Harper H. A., Rodwell V. W., Mayes P. A. Page 276. In: Review of Physiological Chemistry, 17th ed., Lange, 1979.
Hatefi Y. The mitochondrial electron transport and oxidative phosphorylation system, Annu. Rev. Biochem., 1985, 54, 1015.
Hinkle P. C., McCarty R. E. How cells make ATP, Sсi. Am. (March), 1978, 238, 104.
Hinkle P. C., Yu M. L. The phosphorus/oxigen radio of mitochondrial oxidative phosphorylation. J. Biol. Chem., 1979, 254, 2450.
Mitchell P. Keilin’s respiratory chain concept and its chemiosmotic consequences, Science, 1979, 206, 1148.
Nicholls D. G. Bioenergetics: An Introduction to the Chemiosmotic Theory, Academic Press, 1982.
Tyler D. D. The mitochondrial ATP synthase, Page 117. In: Membrane Structure and Function, Vol. 5, Bittar E. E. (ed.), Wiley, 1984.
Tyler D. D., Sutton С. M. Mitochondrial transporting systems, Page 181. In: Membrane Structure and Function, Vol. 5, Bittar E. E. (ed.), Wiley, 1984.