Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Цикл лимонной кислоты: катаболизм ацетил-СоА
Реакции цикла лимонной кислоты (рис. 17.3)
Начальная реакция — конденсация ацетил-СоА и оксалоацетата, приводящая к образованию цитрата, катализируется конденсирующим ферментом, цитратсинтазой, при этом происходит образование связи углерод-углерод между метильным углеродом ацетил-СоА и карбонильным углеродом оксалоацетата. За реакцией конденсации, приводящей к образованию цитрил-СоА, следует гидролиз тиоэфирной связи, сопровождающийся потерей большого количества свободной энергии в форме теплоты; это определяет протекание реакции слева направо до ее завершения:
Ацетил-СоА + Оксалоацетат + Н2О → Цитрат + СоА ∙ SH
Превращение цитрата в изоцитрат катализируется аконитазой (аконитатгидратазой), содержащей железо в Fe2+-состоянии. Эта реакция осуществляется в две стадии: сначала происходит дегидратация с образованием цис-аконитата (часть его остается в комплексе с ферментом), а затем — гидратация и образование изоцитрата:

Реакция ингибируется фторацетатом, который сначала превращается во фторацетил-СоА; последний конденсируется с оксалоацетатом, образуя фторцитрат. Непосредственным ингибитором аконитазы является фторцитрат; при ингибировании накапливается цитрат.
Эксперименты с использованием промежуточных соединений, меченных изотопом 14С, показывают, что аконитаза взаимодействует с цитратом асимметрично: она всегда действует на ту часть молекулы цитрата, которая образовалась из оксалоацетата. Это сначала было трудно объяснить, так как лимонная кислота является внешне симметричным соединением. Однако положение в пространстве двух групп - СН2СООН лимонной кислоты относительно групп — ОН и — СООН неидентично. Об асимметричном действии аконитазы свидетельствует «судьба» меченого ацетил-СоА (т. е. положение атомов 14С) в интермедиатах цикла лимонной кислоты (рис. 17.3). Возможно, что цис-аконитат не является обязательным интермедиатом между цитратом и изоцитратом и образуется на боковой ветви основного пути.
1 Согласно рекомендациям, принятым Комитетом редакторов биохимических журналов (197S г.), окончание от (например, пальмитат) обозначает смесь свободной кислоты и ее ионизированной формы (при рассматриваемом pH) без указания природы присутствующих катионов. Это положение принято в тексте для всех карбоновых кислот.
Далее изоцитратдегидрогеназа катализирует дегидрогенирование с образованием оксалосукцината. Описаны три различных формы изоцитратдегидрогеназы. Одна из них, NAD+-зависимая, найдена только в митохондриях. Две другие формы фермента являются НАDР+-зависимыми, причем одна из них также находится в митохондриях, а другая в цитозоле. Окисление изоцитрата, связанное с работой дыхательной цепи, осуществляется почти исключительно NAD+-зависимым ферментом:
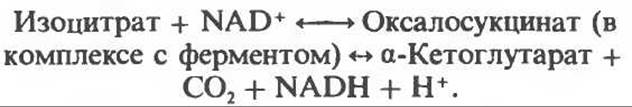
Далее следует декарбоксилирование с образованием а-кетоглутарата, которое также катализируется изоцитратдегидрогеназой. Важным компонентом реакции декарбоксилирования являются ионы Мn2+ (или Mg2+). Судя по имеющимся данным, оксалосукцинат, образующийся на промежуточной стадии реакции, остается в комплексе с ферментом.
а-Кетоглутарат в свою очередь подвергается окислительному декарбоксилированию, сходному с окислительным декарбоксилированием пирувата (см. рис. 18.5): в обоих случаях субстратом является а-кетокислота. Реакция катализируется о-кетоглутаратдегидрогеназным комплексом и требует участия того же набора кофакторов — тиамин- дифосфата, липоата, NAD+, FAD и СоА; в результате образуется сукцинил-СоА — тиоэфир, содержащий высокоэнергетическую связь.
![]()
Равновесие реакции настолько сильно сдвинуто в сторону образования сукцинил-СоА, что ее можно считать физиологически однонаправленной. Как и при окислении пирувата (см. с. 186), реакция ингибируется арсенатом, что приводит к накоплению субстрата (а-кетоглутарата).
Продолжением цикла является превращение сукцинил-СоА в сукцинат, катализируемое сукцинаттиокиназой (сукцинил-СоА-сиитетазой):
![]()
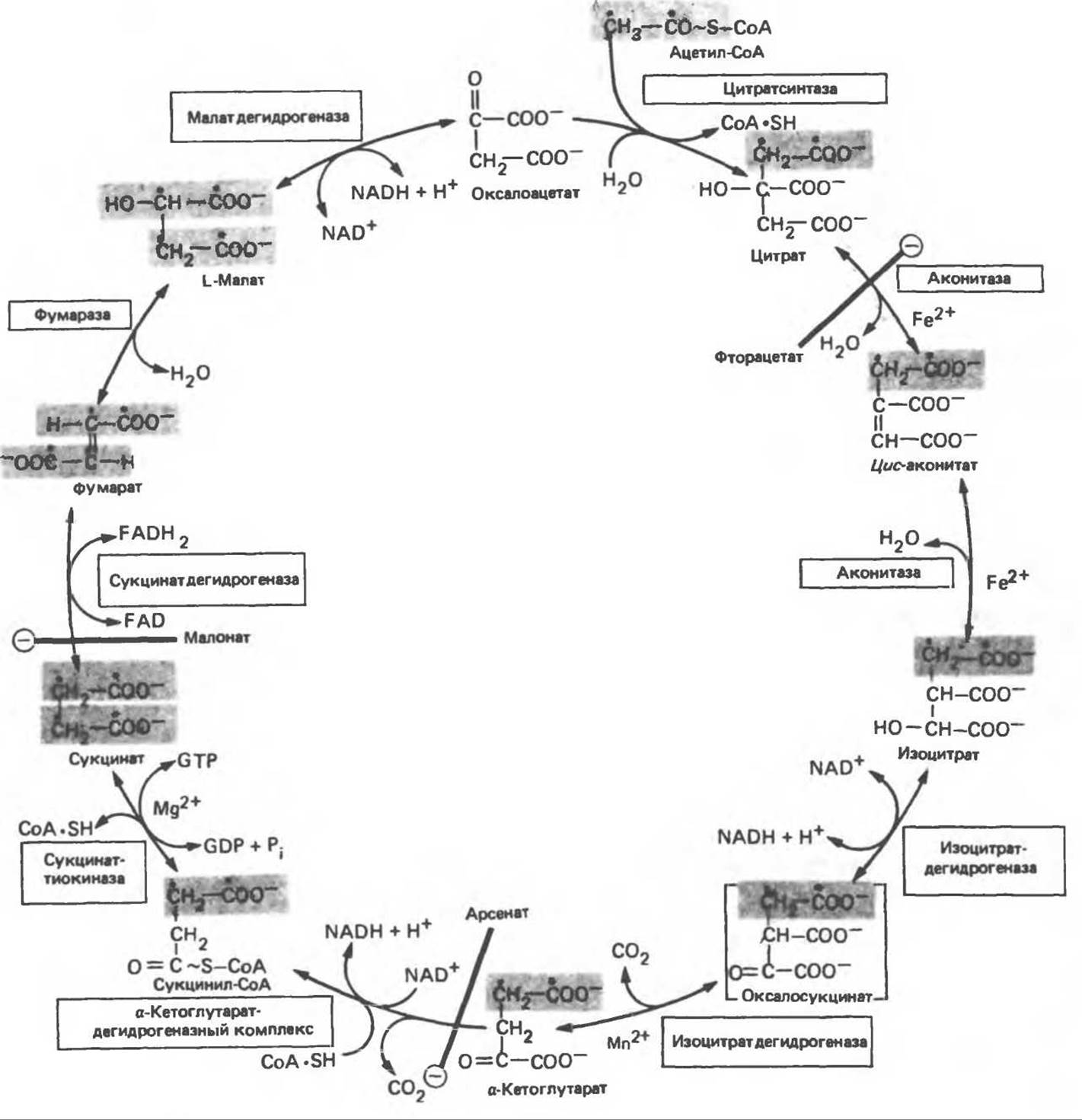
Рис. 17.3. Цикл лимонной кислоты (цикл Кребса). Окисление NADH и FADH2 в дыхательной цепи сопровождается генерированием АТР путем окислительного фосфорилирования. Чтобы проследить судьбу ацетил-СоА в ходе цикла, карбоксильный углерод двухуглеродного ацетильного радикала помечен звездочкой, а метальный углерод — точкой. Два атома углерода, которые уходят в виде СО2 за один оборот цикла, принадлежат не молекуле ацетил-СоА, только что вступившей в цикл, а той части молекулы цитрата, которая образовалась из оксалоацетата. Однако по завершении одного оборота меченые атомы углерода оказываются в регенерируемом оксалоацетате и далее, в ходе второго оборота цикла, попадают в СО2. Сукцинат является симметричным соединением, и две его карбоксильные группы для сукцинатдегидрогеназы неразличимы, поэтому на данной стадии происходит «рандомизация» (случайное распределение) метки, и после одного цикла все четыре атома углерода молекулы оксалоацетата оказываются мечеными. В процессе глюконогенеза часть метки из оксалоацетата включается в глюкозу и в гликоген (см. рис. 20.1). Обсуждение стереохимических аспектов цикла лимонной кислоты приведено в обзоре Гревилля (Greville, 1968). На рисунке показаны также места ингибирования цикла (⊝) фторацетатом, малонатом и арсенатом.
Одним из субстратов реакций является GDP (или IDP), из которого в присутствии неорганического фосфата образуется GTP (ІТР). Это — единственная стадия цикла лимонной кислоты, в ходе которой генерируется высокоэнергетическая фосфатная связь на субстратном уровне; при окислительном декарбоксилировании а-кетоглутарата потенциальное количество свободной энергии достаточно для образования NADH и высокоэнергетической фосфатной связи. В реакции, катализируемой фосфокиназой, АТР может образовываться как из GTP, так и из ІТР. Например:
![]()
В альтернативной реакции, протекающей во внепеченочных тканях и катализируемой сукцинил- СоА-ацетоацетат-СоА-трансферазой (тиофоразой), сукцинил-СоА превращается в сукцинат сопряженно с превращением ацетоацетата в ацетоацетил-СоА (см. с. 290). В печени имеется деацилазная активность, обеспечивающая гидролиз части сукцинил-СоА с образованием сукцината и СоА.
Далее сукцинат дегидрогенируется, затем присоединяется молекула воды, и следует еще одна стадия дегидрогенирования, приводящая к регенерации оксалоацетата:
![]()
Первое дегидрогенирование катализируется сукцинатдегидрогеназой, связанной с внутренней поверхностью внутренней митохондриальной мембраны. Это — единственная дегидрогеназная реакция цикла лимонной кислоты, в ходе которой осуществляется прямой перенос водорода с субстрата на флавопротеин без участия NAD+. Фермент содержит FAD и железо-серный (Fe:S) белок. В результате дегидрогенирования образуется фумарат. Как показали эксперименты с использованием изотопов, фермент стереоспецифичен к транс-атомам водорода метиленовых групп сукцината. Добавление малоната или оксалоацетата ингибирует сукцинатдегидрогеназу, что приводит к накоплению сукцината.
Фумараза (фумаратгндратаза) катализирует присоединение воды к фумарату с образованием малата:
![]()
Фумараза специфична к L-изомеру малата, она катализирует присоединение компонентов молекулы воды по двойной связи фумарата в транс-конфигурации. Малатдегидрогеназа катализирует превращение малата в оксалоацетат, реакция идет с участием NAD+:
![]()
Хотя равновесие этой реакции сильно сдвинуто в направлении малата, реально она протекает в направлении оксалоацетата, поскольку он вместе с NADH постоянно потребляется в других реакциях.
Ферменты цикла лимонной кислоты, за исключением а-кетоглутарат- и сукцинатдегидрогеназы, обнаруживаются и вне митохондрий. Однако некоторые из этих ферментов (например, малатдегидрогеназа) отличаются от соответствующих митохондриальных ферментов.