Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Метаболизм гликогена
Механизмы контроля гликогенолиза гликогенеза
Главные ферменты, контролирующие метаболизм гликогена, — гликогенфосфорилаза и гликогенсинтаза — регулируются сложной серией реакций, в которых используются как аллостерические механизмы (см. с. 104), так и ковалентная модификация путем фосфорилирования и дефосфорилирования фермента (см. с. 108).
Активация и инактивация фосфорилазы (рис. 19.5)
В печени фосфорилаза находится как в активной, так и в неактивной форме. В активной фосфорилазе (фосфорилазе а) гидроксильная группа одного из остатков серина фосфорилирована. Под действием специфической фосфатазы (протеинфосфатазы-1) фермент превращается в неактивную фосфорилазу b в результате гидролитического отщепления фосфата от остатка серина. Реактивация происходит путем рефосфорилирования за счет АТР при действии специфического фермента киназы фосфорилазы.
Мышечная фосфорилаза иммунологически и генетически отличается от соответствующего фермента печени. Она может находиться в двух формах: в форме фосфорилазы а — фосфорилированного фермента, активного как в присутствии, так и в отсутствие АМР (ее аллостерического модулятора), и в форме фосфорилазы b, дефосфорилированной и активной только в присутствии АМР. Фосфорилаза а является нормальной физиологически активной формой фермента. Она представляет собой димер, каждый мономер которого содержит одну молекулу пиридоксальфосфата.
Активация с участием сАМР
В мышце фосфорилаза активируется адреналином (рис. 19.5). Однако он оказывает не прямой эффект, а действует опосредованно через сАМР (3',5'-циклоадениловую кислоту; циклический АМР) (рис. 19.6 и гл. 44). сАМР представляет собой внутриклеточный интермедиат, выступающий в роли второго посредника при действии ряда гормонов. Он образуется из АТР при действии фермента аденилатциклазы, находящейся на внутренней поверхности клеточной мембраны. Аденилатциклаза активируется (опосредованно) гормонами адреналином и норадреналином — лигандами ß-адренергических рецепторов, локализованных в клеточной мембране; в печени она активируется глюкагоном, действующим при участии специального глюкагонового рецептора. сАМР разрушается при действии фосфодиэстеразы; именно этот фермент поддерживает в норме концентрацию сАМР на низком уровне. Имеются данные о том, что инсулин повышает активность фосфодиэстеразы в печени; это приводит к понижению концентрации сАМР.
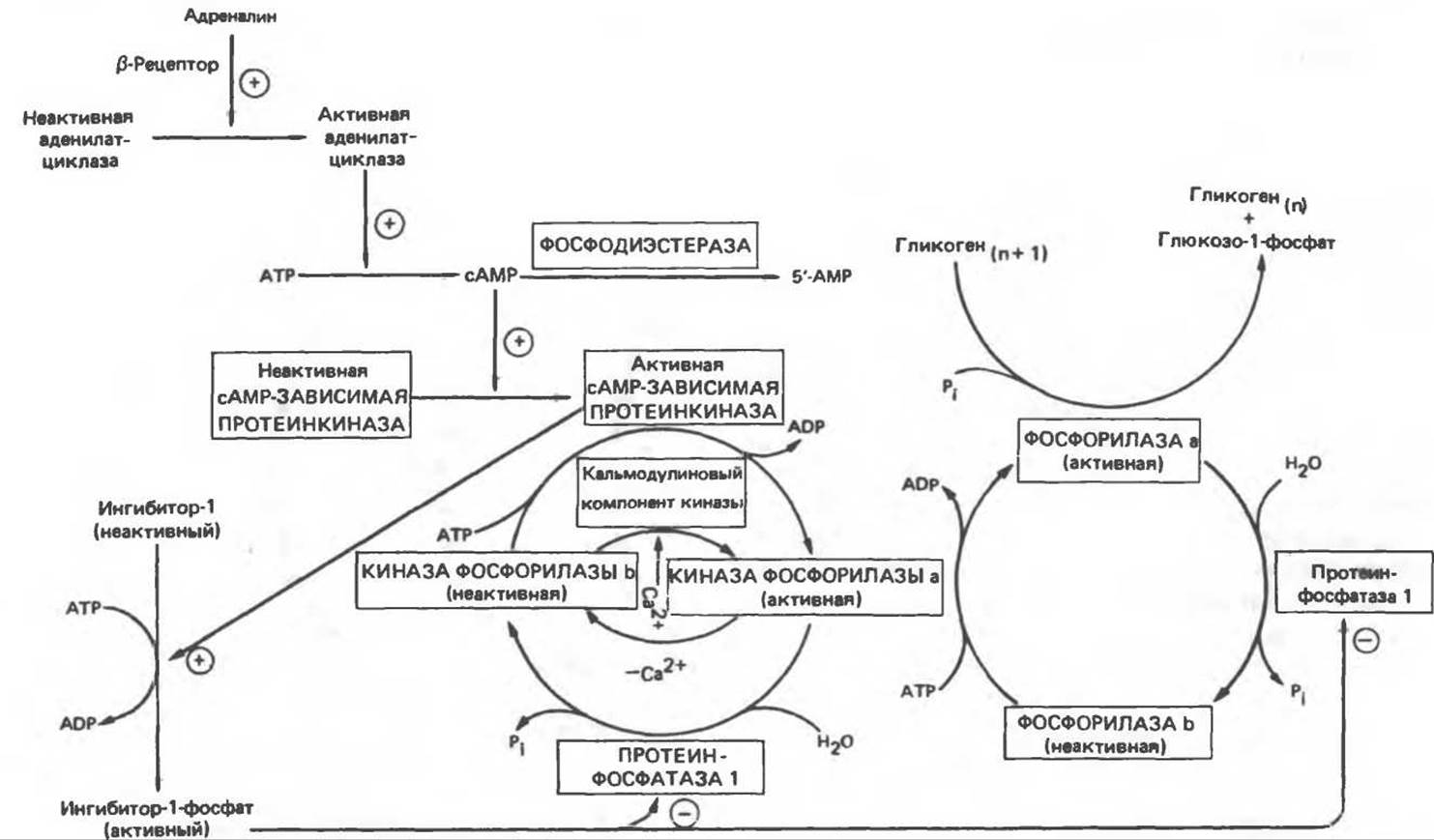
Рис. 19.5. Регуляция активности фосфорилазы в мышцах (n — число остатков глюкозы). Последовательность реакций образует каскад; это позволяет усиливать гормональный сигнал на каждой стадии.
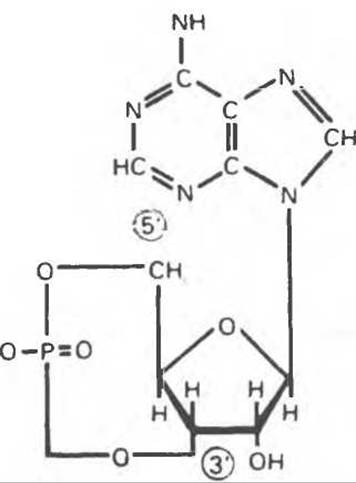
Рис. 19.6. 3',5'-Адениловая кислота (циклический AMP, cAMP).
Повышение концентрации сАМР активирует фермент, обладающий весьма широкой специфичностью — сАМР-зависимую протеинкиназу. Эта киназа катализирует фосфорилирование при участии АТР неактивной киназы фосфорилазы с образованием активной киназы фосфорилазы, которая в свою очередь, путем фосфорилирования, активирует фосфорилазу b, переходящую в фосфорилазу а (рис. 19.5).
Неактивная сАМР-зависимая протеинкиназа состоит из двух пар субъединиц; в каждую пару входят регуляторная субъединица (R), способная связывать две молекулы сАМР, и каталитическая субъединица (С), структура которой включает активный центр. Связывание сАМР с комплексом R2C2 вызывает диссоциацию последнего, приводящую к освобождению активных С-мономеров (см. гл. 44):

Активация ионами Са2+ и синхронизация с мышечным сокращением
Сразу после начала сокращения мышцы гликогенолиз возрастает в несколько сотен раз. Процесс включает быструю активацию фосфорилазы благодаря активации киназы фосфорилазы ионами Са2+ — тем же сигналом, который инициирует сокращение. Мышечная киназа фосфорилазы состоит из субъединиц четырех типов: а, ß, у и δ. Ее структура — (а, ß, у, δ)4. Субъединицы а и ß содержат остатки серина, фосфорилируемые cAMP-зависимой протеинкиназой. ß-Субъединица связывает четыре иона Са2+, она идентична Са2+-связывающему белку кальмодулину. Связывание ионов Са2+ активирует каталитический центр Y-субъединицы, хотя молекула остается в дефосфорилированной b-конфигурации. В то же время полную активность фосфорилированная a-форма приобретает только в присутствии ионов Са2+. Важно отметить, что кальмодулин имеет структурное сходство с мышечным Са2+-связывающим белком тропонином С (ТрС). С киназой фосфорилазы может взаимодействовать вторая молекула кальмодулина или ТрС, вызывая дополнительную активацию фермента. Таким образом, активация мышечного сокращения и гликогенолиз осуществляются одним и тем же Са2+-связывающим белком. Кальмодулин — белок, который участвует во многих видах воздействия кальция на клетку (см. гл. 44).
Гликогенолиз в печени
Установлено, что при стимуляции гликогенолиза катехоламинами в печени в качестве главных посредников выступают а1-рецепторы. При этом происходит сАМР-независимая мобилизация ионов Са2+ и переход их из митохондрий в цитозоль, где они стимулируют Са2+/кальмодулинчувствительную киназу фосфорилазы. Фосфорилаза скелетных мышц в отличие от фосфорилазы печени не активируется глюкагоном. Отметим, что фосфорилаза сердечной мышцы активируется этим гормоном. Другим важным отличием является ингибирование печеночной протеинфосфатазы-1 активной формой фосфорилазы.
Инактивация фосфорилазы
Фосфорилаза а и киназа фосфорилазы а дефосфорилируются и инактивируются протеинфосфатазой-1. Ингибитором протеинфосфатазы-1 является белок, который называют ингибитором-1; последний становится активным только после фосфорилирования cAMP-зависимой протеинкиназой. Таким образом, сАМР контролирует как активацию, так и инактивацию фосфорилазы (рис. 19.5).
Активация и инактивация гликогенсинтазы (рис. 19.7)
Подобно фосфорилазе, гликогенсинтаза может находиться либо в фосфорилированном, либо в нефосфорилированном состоянии. Однако в отличие от фосфорилазы в этом случае активна дефосфорилированная форма (гликогенсинтаза а), которая может быть инактивирована с образованием гликогенсинтазы b путем фосфорилирования семи остатков серина, осуществляемого не менее чем пятью различными протеинкиназами. Все семь мест фосфорилирования находятся на каждой из четырех идентичных субъединиц. Две из протеинкиназ являются Са2+/кальмодулинзависимыми. Одна из них — это киназа фосфорилазы, другая киназа является сАМР-зависимой протеинкиназой; именно эта протеинкиназа обеспечивает реализацию опосредованных сАМР гормональных воздействий, синхронно ингибирующих синтез гликогена и активацию гликогенолиза. Оставшиеся киназы известны как киназы гликогенсинтазы-3, -4 и -5.
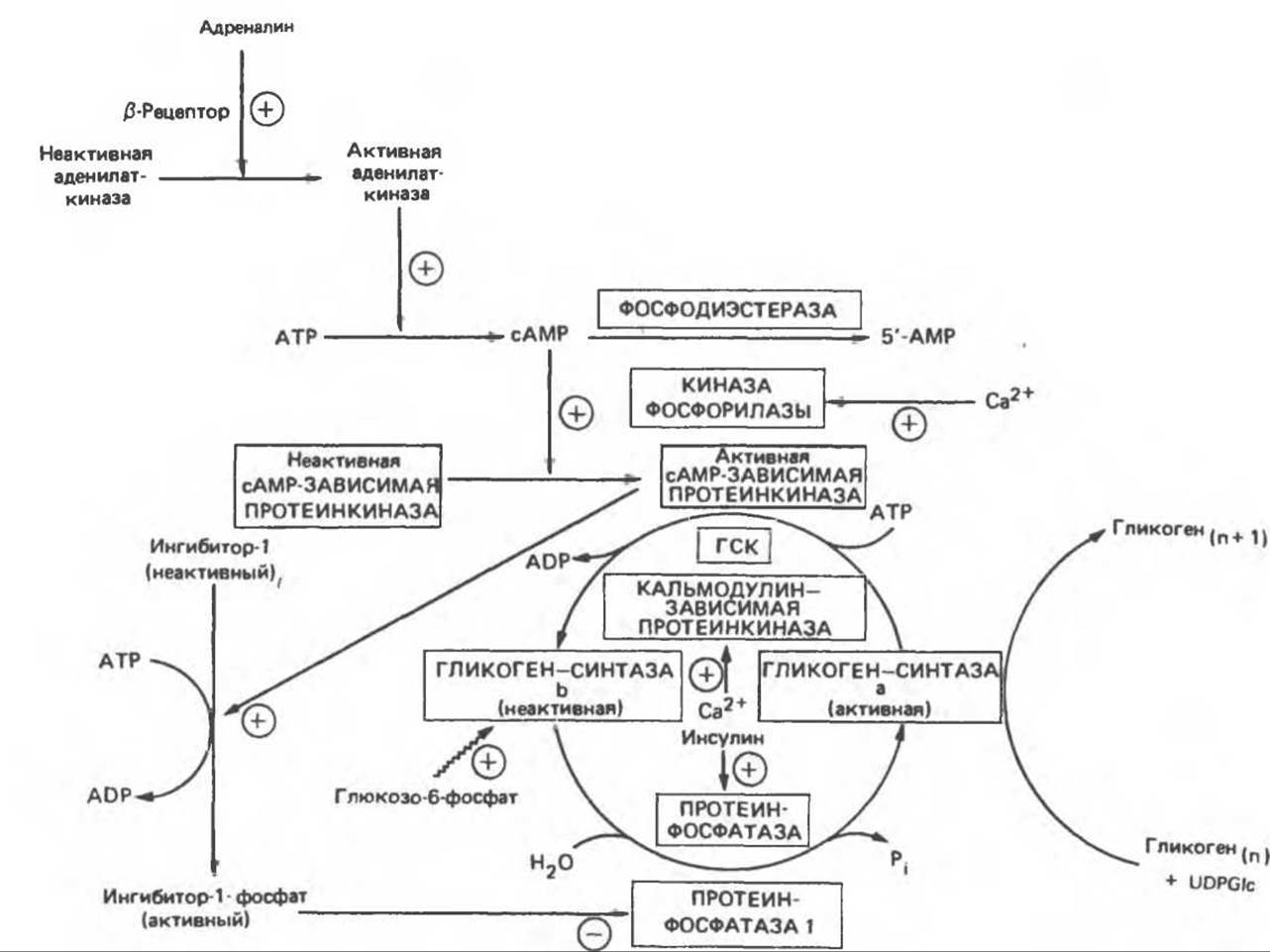
Рис. 19.7. Регуляция активности гликогенсинтазы в мышцах (n - число остатков глюкозы). Последовательность реакций образует каскад, который позволяет усиливать сигнал на каждой стадии; наномольные количества гормона могут вызывать значительные изменения концентрации гликогена. ГСК - киназы гликогенсинтазы-3, -4 и -5. Волнистой стрелкой показана аллостерическая активация.
Глюкозо-6-фосфат является аллостерическим активатором гликогенсинтазы b, вызывая снижение Kм для UDP-глюкозы и обеспечивая тем самым возможность синтеза гликогена фосфорилированной формой фермента. Гликоген оказывает ингибирующее действие на собственный синтез; инсулин стимулирует синтез гликогена в мышце, способствуя дефосфорилированию и активации гликогенсинтазы b. В норме дефосфорилирование гликогенсинтазы b осуществляется протеинфосфатазой-1, находящейся под контролем сАМР-зависимой протеинкиназы (рис. 19.7).
Другие аспекты регуляции метаболизма гликогена будут обсуждаться на с. 219.