Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Регуляция метаболизма углеводов
Регуляция гликолиза, глюконеогенеза и пентозофосфатного пути
Индукция и репрессия синтеза ферментов
Наиболее полно изученные изменения активности ферментов, которые, как считают, происходят при различном состоянии обмена веществ, приведены в табл. 22.1. Данные, представленные в этой таблице, относятся главным образом к ферментам печени. Рассматриваемые ферменты катализируют неравновесные реакции, которые с точки зрения физиологии являются односторонними. Часто эффекты «в прямом направлении» оказываются более выраженными, поскольку одновременно противоположным образом меняется активность ферментов, катализирующих изменения в обратном направлении (рис. 22.2). Необходимо отметить, что все ключевые ферменты, участвующие в каком-либо пути метаболизма, активируются или ингибируются координированно, об этом свидетельствуют данные, представленные в табл. 22.1. Ферменты, участвующие в использовании глюкозы, т. е. ферменты гликолиза и липогенеза, становятся более активными при избытке глюкозы; в этих условиях активность ферментов, катализирующих образование глюкозы по пути глюконеогенеза, уменьшается. Секреция инсулина, которая изменяется в зависимости от концентрации глюкозы в крови, регулирует активность ферментов, участвующих в гликолизе. Вместе с глюкокортикоидами инсулин контролирует также активность ферментов, катализирующих реакции глюконеогенеза. Изменения активности, которые обусловлены синтезом ферментов, можно предотвратить с помощью веществ, блокирующих синтез белка, таких, как пуромицин и этионин.
Таблица 22.1. Регуляторные и адаптивные ферменты крысы (главным образом ферменты печени)
|
Активность при |
||||||
|
Ферменты |
приеме пищи богатой углеводами |
голодании и диабете |
Индуктор |
Репрессор |
Активатор |
Ингибитор |
|
Ферменты гликолиза и кликогенеза |
||||||
|
Гексикиназа |
Глюкозо-6-фосфат 1) |
|||||
|
Глюкокиназа |
↑ |
↓ |
Инсулин |
|||
|
Гликогенсинтазная система |
↑ |
↓ |
Инсулин |
Инсулин |
Глюкагон (сАМР), фосфорилаза, гликоген |
|
|
Фосфофруктокиназа-1 |
↑ |
↓ |
Инсулин |
АМР1), фруктозо-6-фосфат1), Рi1), фруктозо-2,6- биофосфат1) |
Цитрат (жирные кислоты, кетоновые тела)1), АТР1), глюкагон (сАМР) |
|
|
Пируваткиназа |
↑ |
↓ |
Инсулин, фруктоза |
Фруктозо-1,6-бисфосфат1) |
АТР, аланин, глюкагон (сАМР), адреналин |
|
|
Пируватдегидрогеназа |
↑ |
↓ |
СоА, NAD, инсулин2), ADP, пируват |
Ацетил-СоА, NADH, АТР (жирные кислоты, кетоновые тела) |
||
|
Ферменты глюконеогенеза |
||||||
|
Пируваткарбоксилаза |
↓ |
↑ |
Глюкокортикоиды, глюкагон, адреналин |
Инсулин |
Ацетил-СоА1) |
ADP1) |
|
Фосфоенолпируват- карбоксикиназа |
↓ |
↑ |
Глюкокортикоиды, глюкагон, адреналин |
Инсулин |
Глюкагон ? |
|
|
Фруктозо-1,6-бисфосфотаза |
↓ |
↑ |
Глюкокортикоиды, глюкагон, адреналин |
Инсулин |
Глюкагон (cAMP) |
Фруктозо-1,6-бисфосфат1),АМР1),фруктозо-2,6-бисфосфат |
|
Глюкозо-6-фосфатаза |
↓ |
↑ |
Глюкокортикоиды, глюкагон, адреналин |
Инсулин |
||
|
Ферменты пентозофосфатного пути и липогенеза |
||||||
|
Глюкозо-6-фосфат-дегидрогеназа |
↑ |
↓ |
Инсулин |
|||
|
6-Фосфоглюконат- дегидрогеназа |
↑ |
↓ |
Инсулин |
|||
|
«Яблочный» фермент |
↑ |
↓ |
Инсулин |
|||
|
АТР-цитрат-лиаза |
↑ |
↓ |
Инсулин |
ADP |
||
|
Ацетил-СоА-карбоксилаза |
↑ |
↓ |
Инсулин ? |
Цитрат1), инсулин |
Длинноцепочечный ацил-СоА, сАМР, глюкагон |
|
|
Синтаза жирных кислот |
↑ |
↓ |
Инсулин |
|||
1) Аллостерический.
2) В жировой ткани, но не в печени.

Рис. 22.2. Ключевые ферменты, участвующие в регуляции гликолиза, глюконеогенеза и метаболизма гликогена в печени. Указанное на схеме место действия гормона не предполагает прямого влияния на соответствующий фермент. Влияние сАМР на фосфофруктокиназу-1 и на фруктозо-1,6-бисфосфатазу осуществляется путем сочетания ковалентной модификации и аллостерического эффекта (см. рис. 22.4). Аланин в высоких концентрациях ингибирует гликолиз на стадии, катализируемой пируваткиназой, и, таким образом, действует как «сигнал глюконеогенеза»

Рис. 22.3. Регуляция активности пируватдегидрогеназы (ПДГ). Аллостерические эффекты показаны волнистыми стрелками. А — регуляция путем ингибирования конечным продуктом; Б — регуляция путем взаимного превращения активной и неактивной форм фермента.
Обе дегидрогеназы пентозофосфатного пути можно классифицировать как адаптивные ферменты, поскольку их активность увеличивается у животных в условиях хорошего питания, а также при введении инсулина животным, страдающим диабетом. При диабете и голодании эти ферменты малоактивны. «Яблочный» фермент и АТР-цитратлиаза ведут себя подобным образом; это позволяет заключить, что они участвуют в липогенезе, а не в глюконеогенезе.
Ковалентная модификация
Активность пируватдегидрогеназы может регулироваться как путем фосфорилирования, катализируемого ATP-специфичной киназой и приводящего к уменьшению активности, так и путем дефосфорилирования под действием фосфатазы, приводящего к увеличению активности дегидрогеназы. При увеличении соотношений [ацетил-СоА]/[СоА], [NADH]/[NAD+] и [ATP]/[ADP] киназа становится более активной. Следовательно, пируватдегидрогеназа и гликолиз ингибируются при окислении жирных кислот, в процессе которого эти соотношения увеличиваются (рис. 22.3). При голодании активность дегидрогеназы уменьшается, а при действии инсулина увеличивается в жировой ткани (но не в печени). Глюкагон ингибирует гликолиз и активирует процесс глюконеогенеза в печени путем увеличения концентрации сАМР, что в свою очередь вызывает повышение активности сАМР-зависимой протеинкиназы; последняя фосфорилирует и инактивирует пируват-киназу. Глюкагон влияет также на концентрацию фруктозо-2,6-бисфосфата, а следовательно, и на протекание гликолиза и глюконеогенеза; эти вопросы рассматриваются ниже.
Аллостерическая модификация
Аллостерический контроль осуществляется при регуляции активности ряда ферментов углеводного обмена. При биосинтезе в ходе глюконеогенеза оксалоацетата из бикарбоната и пирувата, катализируемого пируваткарбоксилазой, в качестве аллостерического активатора выступает ацетил-СоА. Последний изменяет конформацию белка, в результате уменьшается величина Км для бикарбоната. Этот эффект имеет важное значение для саморегуляции промежуточного обмена веществ, поскольку ацетил-СоА, образующийся из пирувата, активирует пируваткарбоксилазу и тем самым способствует образованию оксалоацетата и его дальнейшему окислению в цикле лимонной кислоты. Активация пируваткарбоксилазы и ингибирование пируватдегидрогеназы, которые вызываются ацетил-СоА, образующимся при окислении жирных кислот, позволяют понять тормозящее действие окисления жирных кислот на окисление пирувата и активирующее влияние на глюконеогенез в печени. Как в печени, так и в почках регуляция активностей пируватдегидрогеназы и пируваткарбоксилазы имеет реципрокный характер, благодаря этому метаболическая судьба пирувата изменяется при переходе от окисления углеводов, начинающегося с гликолиза, к глюконеогенезу (рис. 22.2). Окисление жирных кислот обеспечивает глюконеогенез, поставляя АТР, необходимый для протекания реакций, которые катализируются пируваткарбоксилазой и фосфоенолпируваткарбоксикиназой.
Фосфофруктокиназа (фосфофруктокиназа-1) является еще одним ферментом, регуляция которого осуществляется по принципу обратной связи. Этот фермент играет ключевую роль в регуляции гликолиза. Фосфофруктокиназа-1 ингибируется цитратом и АТР и активируется АМР. Последний функционирует как своего рода индикатор энергетического состояния клетки. Благодаря присутствию аденилаткиназы в клетках печени и многих других тканей быстро достигается равновесие в реакции
АТР + АМР ↔ 2ADP
Таким образом, при расходовании АТР в потребляющих энергию реакциях и образовании ADP возрастает концентрация АМР. Поскольку в исходном равновесии концентрация АТР может в 50 раз превышать концентрацию АМР, то при сравнительно небольшом уменьшении концентрации АТР может многократно увеличиться концентрация АМР. Таким образом, большое увеличение концентрации АМР действует как своего рода метаболический усилитель при незначительном изменении концентрации АТР. Данный механизм делает фосфофруктокиназу-1 высокочувствительной к небольшим изменениям энергетического состояния клетки и позволяет регулировать количество углеводов, подвергающихся гликолизу, до их вступления в цикл лимонной кислоты. Увеличение концентрации АМР позволяет также объяснить, почему процесс гликолиза усиливается при недостатке кислорода, когда концентрация АТР снижается. Одновременно АМР активирует фосфорилазу и тем самым усиливает гликогенолиз. Ингибирование фосфофруктокиназы-1 цитратом и АТР является еще одним путем, который объясняет тормозящее действие окисления жирных кислот на окисление глюкозы; это ингибирование объясняет также эффект Пастера, заключающийся в том, что аэробное окисление субстратов в цикле лимонной кислоты ингибирует анаэробное расщепление глюкозы. Следствием ингибирования фосфофруктокиназы-1 является также накопление глюкозо-6-фосфата, который снижает поступление глюкозы во внепеченочные ткани путем аллостерического ингибирования гексокиназы.
Роль фруктозо-2,6-бисфосфата
Наиболее мощным аллостерическим активатором фосфофруктокиназы-1 и ингибитором фруктозо-1,6-бисфосфатазы печени является фруктозо-2,6-бисфосфат. Он снижает ингибирующее действие АТР на фосфофруктокиназу-1 и увеличивает сродство этого фермента к фруктозо-6-фосфату. При ингибировании фруктозо-1,6-бисфосфатазы фруктозо-2,6-бисфосфатом происходит увеличение Км для фруктозо-1,6-бисфосфата. Концентрация фруктозо-2,6-бисфосфата регулируется концентрацией фруктозо-6-фосфата и гормонами (рис. 22.4). Фруктозо-2,6-бисфосфат образуется при фосфорилировании фруктозо-6-фосфата, катализируемом фосфофруктокиназой-2. Этот фермент является бифункциональным (он обладает также фруктозо-2,6-бисфосфатазной активностью) и находится под аллостерическим контролем фруктозо-6-фосфата (при повышении концентрации фруктозо-6-фосфата, наблюдаемой в случае избытка глюкозы, происходит стимулирование киназной и ингибирование фосфатазной активности). С другой стороны, при снижении концентрации глюкозы глюкагон стимулирует образование сАМР; последний активирует сАМР-зависимую протеинкиназу, которая в свою очередь ингибирует фосфофруктокиназу-2 и активирует фруктозо-2,6-бисфосфатазу путем фосфорилирования. Таким образом, при избытке глюкозы увеличивается концентрация фруктозо-2,6-бисфосфата, который активирует фосфофруктокиназу-1 и ингибирует фруктозо-1,6-бисфосфатазу; в результате происходит стимулирование гликолиза. При недостатке глюкозы гликагон уменьшает концентрацию фруктозо-2,6-бисфосфата; это приводит (рис. 22.4) к снижению активности фосфофруктокиназы-1 и повышению активности фруктозо-1,6-бисфосфатазы, в результате чего стимулируется глюконеогенез. Рассмотренный механизм регуляции позволяет понять, каким образом при стимулировании гликогенолиза глюкагоном происходит высвобождение глюкозы и тормозится ее превращение по гликолитическому пути.
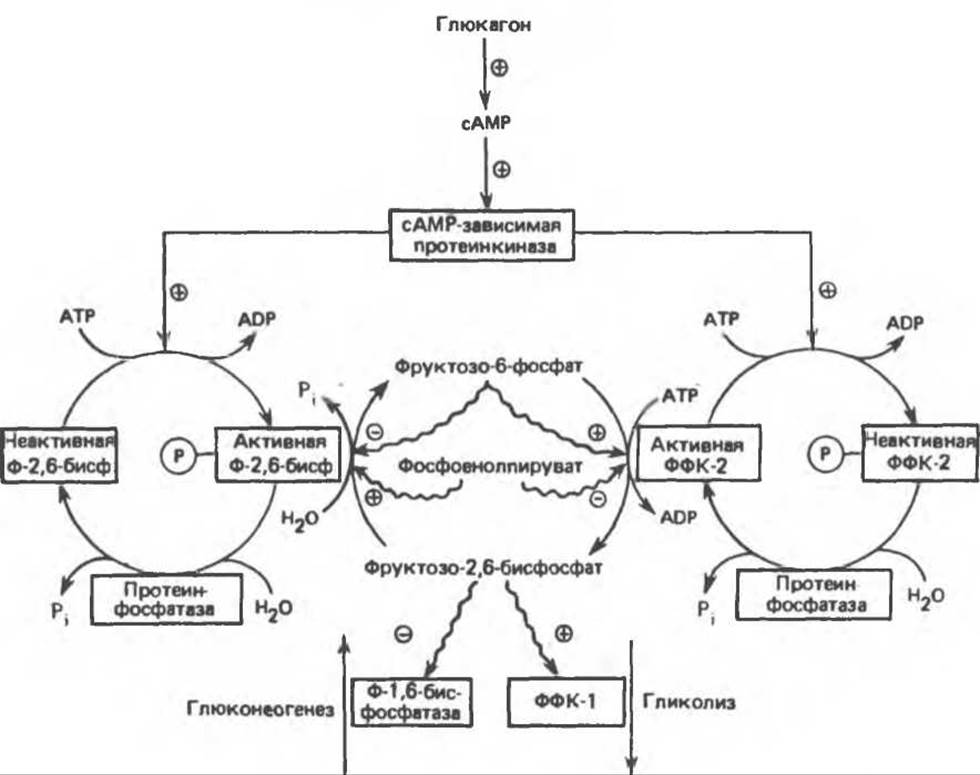
Рис. 22.4. Регуляция гликолиза и глюконеогенеза в печени фруктозо-2,6-бисфосфатом. Ф-1,6-бисфосфатаза фруктозо-1,6-бисфосфатаза; Ф-2,6-бисфосфатаза фруктозо-2.6-бисфосфатаза; ФФК-1 6-фосфофрукто-1-киназа; ФФК-2 6-фосфофрукто-2-киназа. Аллостерическое действие показано стрелками.