Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Пептиды
Структура пептидов
Общие сведения о структуре пептида
На рис. 4.1 изображен трипептид, состоящий из аминокислотных остатков аланина, цистеина и валина. Отметим, что трипептид содержит три остатка, но не три пептидные связи. Структуру пептида принято изображать так, чтобы N-концевой остаток (содержащий свободную а-аминогруппу) располагался слева, а С-концевой остаток (со свободной а- карбоксильной группой) — справа. Такой пептид имеет только одну свободную а-аминогруппу и только одну а-карбоксильную группу. Это справедливо для всех полипептидов, которые образованы только аминокислотными остатками, соединенными друг с другом пептидными связями, образовавшимися между а-аминогруппой и а-карбоксильной группой. В некоторых пептидах концевая аминогруппа или концевая карбоксильная группа модифицирована (примером могут служить ацильное производное аминогруппы или амид карбоксильной группы) и, таким образом, не является свободной.
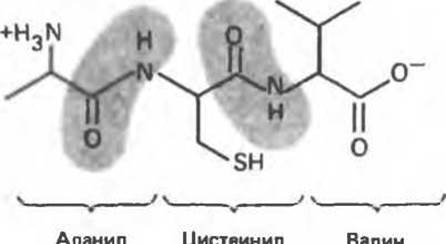
Рис. 4.1. Структурная формула трипептида. Пептидные связи для наглядности затенены.
Запись структурной формулы пептидов
Укажем самый простой способ записи. Во-первых, нарисуем «остов» из связанных друг с другом a-NH2- и a-СООН-групп и из атомов а-углерода. Эти группы чередуются вдоль остова цепи. Затем подсоединим к a-углеродным атомам соответствующие боковые группы. Опишем эту процедуру подробнее.
1. Вычертим зигзагообразную линию произвольной длины и добавим слева N-концевую аминогруппу:
![]()
2. Встроим в цепочку а-углеродные атомы, а-карбоксильную и а-аминную группы:

3. Присоединим соответствующие R-группы (они затенены) и атомы а-водорода к а-углеродным атомам:

Рис. 4.2. Представление первичной структуры гексапептида с помощью трехбуквенных и однобуквенных обозначений аминокислотных остатков. Данный гексапептид содержит на N-конце глутамат (Glu. Е), а на С-конце аланин (Ala, А).
Первичная структура пептида
Линейная последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой пептида. Чтобы определить первичную структуру Полипептида, нужно установить число, химическую структуру и порядок расположения всех аминокислотных остатков, входящих в его состав.
Полипептиды (белки) могут содержать 100 и более остатков, поэтому традиционные структурные формулы оказываются неудобными для представления первичной структуры. «Химическая скоропись» использует либо трехбуквенные, либо однобуквенные обозначения аминокислот, выписанные во втором столбце табл. 3.3 (рис. 4.2). При наименовании пептида его рассматривают как производное С-концевого аминокислотного остатка.
Если первичная структура однозначно установлена, то трехбуквенные обозначения аминокислотных остатков соединяют черточками. Однобуквенные обозначения черточками не соединяют. Если на каком-то участке полипептидной цепи точный порядок следования аминокислотных остатков неизвестен, эти остатки заключают в скобки и разделяют запятыми (рис. 4.3).
![]()
Рис. 4.3. Гептапептид, содержащий участок, точная первичная структура которого не установлена.
Физиологические последствия изменений в первичной структуре
Замена всего одной аминокислоты на другую в линейной последовательности из 100 и более аминокислот может привести к снижению или полной потере биологической активности пептида, а это повлечет за собой весьма серьезные последствия (в качестве примера можно привести серповидноклеточную анемию; см. гл. 6). Многие наследуемые нарушения метаболизма обусловлены именно одиночными заменами такого типа. С развитием новых мощных методов определения структуры белков и ДНК удалось выяснить биохимическую основу многих наследуемых болезней, связанных с нарушениями метаболизма.