Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Пептиды
Автоматическое определение аминокислотной последовательности полипептидов методом Эдмана
Разделение на линейные полипептиды
Молекулы многих белков содержат более одной полипептидной цепи; эти цепи связаны либо нековалентными связями, либо дисульфидными мостиками. Поэтому первым шагом должно быть выделение индивидуальных полипептидных цепей. Диссоциацию нековалентно связанных полипептидов проводят с помощью денатурирующих агентов (мочевины, гуанидингидрохлорида), которые разрывают водородные связи. Дисульфидные мостики разрушают с помощью окисляющих и восстанавливающих агентов (рис. 4.10). Затем проводят хроматографическое разделение полипептидов.
Расщепление полипептида на фрагменты, пригодные для автоматического секвенирования
Приборы для автоматического секвенирования (секвенаторы) работают наиболее эффективно, когда длина полипептидов составляет 20—60 остатков. Эти требования в значительной мере способствовали разработке методов расщепления полипептидов на фрагменты нужного размера и их очистки. Основной задачей стало не получение большого числа малых фрагментов, пригодных для ручного секвенирования, а расщепление на малое число крупных фрагментов (от 30 до 100 остатков). При этом желательно было осуществить полное высокоспецифичное расщепление по ограниченному числу связей. Этим требованиям отвечает расщепление цианогенбромидом (CNBr), трипсином и о-иодозобензолом.
A. CNBr. Предварительно проводят модификацию остатков цистеина иодоуксусной кислотой. Далее с помощью CNBr специфически расщепляют связи на СООН-стороне от остатков метионина, в большинстве случаев с количественным выходом. Остатки метионина в полипептидах встречаются достаточно редко, поэтому в результате такого расщепления образуются пептидные фрагменты желаемого размера.

Рис. 4.10. Две соседние полипептидные цепи соединены дисульфидной связью (затенена). Расщепление этой связи путем окисления надмуравьиной кислотой (слева) или путем восстановления ß-меркаптоэтанолом (справа) приводит к образованию двух пептидов, содержащих остатки цистеиновой кислоты или цистеина соответственно.
Б. Трипсин. Трипсин расщепляет связи на СООН-стороне от остатков лизина и аргинина. Чтобы ограничить число мест разрыва, остатки лизина предварительно модифицируют цитраконовым ангидридом (реакция носит обратимый характер); в результате положительный заряд остатков лизина заменяется на отрицательный. Модификация остатков аргинина менее целесообразна, поскольку остатки лизина встречаются относительно чаще. Однако она бывает полезна для дальнейшего расщепления CNBr-фрагментов.
В. о-Иодозобензол. Этот реагент специфически и с количественным выходом расщепляет сравнительно редкие связи типа Тrр-Х. Предварительной защиты других остатков при этом не требуется.
Г. Гидроксиламин. Гидроксиламин расщепляет сравнительно редко встречающиеся связи Asn-Gly, но выход не является количественным.
Д. Протеаза из Staphylococcus aureus V8 расщепляет связи типа Glu-X, преимущественно в тех случаях, когда X — гидрофобный остаток. Связь Glu-Lys не расщепляется. Эта реакция полезна также для последующего расщепления CNBr-фрагментов.
Е. Мягкий кислотный гидролиз. Расщеплению подвергаются редко встречающиеся связи Asp-Pro.
Двух-трех наборов фрагментов, обычно получаемых при расщеплении исходного полипептида по остаткам Met, Тrр, Arg и по связям Asn-Gly, вместе с субфрагментами, полученными при дополнительном расщеплении, обычно оказывается достаточно для определения полной первичной структуры полипептида. Если не возникает каких-либо непредвиденных трудностей в очистке фрагментов, то при должной тщательности для всей процедуры необходимо всего несколько микромолей полипептида.
Фрагменты очищают с помощью гель- фильтрации в уксусной или муравьиной кислоте (рис. 4.7), с помощью жидкостной хроматографии с обращенной фазой при высоком давлении (рис. 4.8) или ионообменной хроматографии на фосфоцеллюлозе или на сульфофенил-сефадексе.
Реагент Эдмана и реакция Эдмана
При автоматическом секвенировании вместо реагента Сенгера применяют фенилизотиоцианат (реагент Эдмана); в результате реакции происходит отщепление N-концевого остатка в виде его фенилтиогидантоинового производного (реакция Эдмана; рис. 4.11).
Все реакции протекают в пленке раствора, которая покрывает стенки вращающейся цилиндрической камеры. Это облегчает экстракцию и последующее удаление растворителей. Несколько фирм выпускают приборы, позволяющие проводить полностью автоматизированное определение последовательности полипептидов, содержащих до 30—40 остатков (в некоторых случаях до 60 или даже до 80 остатков) за один прогон. В прибор заложена программа последовательного отщепления по Эдману N-концевых остатков полипептида. После отщепления, выделения и идентификации исходной N-концевой аминокислоты (рис. 4.11) образуется эдмановское производное следующей аминокислоты и т. д. Идентификацию фенилтиогидантоиновых производных производят с помощью жидкостной хроматографии под давлением. На таком приборе можно определить последовательность значительно более длинных участков, чем при секвенировании вручную, причем гораздо быстрее.

Рис. 4.11. Образование фенилтиогидантоина из аминокислоты (или N-концевого остатка полипептида). Фенилизотиоцианат реагирует с аминогруппами аминокислот или пептидов с образованием фенилтиогидантоиновых производных. Последующая их обработка кислотой в растворителях, не содержащих гидроксильных Трупп, приводит к циклизации производных с образованием фенилтиогидантоинов. Эта реакция, позволяющая идентифицировать N-концевой остаток пептида, используется при автоматическом секвенировании полипептидов.
Установление полной первичной структуры путем сравнения последовательностей перекрывающихся пептидов
Последний шаг состоит в воссоздании последовательности, в которой просеквенированные пептиды располагались в исходном белке. Для этого необходимо иметь пептиды, полученные разными методами в результате разрыва белковой цепи в различных местах (например, с использованием трипсина и химотрипсина). Сопоставив последовательности полученных пептидов, однозначно устанавливают первичную структуру (рис. 4.12).
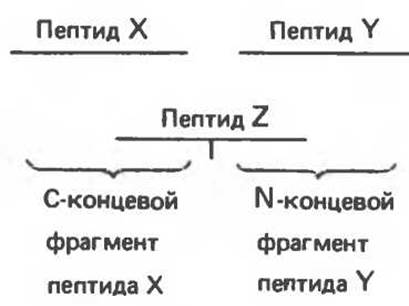
Рис. 4.12. Используя пептид Z, последовательность которого перекрывается с последовательностями пептидов X и Y, можно установить, что в исходном белке пептиды X и Y располагаются в порядке X→Y, но не Y→X.