Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Белки: структура и свойства
Связи, ответственные за формирование структуры белка
Первичная структура белков формируется в результате соединения L-a-аминокислот пептидными связями. Об этом свидетельствует множество различных данных, однако наиболее убедительным доказательством стал химический синтез инсулина и рибонуклеазы, осуществленный путем последовательного соединения аминокислот пептидными связями.
Структура большинства белков стабилизируется двумя классами прочных связей (пептидных и дисульфидных) и тремя классами слабых связей (водородных, гидрофобных и электростатических, т. е. солевых).
Жесткость пептидной связи
В структурных формулах пептидов связь между карбонильной группой и атомом a-азота изображается как одинарная, однако на самом деле эта связь между атомами углерода и азота носит характер частично двойной связи (рис. 5.1). Свободное вращение вокруг нее невозможно, и все четыре атома на рис. 5.1 лежат в одной плоскости (компланарны). Вращение же вокруг остальных связей полипептидного остова, наоборот, достаточно свободно. Это положение иллюстрирует рис. 5.2, где связи, вокруг которых возможно свободное вращение, охвачены круглыми стрелками, а группы компланарных атомов затенены. Эта полужесткость ведет к важным последствиям, сказывающимся на более высоких уровнях структурной организации белка.
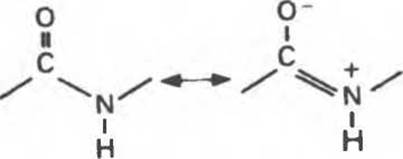
Рис. 5.1. Резонансная стабилизация пептидной связи придает ей характер частично двойной связи; этим объясняется жесткость связи С—N.
Межцепочечные и внутрицепочечные поперечные дисульфидные связи
Дисульфидная связь образуется между двумя остатками цистеина и «сшивает» два участка полипептидной цепи (или цепей), которым принадлежат эти остатки. Эта связь остается стабильной в тех условиях, при которых белок обычно денатурирует. Обработка белка надмуравьиной кислотой (окисляющей связи S—S) или ß-меркаптоэтанолом (восстанавливающим связи S—S с регенерацией двух остатков цистеина) приводит к разделению полипептидных цепей, связанных дисульфидными связями; их первичная структура при этом не затрагивается (см. рис. 4.10).
Стабилизация полипептидов межцепочечными и внутрицепочечными водородными связями
Водородные связи образуются 1) между группами, входящими в состав боковых цепей и способными к формированию водородных связей; 2) между атомами азота и кислорода, принадлежащими пептидным группам остова; 3) между полярными остатками, расположенными на поверхности молекулы белка, и молекулами воды. Все они играют важную роль в стабилизации вторичной, третичной и т.д. структур белка (см. разд. «а-Спираль» и «Складчатый ß-слой»).

Рис. 5.2. Параметры полностью вытянутой полипептидной цепи. Четыре атома, расположенные в затененных областях, компланарны и образуют пептидную связь. В незатененных областях находятся атом а-углерода, атом а-водорода и a-R-группа соответствующей аминокислоты. Вокруг связей, соединяющих а-углерод с а-азотом и а- карбонилом, возможно свободное вращение (показано стрелками). Таким образом, вытянутая полипептидная цепь — это полужесткая структура, в которой две трети атомов остова- (если рассматривать атомы по группам, образующим пептидную связь) занимают друг относительно друга фиксированное положение и находятся в одной плоскости. Расстояние между соседними атомами а-углерода 0,36 нм. Показаны также другие межатомные расстояния и валентные углы (они неэквивалентны). (С разрешения, из работы Pauling L., Corey R. В, Branson Н. R.: The structure of proteins. Two hydrogen-bonded helical configurations of the polypeptide chain. Proc. Natl. Acad. Sсi. USA 1951:37:205.)
Гидрофобные взаимодействия
Неполярные боковые цепи нейтральных аминокислот в белках имеют тенденцию к ассоциации. Стехиометрические соотношения при этом не соблюдаются, так что никаких связей в обычном смысле не возникает. Тем не менее эти взаимодействия играют важную роль в поддержании структуры белка.
Электростатические связи
Эти солевые связи возникают между разноименно заряженными группами, входящими в состав боковых цепей аминокислот. Например, ε-аминогруппа лизина при физиологических pH несет заряд +1, а карбоксильная группа аспартата или глутамата в составе боковой цепи несет заряд -1. Следовательно, эти группы могут электростатически взаимодействовать, стабилизируя структуру белка.
Прочность связей
В ходе денатурации белков (например, при обработке мочевиной или додецилсульфатом натрия в присутствии избытка ионов Н++ и ОН-) водородные и гидрофобные связи, а также связи электростатической природы разрушаются, а пептидные и дисульфидные сохраняются.