Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Каталитический центр
Размеры белков намного превышают размеры низкомолекулярных субстратов, в связи с чем возникло представление о том, что в катализе участвует лишь ограниченная область молекулы фермента. Эту область мы и называем каталитическим центром. Вначале было непонятно, почему молекулы ферментов столь велики, если только часть их структуры участвует в связывании субстрата и непосредственно в катализе. Однако, как показал анализ трехмерной структуры ферментов, с субстратом взаимодействует намного большая часть белковой молекулы, чем предполагалось ранее. Если еще учесть включение в работу ферментов аллостерических центров такого же размера (см. гл. 10), не приходится удивляться объемности ферментов.
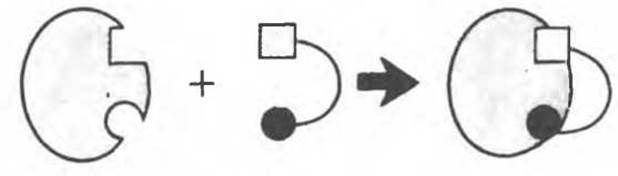
Рис. 8.5. Образование комплекса Enz S согласно модели «жесткой матрицы» Фишера.
Модель «ключ—замок»
Первоначальная модель каталитического центра, предложенная Эмилем Фишером, трактовала взаимодействие субстрата и фермента по аналогии с системой «ключ — замок». Эта модель, которую иногда называют моделью «жесткой матрицы» (рис. 8.5), не утратила своего значения для понимания некоторых свойств ферментов, например их способности к строго определенному связыванию двух или большего числа субстратов (рис. 8.6), или для объяснения кинетики насыщения субстратом.
Модель индуцированного соответствия
Недостатком модели Фишера является подразумеваемая в ней жесткость каталитического центра. Более общий характер имеет модель индуцированного соответствия, предложенная Кошландом. Эта модель основывается на весьма убедительных экспериментальных данных. Ее существенной чертой является гибкость каталитического центра. В модели Фишера каталитический центр считается заранее подогнанным под форму молекулы субстрата. В модели же индуцированного соответствия субстрат индуцирует конформационные изменения фермента, и лишь в результате этих изменений аминокислотные остатки и другие группы фермента принимают пространственную ориентацию, необходимую для связывания субстрата и катализа. При этом другие аминокислотные остатки могут погрузиться в глубь молекулы фермента.
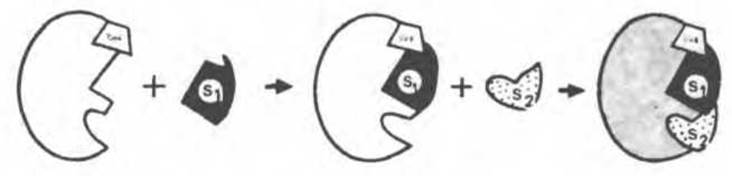
Рис. 8.6. Последовательное связывание ферментом кофермента (СоЕ) и двух субстратов (S1 и S2) в рамках гипотезы «жесткой матрицы». Предполагается, что кофермент содержит участок, способный связывать первый субстрат (S1); после связывания первого субстрата облегчается связывание второго субстрата S2.
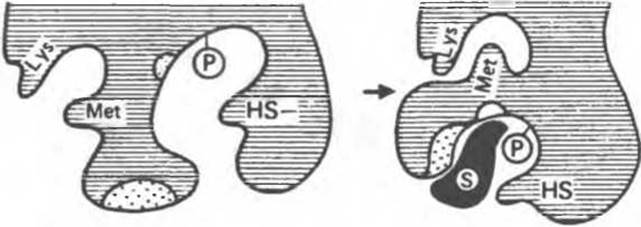
Рис. 8.7. Схематическое представление конформационных изменений в молекуле фермента при связывании субстрата согласно модели индуцированного соответствия. Обратите внимание на расположение ключевых остатков до и после связывания субстрата (по Кошланду).
В примере, приведенном на рис. 8.7, в связывании субстрата принимают участие гидрофобные и заряженные группы (области, выделенные точками). Непосредственно в катализе участвуют остаток фосфосерина (Р) и — SH-группа цистеина. Другие остатки, не вовлеченные ни в тот, ни в другой процесс, представлены остатками Lys и Met. В отсутствие субстрата каталитические и субстратсвязывающие группы находятся друг от друга на расстоянии, в несколько раз превышающем длину связи. Субстрат по мере сближения с ферментом индуцирует в последнем конформационные изменения, в результате которых соответствующие группы занимают положение, необходимое для связывания субстрата и для катализа. Одновременно меняется пространственное расположение других остатков — Lys и Met теперь оказываются сближенными (рис. 8.7).
Аналоги субстрата тоже могут вызывать конформационные изменения, но не все из них являются «правильными» (рис. 8.8). При связывании истинного субстрата (А) все группы (черные кружочки) занимают нужное положение. При связывании же аналога субстрата — более объемного (рис. 8.8,Б) или, наоборот, меньшего по размеру (рис. 8.8,В) — индуцируется неправильное расположение этих групп. Еще одной структурной особенностью фермента является небольшая выемка в правой части. Представим, что в эту выемку попадает регуляторная молекула, «удерживающая» один из полипептидных участков, который несет каталитическую группу, от перемещения. Тогда будет происходить лишь связывание субстрата, но не катализ.
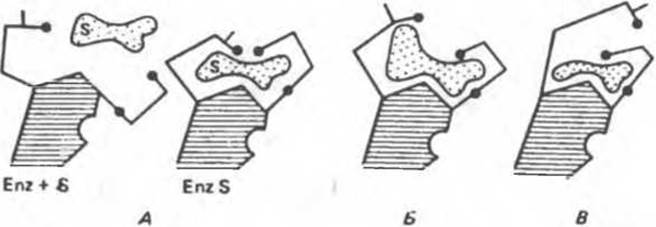
Рис. 8.8. Схематическое представление конформационных изменений в ферменте при связывании истинного субстрата (А) и его аналогов (Б, В).

Рис. 8.9. Схема альтернативных путей реакции при индуцировании субстратом конформационных изменений в ферменте. Фермент сначала претерпевает конформационное изменение (А), затем связывает субстрат (Б). На альтернативном пути фермент сначала связывает субстрат (В), а затем претерпевает конформационное изменение (Д). Наконец, оба процесса могут развиваться согласованным образом (Г) с образованием конечной конформации (Е).
Остается выяснить точную последовательность событий, из которых складываются индуцированные субстратом конформационные изменения. Здесь возможно несколько путей, представленных на рис. 8.9.
Предположим, что нам известна полная первичная структура фермента. Даже в этом случае обычно бывает трудно решить, из каких именно остатков формируется каталитический центр. Как явствует из модели индуцированного соответствия, эти остатки могут располагаться далеко один от другого в первичной структуре, но быть сближены в трехмерной (третичной) структуре.
В формировании каталитического центра принимают участие аминокислотные остатки нескольких сегментов полипептидной цепи, как в случае гемоглобина (гл. 6) или химотрипсина (гл. 9).
Каталитический центр лизоцима
Лизоцим присутствует в составе слез, носовой слизи, слюны, желудочного секрета, в различных тканях, а также в молоке и яичном белке. Этот фермент катализирует гидролиз ß-1,4-связей N-ацетилнейраминовой кислоты (см. гл. 13 и 33), входящей в состав протеогликанов и глюкозаминогликанов. Лизоцим, присутствующий в слезах и носовой слизи, разрушает клеточные стенки многих попадающих из воздуха грамположительных бактерий. Лизоцим (мол. масса около 15 000) образован одной полипептидной цепью, содержащей 129 остатков. Поскольку в составе молекулы нет ни кофермента, ни ионов металлов, катализ, специфичность и трехмерная структура лизоцима целиком определяются аминокислотной последовательностью. В молекуле имеются небольшие области складчатого слоя, несколько коротких а-спиралей и достаточно большие участки с нерегулярной структурой. Цветной снимок трехмерной модели лизоцима в комплексе с субстратом можно найти в работе J. Biol. Chem. 1968: 243, 1663. Посредине молекулы лизоцима проходит глубокая щель, в которой находятся остатки, формирующие каталитический центр и субстратсвязывающую область; последняя содержит шесть участков, взаимодействующих с разными субстратами или ингибиторами (рис. 8.10). Остатки, ответственные за расщепление связи, располагаются между участками D и Е; наиболее важную роль играют карбоксильные группы остатков Asp 52 и Glu 35. Последний, по всей вероятности, протонирует гликозидную связь субстрата, а отрицательно заряженный остаток Asp 52, располагающийся на противоположной стороне, стабилизирует образующийся в результате карбониевый ион.
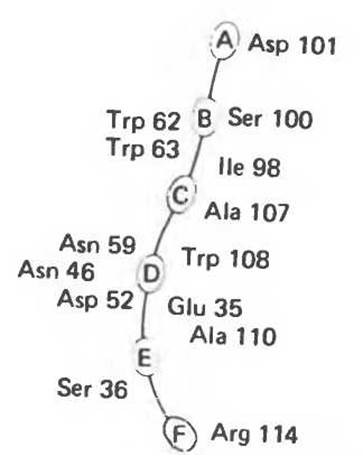
Рис. 8.10. Схематическое представление каталитического центра, расположенного в щели, которая проходит посредине молекулы лизоцима. Гликозильные звенья гексасахарида обозначены буквами от А до F. Указаны некоторые остатки, выстилающие щель активного центра, и их номера в аминокислотной последовательности лизоцима.
Каталитический центр рибонуклеазы
В отличие от ситуации с лизоцимом информация о каталитическом центре рибонуклеазы была в значительной мере получена еще до определения ее трехмерной структуры. Выводы, основанные на химических исследованиях, подтверждены кристаллографическими данными. В молекуле рибонуклеазы тоже имеется щель, сходная со щелью в лизоциме, в которую выступают два остатка, His 12 и His 119. Из полученных ранее химических данных следовало, что эти остатки входят в состав каталитического центра. Оба они располагаются вблизи места связывания уридиловой кислоты (рис. 8.11).

Рис. 8.11. Структура рибонуклеазы по данным рентгеноструктурного анализа. Указаны номера специфических остатков. (См. также рис. 5.7.)
Аминокислотные последовательности в области каталитического центра
Первичная структура в окрестности каталитического центра у различных семейств гидролитических ферментов оказывается довольно близкой (табл. 8.1). Это позволяет предполагать, что механизмы гидролиза связей в биологических системах относительно немногочисленны. Поэтому неудивительно, что аминокислотные последовательности в области каталитического центра у одного и того же фермента, выделенного из разных видов, еще более сходны.