Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Ограничения, присущие уравнению Михаэлиса-Ментен
Некоторые ферменты и другие лигандсвязывающие белки, например гемоглобин (см. гл. 6 и 10), не подчиняются классической кинетике насыщения Михаэлиса—Ментен. График зависимости v от [S] носит в этом случае сигмоидный характер (рис. 8.17). Это обычно указывает на кооперативное связывание субстрата многими центрами — связывание с одним центром влияет на связывание с другим, как это происходит с гемоглобином (гл. 6).
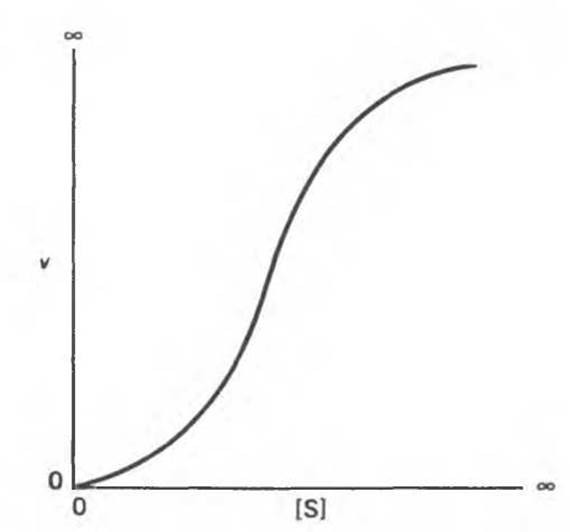
Рис. 8.17. Сигмоидная кинетическая кривая с насыщением.
В таком случае описанный выше метод графической оценки концентрации субстрата, при которой скорость реакции составляет половину максимальной, оказывается непригодным (прямой в соответствующих координатах уже не получается). Здесь следует обратиться к графическому представлению уравнения Хилла, первоначально предложенного для описания кооперативного связывания О2 с гемоглобином (гл. 6). Уравнение Хилла, преобразованное так, чтобы график в соответствующих координатах представлял собой прямую, имеет вид
![]()
где k' — константа. Из уравнения следует, что в условиях, когда [S] мало по сравнению с k', скорость реакции возрастает как n-я степень [S]. На рис. 8.18 приведен график Хилла, построенный по кинетическим данным для фермента, характеризующегося кооперативным связыванием субстрата. График зависимости log (v/Vmax — v) от log [S] представляет собой прямую с тангенсом угла наклона, равным и, где n — эмпирический параметр, зависящий от числа субстратсвязывающих центров и характера взаимодействия между ними. При n = 1 связывающие центры не зависят друг от друга. При n > 1 между центрами имеется кооперативное взаимодействие; чем больше и, тем выше степень кооперативности и тем более выражена сигмоидность кривых насыщения. При n < 1 говорят об отрицательной кооперативности.
Когда скорость реакции равна половине максимальной (v = Vmax/2), v/(Vmax—v) = 1 и log [v/(Vmax — v)] = 0. Таким образом, чтобы определить величину S50 (концентрацию субстрата, при которой скорость вдвое меньше максимальной), нужно из точки на прямой, для которой log [v((Vmax—v)] = 0, опустить перпендикуляр на ось х.

Рис. 8.18. Графический способ определения из уравнения Хилла концентрации субстрата, при которой скорость реакции составляет половину максимальной, в условиях, когда кинетическая кривая носит сигмоидный характер.