Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: механизм действия
Механизм каталитического действия химотропсина
Природа и специфичность полной реакции
Химотрипсин катализирует гидролиз пептидных связей, в которых карбоксильная группа принадлежит ароматической аминокислоте (Phe, Туr или Тrр) или аминокислоте с объемной неполярной R-группой (Met).
Как и многие другие протеазы, химотрипсин катализирует также гидролиз некоторых сложных эфиров. Эта его способность не имеет физиологического значения, но она успешно используется в экспериментах, направленных на детальное изучение механизма катализа.
n-Нитрофен ил ацетат, полезный синтетический субстрат
Использование синтетического субстрата «нитрофенилацетата (рис. 9.1) позволяет определять активность химотрипсина колориметрическими методами, поскольку гидролиз n-нитрофенилацетата приводит к образованию n-нитрофенола, который в щелочной среде превращается в имеющий желтую окраску n-нитрофенолят-анион.
Изучение кинетики методом остановленной струи
Кинетику гидролиза n-нитрофенилацетата химотрипсином можно изучать с помощью так называемого метода остановленной струи. Метод состоит в смешивании примерно эквимолярных количеств фермента и субстрата и немедленном (в течение несколько миллисекунд) измерении. Растворы реагентов заливают в два шприца и с помощью механического устройства одновременно и практически мгновенно выталкивают их в очень узкую трубку, проходящую через спектрофотометр. На экран осциллографа выводятся данные об оптической плотности как функции времени, прошедшего с момента смешивания.
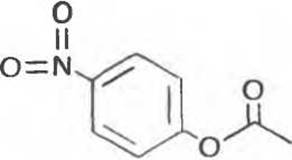
Рис. 9.1. n-Нитрофенилацетат.
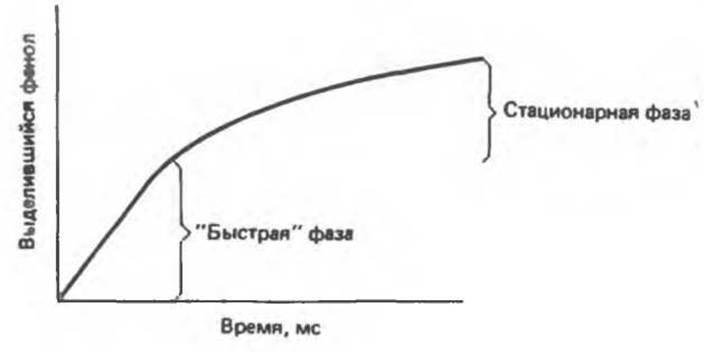
Рис. 9.2. Кинетика освобождения n-нитрофeнолят-аниона в ходе гидролиза n-нитрофснилацетата химотрипсином, регистрируемая методом остановленной струи. Количество выделившегося «-нитрофенола определяется путем измерения оптической плотности.
Двухфазный характер гидролиза n-нитрофенилацетата
Кинетическая кривая образования n-нитрофенолят-аниона имеет две четко различающиеся фазы (рис. 9.2): 1) фаза «выброса», характеризующаяся быстрым образованием n-нитрофенолят-аниона, 2) последующее медленное образование еще некоторого количества n-нитрофенолят-аниона.
Образование и распад фермент-субстратного комплекса
Двухфазный характер образования n-нитрофенолят-аниона можно объяснить, рассматривая последовательные стадии катализа, приведенные на рис. 9.3.
Медленная стадия представляет собой гидролиз химотрипсин-ацетатного комплекса (ХТ-Ац). После того как весь имеющийся химотрипсин перейдет в состав комплекса, выделение n-нитрофенолят-аниона замедлится из-за отсутствия свободного фермента, который освобождается лишь по мере медленного отщепления от комплекса ацетат-иона (рис. 9.3). Фаза «выброса» n-нитрофенолят-аниона (рис. 9.2) соответствует переходу всего имеющегося химотрипсина в состав комплекса ХТ-Ац с одновременным образованием n-нитрофенолят-аниона. Освобождение этого продукта сразу вслед за быстрой фазой обусловлено медленным высвобождением химотрипсина в процессе гидролиза комплекса ХТ-Ац. Этот свободный химотрипсин снова включается в реакцию образования комплексов ХТ-ПНФ и ХТ-Ац, сопровождающуюся выделением n-нитрофенолят-аниона. Количество выделившегося n-нитрофенолят-аниона прямо пропорционально числу молей химотрипсина, присутствующего в смеси.
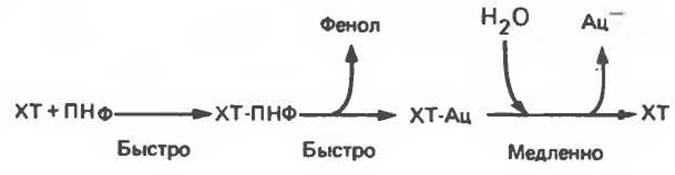
Рис. 9.3. Промежуточные стадии катализируемого химотрипсином гидролиза n-нитрофенилацетата. XT - химотрипсин; ПНФ — n-нитрофенилацетат; ХТ- ПНФ - комплекс химотрипсина с n-нитрофенилацетатом; ХТ-Ац — ацегилхимотрипсин; фенол - n-нитрофенолят-анион; Ац ацетат-анион. Образование комплекса ХТ-ПНФ и ацетилфермента ХТ-Ац идет намного быстрее гидролиза ХТ-Ац.

Рис. 9.4. Реакция гидроксила Ser 195 в составе химоnрипсина с диизопропилфторфосфатом (ДИФФ).
Роль Ser 195 в катализе
Ацильная группа, входящая в состав интермедиата ацил-XT, связана с высокореакционноспособным остатком серина — Ser 195. Особая роль и высокая реакционная способность Ser 195 проявляется в способности этого остатка (отсутствующей у остальных 27 сериновых остатков химотрипсина) вступать в реакцию с диизопропилфторфосфатом (ДИФФ) (рис. 9.4). Аналогичные реакции характерны и для других сериновых протеаз.
При модификациии Ser 195 химотрипсин инактивируется. По аналогичному механизму в присутствии ДИФФ происходит инактивация и ряда других протеаз. Все они называются сериновыми протеазами.
Система переноса заряда
В ходе катализа в молекуле химотрипсина функционирует система переноса заряда, которая служит каналом переноса протона. Эта система включает три аминокислотных остатка, далеко отстоящих друг от друга в первичной структуре, но сближенных в рамках третичной структуры до расстояний, допускающих возможность взаимодействия. Этими остатками являются Asp 102, His 57 и Ser 195. Хотя в химотрипсине большинство заряженных остатков находится на поверхности молекулы, остатки, из которых формируется система переноса заряда, укрыты во внутренней неполярной части молекулы. Три упомянутых остатка образуют цепочку Asp 102 ... His 57 .... Ser 195.
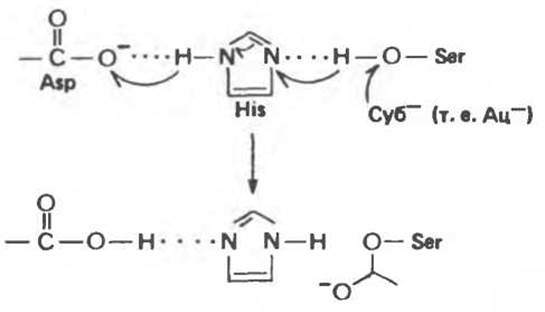
Рис. 9.5. Функционирование системы переноса протонов в химотрипсинс при ацилировании остатка Ser 195 субстратом (Суб-).
Напомним, что Ser 195 — это тот самый остаток, который в ходе катализа подвергается ацилированию. Сближение ацетат-аниона (образующегося из μ-нитрофенилацетата) с атомом кислорода R-группы Ser 195 приводит к последовательному переносу протона от Ser 195 к His 57 и далее к Asp 102 (рис. 9.5).
В ходе деацилирования комплекса ацил-Ser 195 протон перемещается в обратном направлении. Аналогичный перенос протона, как полагают, происходит и при гидролизе физиологических субстратов химотрипсина — пептидов.