Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: регуляция активности
Регуляция количества фермента путем регуляции скорости его синтеза распада
Общие принципы
Абсолютное количество фермента в клетке определяется скоростями его синтеза (kсинт) и распада (kpacn) (рис. 10.2). Соответственно количество фермента увеличивается либо в результате повышения скорости его синтеза (увеличением kсинт), либо снижения скорости распада (уменьшением kрасп), либо обоими способами сразу. Подобным же образом количество фермента уменьшается в результате либо уменьшения kсинт, либо увеличения kрасп, либо и тем и другим путем. В клетках человека может происходить изменение и kсинт, и kрасп. У всех живых организмов синтез ферментов (и всех других белков) из аминокислот и распад фермента (белка) на аминокислоты представляют собой разные процессы, которые катализируются совершенно разными наборами ферментов. В этих условиях легко осуществляется независимая регуляция скорости синтеза фермента и скорости его распада.
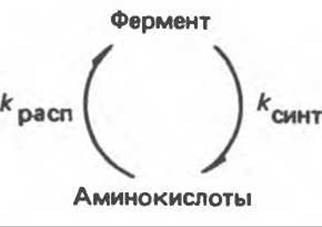
Рис. 10.2. Количество фермента определяется балансом процессов его синтеза и распада.
Синтез ферментов детерминируется информацией, содержащейся в ДНК
Первичная структура фермента, как и любого другого белка, определяется той информацией, которая записана в информационной (матричной) РНК (мРНК) и считывается с помощью трехбуквенного (триплетного) кода. Нуклеотидная последовательность мРНК в свою очередь определяется комплементарной последовательностью оснований ДНК- матрицы, т.е. соответствующего гена (см. гл. 38 и 40).
В результате мутаций нуклеотидная последовательность ДНК может измениться, и будут синтезироваться белки с измененной первичной структурой. Если новая аминокислота сильно отличается по своим свойствам от исходной, изменения могут охватить высокие уровни структурной организации и может произойти частичная или полная утрата каталитической активности (впрочем, в редких случаях наблюдается, напротив, ее повышение). Мутации в различных генетических локусах могут приводить к нарушению синтеза самых разных ферментов и тем самым к развитию многих генетических заболеваний.
Индукция ферментов
Клетки могут синтезировать специфические ферменты в ответ на присутствие специфических низкомолекулярных индукторов. Индукцию ферментов можно проиллюстрировать на следующем примере. Клетки Escherichia coli, выращенные на глюкозе, не способны сбраживать лактозу из-за отсутствия фермента ß-галактозидазы, гидролизующей лактозу, которая распадается на глюкозу и галактозу. Если в питательную среду добавить лактозу или некоторые другие ß-галактозиды, то индуцируется синтез ß-галактозидазы, и культура клеток обретает способность сбраживать лактозу.
Индуктор (лактоза) является субстратом индуцируемого белка (ß-галактозидазы). Многие индукторы одновременно служат субстратами ферментов, которые они индуцируют, однако в роли индукторов могут выступать и соединения, структурно сходные с субстратом, но сами не являющиеся субстратами. И наоборот, соединение может быть субстратом, но не являться индуктором. Нередко какое-либо соединение индуцирует сразу несколько ферментов данного катаболического пути. В этих случаях говорят, что структурные гены, кодирующие группу катаболических ферментов, составляют оперон, и все ферменты, кодируемые генами оперона, индуцируются единственным индуктором (координированная индукция). Способность регулировать синтез ферментов с помощью того или иного питательного вещества позволяет бактерии использовать это питательное вещество с максимальным для себя преимуществом; в то же время «ненужные» ферменты бактерия не синтезирует.
Ферменты, концентрация которых в клетке не зависит от добавления индукторов, называются конститутивными. Данный фермент может быть конститутивным для одного штамма, индуцируемым для другого и вообще отсутствовать в третьем. Обычно клетки содержат небольшое, но измеримое количество соответствующего фермента даже в отсутствие индуктора. Это — базовый уровень. Величина отклика данного организма на введение индуктора определяется генетически (см. гл. 41). При индукции различных штаммов может наблюдаться повышение содержания фермента, варьирующее от двукратного до тысячекратного. Таким образом, содержащаяся в клетке наследственная генетическая информация определяет и характер, и величину реакции на введение индуктора. Следовательно, понятия «конститутивный» и «индуцируемый» относительны: они характеризуют лишь крайние точки всего спектра возможных реакций.
Индукция ферментов наблюдается и у эукариот. Примерами индуцируемых ферментов у млекопитающих являются триптофанпирролаза, треониндегидраза, тирозин-а-оксоглутарат — трансаминаза, инвертаза, ферменты цикла мочевины, HMG-СоА-редуктаза и цитохром Р-450.
Репрессия и дерепрессия ферментов
Бактерии, способные синтезировать определенный метаболит, при наличии этого метаболита в среде могут приостановить его синтез в результате репрессии. В этом случае небольшая молекула, например пурин или аминокислота, действуя как корепрессор, блокирует синтез ферментов, участвующих в биосинтезе самого корепрессора. Например, добавление гистидина в среду, на которой растет бактерия Salmonella typhimurium, подавляет (репрессирует) синтез всех ферментов биосинтеза гистидина; добавление в среду лейцина репрессирует синтез первых трех ферментов, которые участвуют исключительно в биосинтезе лейцина. В обоих случаях гены ферментов, ответственных за биосинтез данного метаболита, образуют оперон. добавление в среду конечного продукта биосинтеза, гистидина или лейцина, вызывает координированную репрессию. Координированная репрессия наблюдается не для всех путей биосинтеза. После удаления из среды корепрессора или же при истощении его запасов биосинтез соответствующих ферментов возобновляется. Это явление называют дерепрессиен. Дерепрессия может быть координированной и некоординированной.
Приведенные выше примеры иллюстрируют репрессию конечным продуктом по принципу обратной связи, характерную для процессов биосинтеза в бактериях. Сходное явление — катаболитная репрессия — состоит в том, что одно из промежуточных соединений в цепочке катаболических ферментативных реакций репрессирует синтез катаболических ферментов. Оно было впервые обнаружено при изучении культуры Е. coli, растущей на среде, которая содержит в качестве источника углерода не глюкозу, а другое соединение (X). Добавление глюкозы репрессировало синтез ферментов, участвующих в катаболизме X. Это явление вначале называли «эффект глюкозы», но потом обнаружилось, что сходные эффекты могут вызывать и другие окисляемые питательные вещества; поэтому был предложен термин «катаболитная репрессия». Катаболитная репрессия осуществляется при участии сАМР. Молекулярные механизмы индукции, репрессии и дерепрессии осуждаются в гл. 41.
В разветвленных процессах биосинтеза, например при биосинтезе аминокислот с разветвленными боковыми цепями или аминокислот семейства аспартата, ферменты начальных стадий участвуют в биосинтезе нескольких аминокислот (рис. 10.3). Если в среду, на которой растут бактерии, добавить лизин, репрессируется синтез ферментов, участвующих исключительно в биосинтезе лизина (EnzL). Добавление в среду треонина вызывает репрессию ферментов, участвующих только в биосинтезе треонина (EnZТ). Это — примеры простой репрессии конечным продуктом. В то же время ферменты Enz1 и Enz2 (рис. 10.3) участвуют одновременно в биосинтезе и лизина, и треонина. Если бы репрессию их синтеза вызывал каждый из конечных продуктов по отдельности, то наблюдался бы недостаток другой аминокислоты. Если же в среду добавить одновременно и лизин, и треонин, то ферменты Enz1 и Enz2 окажутся излишними; их репрессия была бы выгодна бактерии, поскольку позволила бы более эффективно использовать имеющиеся питательные вещества.
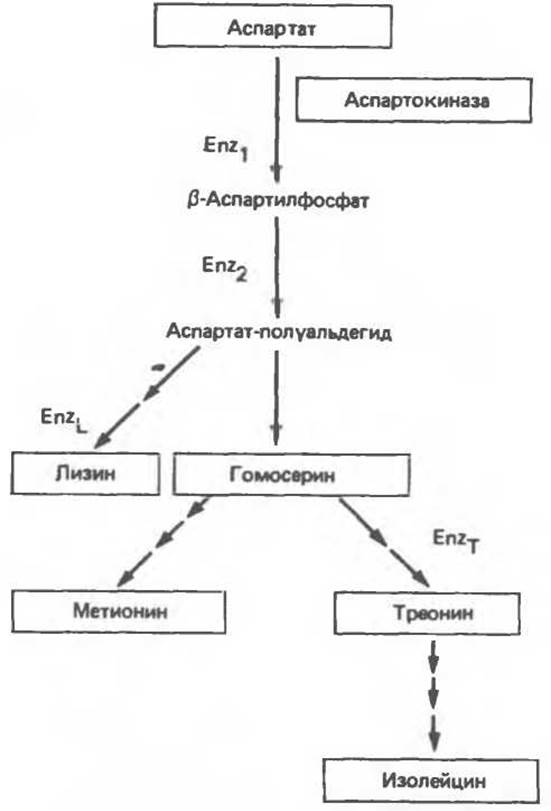
Рис. 10.3. Синтез аминокислот семейства аспартата. Под EnzL и EnzТ подразумеваются группы ферментов, участвующих в биосинтезе лизина и треонина соответственно.
Число стрелок соответствует числу стадий.
В присутствии всех конечных продуктов, образующихся на различных ответвлениях пути биосинтеза, может наблюдаться мультивалентная репрессия. Это происходит только тогда, когда все конечные продукты, синтезируемые данным набором ферментов, присутствуют в избытке. Следовательно, для полной репрессии аспартокиназы (Enz1) необходимо присутствие не только лизина и треонина, но также еще и метионина, и изолейцина.
Обновление ферментов
В быстро растущих бактериях общая скорость распада белков составляет около 2% в час. Иное положение складывается, когда бактерии находятся в условиях голодания или их переносят на свежую среду, бедную углеродом. В этих условиях распад бактериальных белков идет со скоростью 7—10% в час.
Сочетание процессов синтеза и распада ферментов называют обновлением ферментов. Обновление происходит и у бактерий, и у млекопитающих, однако значение распада ферментов как средства регуляции их количества у бактерий недооценивалось. В клетках млекопитающих обновление белков было обнаружено гораздо раньше, чем у бактерий. Указания на этот процесс у человека были получены более ста лет назад на основании наблюдений за людьми, получавшими специальную диету. Однако лишь после классических работ Шёнхеймера, начатых незадолго до второй мировой войны, было твердо установлено, что обновление клеточных белков происходит на протяжении всей жизни. Измеряя скорость включения в данный белок 15N-меченных аминокислот и скорость утраты метки белком, Шёнхеймер пришел к выводу, что белки в организме человека находятся в состоянии «динамического равновесия»; это представление позднее было распространено на другие компоненты организма, включая липиды и нуклеиновые кислоты.
Регуляция синтеза и распада ферментов
Основные этапы синтеза белков достаточно хорошо изучены, чего нельзя сказать о процессах распада ферментов. Распад ферментов происходит в результате их гидролиза протеолитическими ферментами, но о механизме регуляции этой протеолитической активности мало что известно. Установлено только, что процессы регуляции могут быть сопряжены с расходованием АТР. Чувствительность фермента к протеолизу зависит от его конформации. Присутствие или отсутствие субстратов, коферментов, ионов металлов — все это способно влиять на конформацию белка и его чувствительность к протеолизу. Поэтому скорость распада специфических ферментов может зависеть от концентрации в клетке субстратов, коферментов и, возможно, ионов. Эти представления можно хорошо проиллюстрировать на примере аргиназы и триптофаноксигеназы (триптофанпирролазы). Регуляция содержания аргиназы в печени может осуществляться путем изменения либо kсинт либо kрасп. Переход на обогащенную белковую диету приводит к возрастанию содержания аргиназы из-за повышения скорости ее синтеза. Содержание фермента в печени возрастает также у голодающих животных. Но это обусловлено снижением скорости распада аргиназы, поскольку значение kсинт остается постоянным. Теперь о ситуации, которая наблюдается со вторым ферментом: инъекция млекопитающим глюкокортикоидов, как и инъекция триптофана, повышает содержание триптофаноксигеназы. Гормон вызывает повышение скорости синтеза фермента kсинт, тогда как Тrр не оказывает влияния на kсинт, а понижает kрасп, повышая устойчивость оксигеназы к протеолизу. Сравним оба этих примера с индукцией ферментов у бактерий. В случае аргиназы повышенное потребление азота при нахождении на обогащенной белковой диете может увеличить содержание аргиназы (см. гл. 30). Повышение скорости синтеза аргиназы внешне напоминает индукцию субстратом, наблюдающуюся у бактерий. Для триптофанпирролазы ситуация иная: в бактериальных клетках Тrр может действовать как индуктор (увеличивая kсинт), но в тканях млекопитающих он действует только на процесс распада фермента (уменьшает kрасп).
Содержание ферментов в тканях млекопитающих может изменяться в результате действия различных физиологических и гормональных факторов, а также под влиянием диеты. Известно много примеров такого рода для разных тканей и различных метаболических путей (табл. 10.1), однако наши знания о молекулярном механизме процессов носят фрагментарный характер.
Глюкокортикоиды повышают концентрацию тирозин-трансаминазы, увеличивая kсинт. На этом примере была впервые четко показана гормональная регуляция синтеза фермента в тканях млекопитающих. Инсулин и глюкагон, несмотря на взаимный антагонизм их физиологического действия, оба независимо повышают kсинт в 4—5 раз. Действие глюкагона, вероятно, опосредуется сАМР, который оказывает аналогичное гормону действие в органной культуре печени крысы.
Превращение проферментов в активные ферменты
Ферментативная активность может регулироваться путем превращения неактивного профермента в каталитически активную форму. Чтобы перейти в такую форму, профермент должен подвергнуться ограниченному протеолизу, сопровождающемуся конформационными изменениями; при этом происходит либо демаскирование каталитического центра, либо его формирование (см. гл. 8). Синтез в форме каталитически неактивных проферментов является характерным свойством пищеварительных ферментов, а также ферментов системы свертывания крови и системы фибринолиза (см. гл. 55).