Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Гормоны коры надпочечников
Классификация и механизм действия стероидных гормонов
Глюкокортикоидные гормоны
А. Классы глюкокортикоидных гормонов. Начальный этап действия глюкокортикоидных гормонов — взаимодействие со специфическим рецептором. В результате этого взаимодействия рецептор «активируется», что, как предполагается, необходимо для связывания с ДНК. В целом существует высокая степень корреляции между связыванием стероида с рецептором и выраженностью определенного биологического ответа. Эта корреляция сохраняется в широком диапазоне активностей; так, если один стероид обладает в 10 раз меньшим сродством к рецептору по сравнению с другим, то и его биологический эффект будет соответственно ниже (при действии в одинаковых концентрациях). В действии стероидных гормонов «резервные рецепторы» не участвуют.
Биологический эффект стероида определяется как способностью связываться с рецептором, так и концентрацией свободного гормона в крови. Возьмем, например, кортизол, кортикостерон и альдостерон; все три гормона обладают высоким сродством к глюкокортикоидному рецептору, однако в физиологических условиях доминирует действие кортизола, поскольку в плазме крови он содержится в относительно высокой концентрации. Кортикостерон может играть важную роль при некоторых патологических условиях (недостаточность 17а-гидроксилазы), но альдостерон никогда не достигает такой концентрации в плазме крови, чтобы мог проявиться его глюкокортикоидный эффект.
Если сравнить различные стероиды по их способности опосредовать хорошо известный глюкокортикоидный эффект — индукцию фермента тирозин-аминотрансферазы в печени, — то выявляется, что эти гормоны можно разделить на четыре класса: агонисты, частичные агонисты, антагонисты и неактивные стероиды (табл. 48.4).
Б. Глюкокортикоидный рецептор. Ряд биохимических, иммунологических и генетических исследований позволил сформировать представление о глюкокортикоидном рецепторе (рис. 48.7). В его N-концевой половине содержатся большая часть антигенных участков, а также область, модулирующая функцию промотора. В С-концевой области содержатся ДНК-связывающие и гормон-связывающие сайты. Домен, связывающий ДНК, расположен ближе к середине молекулы, тогда как домен, связывающий гормон, — ближе к С-концу. Некоторые области в С-концевой половине рецептора гомологичны белку онкогена v-erb-A, а также ДНК-связывающего участка в TFIIIA и соответствующей области в рецепторах эстрогенов и прогестерона. Что касается аминокислотной последовательности рецептора, то она была установлена на основе анализа молекул кДНК. При этом в ДНК-связывающем участке были выявлены две области, богатые остатками Cys-Lys-Arg. Сравнение этих областей с другими известными белками, связывающими ДНК, например TFIIIA, показало, что здесь возможно образование складки в виде пальца (с цинком в середине); предполагается, что такая «пальцевая» структура внедряется в изгиб ДНК. Глюкокортикоидный рецептор человека существует в двух формах, а и ß, состоящих соответственно из 777 и 742 аминокислотных остатков.
Таблица 48.4. Классификации стероидов по их глюкокортикоидному эффекту
|
Агонисты Дексаметазон Кортизол Кортикостерон Альдостерон Частичные агонисты 11 ß-Гидроксипрогестерон 21 -Дезоксикортизол 17а-Гидроксипрогестерон Прогестерон Антагонисты Тестостерон 17ß-Эстрадиол 19-Нортестостерон Кортизон Неактивные стероиды 11а-Гидроксипрогестерон Андростендион 11а, 17а-Метилтестостерон Тетрагидрокортизол |
В. Общая характеристика механизма действия.
Схема механизма действия глюкокортикоидных гормонов описана в гл. 44 и изображена на рис. 44.1. Многочисленные примеры подтверждают концепцию о том, что эти гормоны влияют на специфические внутриклеточные процессы путем изменения содержания в клетке критически важных белков, как правило, ферментов. Последнее определяется тем, что глюкокортикоиды способны регулировать в клетках-мишенях скорость транскрипции специфических генов. Для этого требуется, чтобы стероидрецепторный комплекс связался со специфическими областями ДНК вблизи сайта инициации транскрипции и далее чтобы эти области определили специфичность ответа. Каким именно образом это связывание стимулирует или тормозит транскрипцию, как обеспечивается тканевая специфичность, почему один и тот же ген может быть активирован в одной ткани и ингибирован в другой, — эти и многие другие принципиальные вопросы остаются открытыми.
Иллюстрацией современных представлений о механизме действия стероидных гормонов может служить краткое описание того, как глюкокортикоиды влияют на транскрипцию ДНК вируса рака молочной железы мыши. Система этого онкогенного вируса удобна тем, что эффект стероида проявляется на ней быстро и сильно, а молекулярная биология вируса подробно изучена. Комплекс глюкокортикоидный гормон-рецептор связывается с высокой избирательностью и специфичностью с областью ДНК вируса — глюкокортикоидным регуляторным элементом, расположенным на несколько сотен пар оснований выше сайта инициации транскрипции. В состав глюкокортикоидного регуляторного элемента входят последовательности, очень сходные с консенсусной последовательностью AGAАТ CAGАТ, обнаруженной в регуляторных элементах целого ряда генов, регулируемых глюкокортикоидами. Нагруженный рецептором глюкокортикоидный регуляторный элемент стимулирует инициацию транскрипции вируса рака молочной железы мыши и, кроме того, активирует гетерологичные промоторы. Этот цис-действующий элемент работает при перемещении от одной области к другой по ходу или против хода транскрипции; кроме того, он работает независимо от своей ориентации вперед или назад. Такие свойства позволяют рассматривать глюкокортикоидный регуляторный элемент как энхансер транскрипции. Было показано, что ряд регулируемых глюкокортикоидами генов обладает теми же характеристиками.
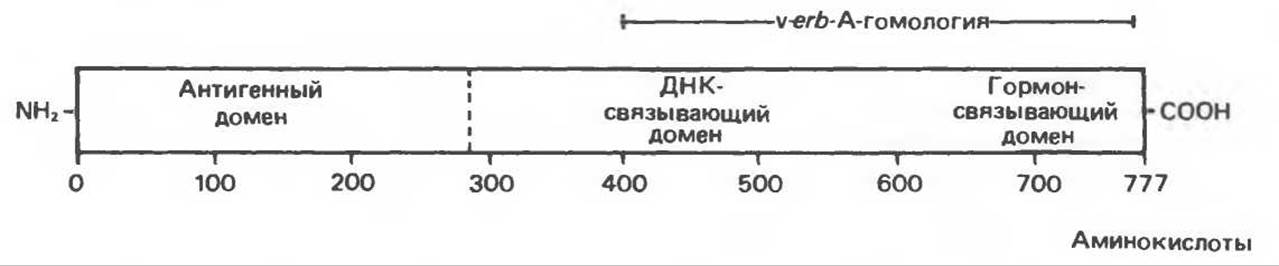
Рис. 48.7. Схематическое изображение глюкокортикоидного рецептора человека. Этот рецептор существует в двух формах, состоящих соответственно из 742 или 777 аминокислотных остатков и различающихся своими С-концами. На рисунке показана вторая форма. Рецептор можно разделить на функционально разные домены: антигенный, связывающийся с ДНК и гормон-связывающий. Показана область, обладающая высокой степенью гомологии с онкогеном V-erb-А.
Регуляция скорости транскрипции — это, по-видимому, важнейший элемент механизма действия глюкокортикоидных гормонов, но он не является единственным. Удалось выявить, что эти гормоны регулируют также процессинг и транспорт ядерных транскриптов (например, а1-кислых глюкопротеинов), скорость распада специфических мРНК (например, гормона роста и фосфоенолпируват-карбоксикиназы), наконец, посттрансляционный процессинг (различные белки вируса опухоли молочных желез). Создается впечатление, что этот и другие классы стероидных гормонов способны действовать на любом уровне переноса информации от ДНК к белку, причем относительное значение воздействия на каждом из уровней варьирует от системы к системе.
Минералокортикоидные гормоны
А. Общая характеристика механизма действия.
Механизм действия альдостерона в основных чертах сходен с механизмом действия других стероидных гормонов (рис. 48.8). Клетки-мишени содержат специфические рецепторы, связывающие альдостерон. Образовавшийся гормон-рецепторный комплекс связывается с хроматином и регулирует скорость транскрипции специфических генов. Хотя специфические генные продукты не были выделены, однако известно, что для проявления эффекта альдостерона требуется синтез РНК и белка. Предполагают, что влияние альдостерона на транспорт ионов опосредовано определенными белками.
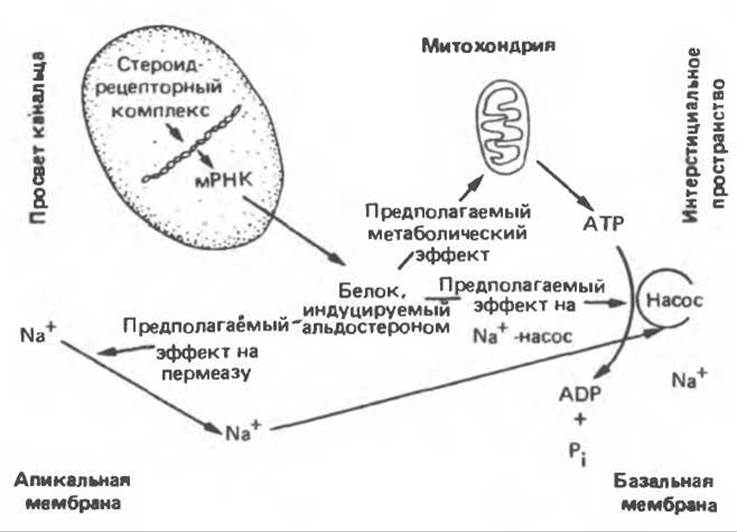
Рис. 48.8. Механизм действия альдостерона. Гормон индуцирует образование одного или более белков, которые в свою очередь увеличивают проницаемость апикальной (люминальной) мембраны по отношению к Na+, усиливают активный транспорт Na+ из клетки через базальную и латеральные мембраны в интерстициальное пространство либо улучшают энергетическое обеспечение работы Na+-насоса. (Modified from Edelman S. Candidate mediators in the action of aldosterone on Na+-transport. In: Membrane Transport Processes, vol. 1. Hoffman J.F. [editior]. Raven Press, 1978.)
Б. Связывание альдостерона с рецепторами. В цитоплазме и ядре клеток-мишеней выявлены рецепторы, связывающие альдостерон с высоким сродством (Kd~1 нмоль/л). Общее связывание (емкость рецепторов) в цитоплазме в 80—100 раз выше, чем в ядре; однако по специфичности и аффинности связывание в ядре намного превосходит общую связывающую активность цитозоля. Как обнаружилось в опытах in vitro, в цитозоле присутствуют три типа связывающих белков. Белки I и II типа связывают альдостерон с высоким сродством, белки типа III — с низким. Тип I — это минералокортикоидный рецептор, а тип II — видимо, глюкокортикоидный рецептор, одновременно связывающий альдостерон. Рецептор типа I жадно связывает альдостерон, но очень хорошо связывает также ДОК и кортикостерон. Исходя из того, что уровень каждого из этих двух стероидов в плазме намного выше, чем альдостерона. можно, казалось бы, предположить, что именно они будут предпочтительно связываться с рецептором типа I и, следовательно, эффект альдостерона будет слабым. Однако вспомним, что в плазме крови ДОК и кортикостерон связаны со стероид-транспортирующим белком транскортином, тогда как альдостерон не имеет специфического транспортної о белка. Отсюда следует, что в плазме эффективная «свободная» концентрация альдостерона выше, чем кортикостерона или ДОК. Благодаря этому альдостерон беспрепятственно проникает в клетки, и in vivo это обеспечивает ему преимущество в конкурентном связывании с рецептором типа I.
В. Действие альдостерона на транспорт ионов. Молекулярный механизм действия альдостерона на транспорт Na+ не выяснен, но целый ряд данных подтверждает модель, приведенную на рис. 48.8. Согласно этой схеме, Na+ из жидкости, содержащейся в канальцах и омывающей апикальную поверхность почечных клеток, пассивно входит в клетки по Na+-каналам. Далее происходит перенос этого иона в интерстициальную жидкость, причем транспорт через мембрану на серозной стороне клетки осуществляется Na+/К+-зависимой АТРазой. Таким образом, на этот активный процесс расходуется энергия АТР.
Альдостерон увеличивает число Na+-каналов на мембране на апикальной стороне клеток, что, очевидно, ведет к повышению уровня внутриклеточного Na+. Кроме того, альдостерон увеличивает активность ряда митохондриальных ферментов, что должно способствовать выработке АТР, необходимого для работы Na+/K+-Hacoca мембраны на серозной стороне клетки. В результате действия альдостерона возрастают как соотношение NADH:NAD, так и активность некоторых митохондриальных ферментов, в том числе цитратсинтазы. Повышение цитратсинтазной активности обусловлено истинной индукцией фермента (вероятно, опосредованной влиянием на транскрипцию генов), причем транзиторное возрастание количества этого белка тесно коррелирует с эффектом гормона на транспорт Na+. Исходя из того, что прямого эффекта альдостерона на Na+-насос не было выявлено, представляется вероятным, что гормон действует через увеличение внутриклеточной концентрации Na+ и создание источника энергии, необходимой для удаления этого иона. Воздействие альдостерона на транспорт К+ и Н+ может осуществляться с помощью иных механизмов, в которых участвуют различные, регулируемые этим гормоном белки.