Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Гликопротеины и протеогликаны
Гликопротеины - Классификация гликопротеинов
Основываясь на природе связей между полипептидными и олигосахаридными цепями, гликопротеины можно разделить на 4 класса: 1) содержащие связь Ser (или Thr)—GalNAc (рис. 54.1); 2) гликопротеины, содержащие связь Ser-Xyl; 3) коллагены, содержащие связь гидроксилизин (Нуl)—Gal; 4) гликопротеины, содержащие связь Asn—GlcNAc (рис. 54.1).
Гликопротеины классов 1,2 и 3 соединяются с соответствующими аминокислотами О-гликозидной связью (т. е. связью, образуемой ОН боковой цепи аминокислоты и остатком сахара). Класс 4 характеризуется N-гликозидной связью (т.е. связью, образуемой N-амидной группой аспарагина и остатком сахара). Поскольку гликопротеины классов 2 и 3 встречаются относительно редко, термин О-связанные гликопротеины часто используют (как это имеет место и здесь) только в отношении представителей класса 1. Гликопротеины класса 4 получили название «N-связанные гликопротеины». Имеются и другие классы гликопротеинов, присутствующие в малых количествах. Число олигосахаридных цепей, присоединенных к одному белку, может колебаться от 1 до 30 и более, а длина сахарных цепей варьирует от 2 или 3 остатков до значительно больших структур.
Некоторые гликопротеины содержат как N-, так и О-гликозидные связи.
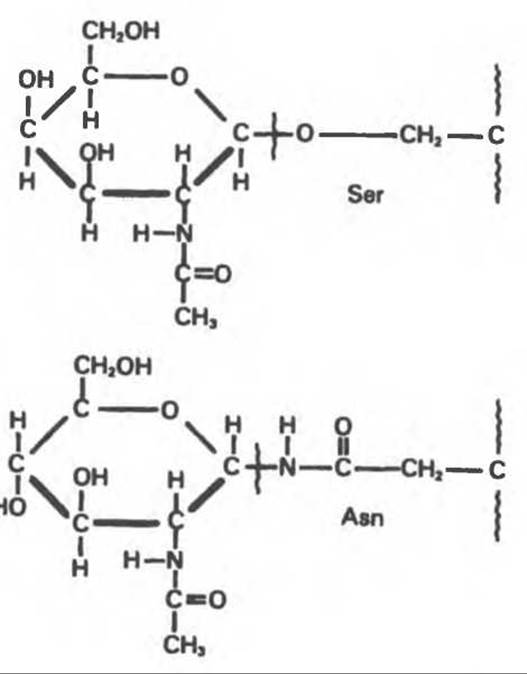
Рис. 54.1. Связь N-ацетилгалактозамина с серином и N-ацетилглюкозамина с аспарагином.
О-связанные гликопротеины
Большинство О-гликозидных связей образуется за счет свободных ОН-групп остатков Ser и Thr полипептида в трипептидной последовательности Asn—Y—Ser(Thr), где Y—любая аминокислота, кроме аспартата. Эта специфическая трипептидная последовательность широко распространена в белках, но не каждая такая последовательность находится в гликозилированном состоянии. Гликозилирование остатков Ser или Thr зависит от конформации белка, окружающего трипептид при его проникновении через эндоплазматический ретикулум.
А. Распространение и структура олигосахаридных цепей О-связанных гликопротеинов. Многие гликопротеины этого класса присутствуют в муцинах. Однако О-гликозидные связи обнаруживаются также в некоторых мембранных и циркулирующих в крови гликопротеинах. Как отмечалось выше, сахаром, прямо присоединяющимся к остатку Ser или Thr, является GalNac (рис. 54.1). Остаток Gal или NeuAc обычно присоединяется к GalNAc. Структура двух типичных олигосахаридных цепей гликопротеинов этого класса представлена на рис. 54.2. Встречаются также многие варианты таких структур.
Б. Биосинтез О-связанных гликопротеинов. Полипептидные цепи этих и других гликопротеинов кодируются соответствующими мРНК; поскольку большинство гликопротеинов связано с мембранами или секретируются, они обычно транслируются на мембраносвязанных полирибосомах (см. гл. 40). Олигосахаридные цепи гликопротеинов О-гликозидного типа конструируются путем ступенчатого добавления сахаров из нуклеотидсахаров, таких, как UDPGal-NAc, UDPGal и CMP-NeuAc. Ферменты, катализирующие эту реакцию, представляют собой мембраносвязанные гликопротеин-гликозилтрансферазы. Синтез каждого такого фермента контролируется одним специфическим геном. В общем плане образование одного типа связей требует активности соответствующей трансферази (гипотеза «одна связь — одна гликозилтрансфераза»). Ферменты, катализирующие присоединение внутренних сахарных остатков, локализованы в эндоплазматическом ретикулуме, и присоединение первых сахаров происходит во время трансляции (т. е. имеет место котрансляционная модификация белка). Ферменты, осуществляющие присоединение терминальных сахаров (таких, как NeuAc), локализованы в комплексе Гольджи.
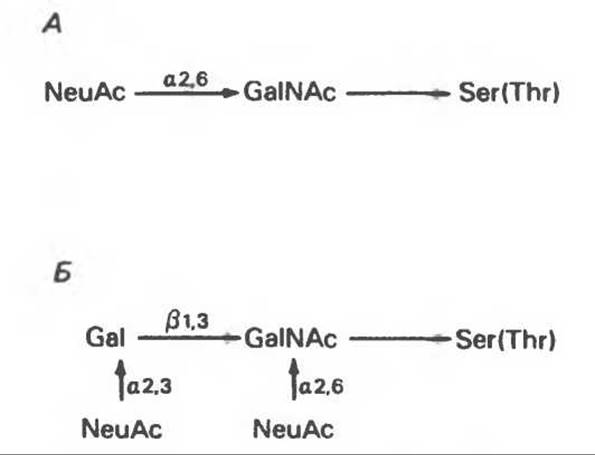
Рис. 54.2. Структура двух О-связанных олигосахаридов, обнаруживаемых в составе (А) муцинов слюны подчелюстной железы и (Б) фетуина, а также сиалогликопротеина эритроцитарных мембран человека. (Modified and reproduced, with permission, from Lennarz W. J. The Biochemistry of Glycoproteins and Proteoglycans. Plenum Press, 1980.)
N-связанные гликопротеины
Отличительной особенностью этих соединений, составляющих основной класс гликопротеинов, служит наличие связи Asn—GlcNAc (рис. 54.1). Представители этого класса в связи с легкостью их получения изучены довольно тщательно (например, белки крови). Данный класс включает как мембраносвязанные, так и циркулирующие в крови гликопротеины. Основное отличие между ними и ранее описанным классом помимо природы аминокислоты, к которой присоединена олигосахаридная цепь (в основном Asn вместо Ser), заключается в особенностях их биосинтеза.
А. Группы N-связанных гликопротеинов и их структура. Существуют три главные группы N-связанных гликопротеинов: сложные, гибридные и богатые маннозой (рис. 54.3). Они содержат общий пентасахарид ([Man]3 [GlcNAc])2, показанный внутри очерченной области на рис. 54.3 и на рис. 54.4, но различаются по структуре наружных цепей. Присутствие общего пентасахарида объясняется тем, что начальный биосинтез всех трех групп протекает одинаково. Гликопротеины сложного типа обычно содержат концевые остатки NeuAc и предшествующие им остатки Gal и GlcNAc; последние часто составляют дисахарид лактозамин. (Присутствие повторяющихся лактозаминовых компонентов [Galß1-4GlcNAc ß1—3]n характеризует четвертый класс гликопротеинов — нолилактозаминов, которые играют важную роль, поскольку определяют группы крови I/i.) Большинство олигосахаридов сложного типа содержит 2 (рис. 54.2), 3 или 4 внешние ветви, но описаны и структуры, содержащие 5 ветвей. Эти ветви часто называют антеннами, так что можно говорить о наличии ди-, три-, тетра- и пентаантенных структур. Количество цепей комплексного типа удивительно велико, и вариант, представленный на рис. 54.3, только один из многих. Другие сложные цепи могут оканчиваться Gal или Fuc. Богатые маннозой олигосахариды обычно содержат 2—6 дополнительных маннозных остатков, присоединенных к пентасахаридному ядру.
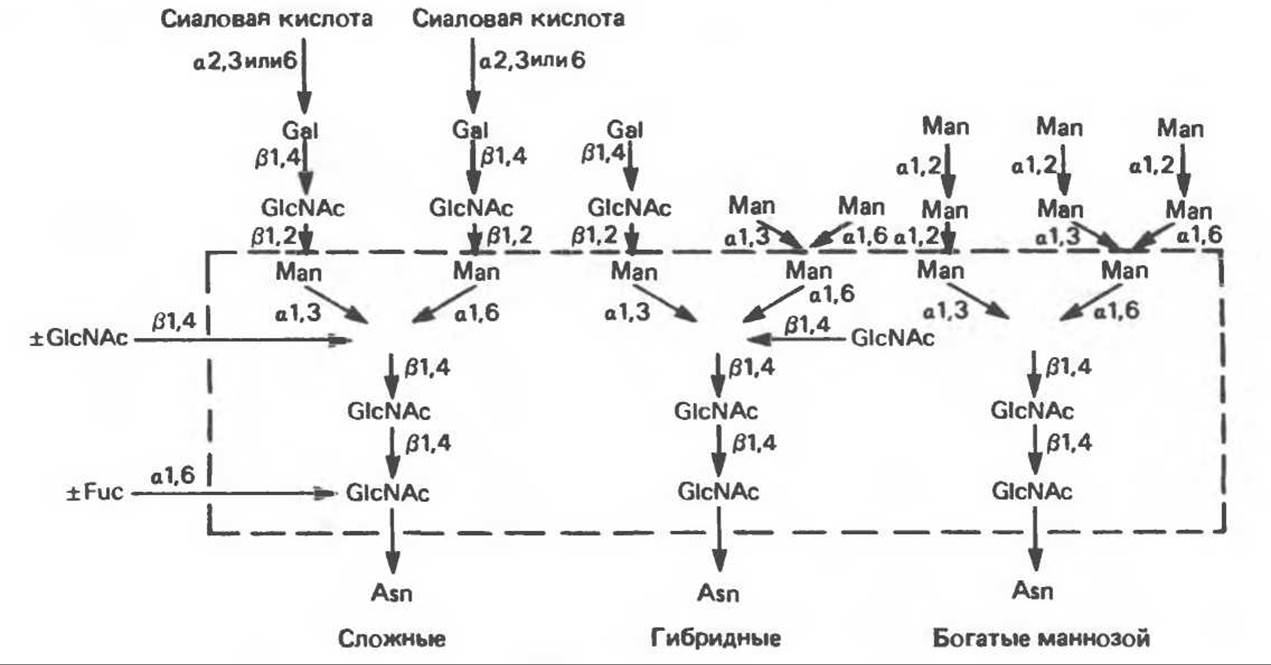
Рис. 54.3. Структура основных видов аспарагин-связанных олигосахаридов. Область, заключенная в рамку, включает олигосахаридное ядро, общее для всех N-связанных гликопротеинов. (Reproduced, with permission, from Kornfeld R., Kornfeld S. Assembly of asparagine-linked oligosaccharides. Annu. Rev. Biochem., 1985, 54, 631.)
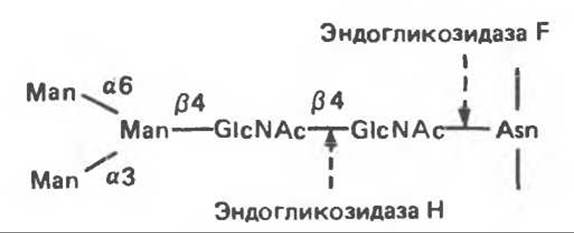
Рис. 54.4. Схематическое изображение пентасахаридного ядра, общего для всех N-связанных гликопротеинов, к которому могут присоединяться различные наружные олигосахаридные цепи. Указаны также места действия эндогликозидаз F и Н.
Б. Обзор данных о биосинтезе N-связанных гликопротеинов. Группой исследователей под руководством Лелуа описано соединение, представляющее собой олигосахарид-пирофосфорил-долихол(олигосахарид-Р—P-Dol), которое, как показали дальнейшие исследования, играет ключевую роль в биосинтезе N-связанных гликопротеинов. Олигосахаридная цепь этого соединения имеет общую структуру (Glc)3 (Man)9 (GlcNAc)2 — R, где R = P—P-Dol. Сахара сначала собираются на пирофосфорил-долихоловом остове, а затем олигосахаридная цепь переносится целиком к соответствующим Asn-остаткам акцепторных апогликопротеинов в ходе их синтеза на мембраносвязанных полирибосомах. При образовании олигосахаридной цепи сложного типа удаляются остатки Glc и 6 остатков Man и возникает пентасахаридное ядро (Man), (GlcNAc)2(рис. 54.4.). Далее под действием индивидуальных гликозилтрансфераз, локализованных главным образом в комплексе Гольджи, происходит присоединение сахаров, характерных для сложных цепей (GlcNAc, Gal, NeuAc). При образовании высокоманнозных цепей удаляются только остатки Glc с некоторыми периферическими остатками Man или без них. Феномен, при котором гликановые цепи N-связанных гликопротеинов сначала подвергаются частичной деградации, а затем строятся заново, носит название «процессинг олигосахаридов». Неожиданно оказалось, что начальные этапы биосинтеза N-связанных и О-связанных гликопротеинов существенно различаются между собой. В первом случае в процессе участвует олигосахарид-пирофосфорил-долихол, а во втором это соединение роли не играет.
Процесс может быть разделен на 2 этапа: 1) сборка и перенос олигосахарид-пирофосфорил-долихола и 2) процессинг олигосахаридной цепи.
1. Сборка и перенос олигосахарид- пирофосфорил-долихола. Полиизопреноловые соединения присутствуют и у бактерий, и в тканях эукариот. Они участвуют в биосинтезе стенок бактериальных клеток и в биосинтезе N-связанных гликопротеинов. Полиизопренолы эукариотических тканей представлены долихолом, который, подобно каучуку, является самым длинным из природных углеводородов, построенных из одинаковых повторяющихся компонентов. Долихол состоит из 17—20 повторяющихся изопреноидных компонентов (рис. 54.5).
До включения в процесс биосинтеза олигосахарид-пирофосфорил-долихола долихол должен сначала подвергнуться фосфорилированию с образованием долихолфосфата (Dol-P) в реакции, катализируемой долихолкиназой при использовании АТР в качестве донора фосфата.
GlcNAc-пирофосфорил-долихол (GIcNAc-P— Р- Dol) является ключевым липидом, действующим в качестве акцептора других сахаров при сборке олигосахарид-пирофосфорил-долихола. Он синтезируется в мембранах эндоплазматического ретикулума из Dol-P и UDPGlcAc в следующей реакции:
Dol-P + UDPGlcNAc → GlcNAc-P — P-Dol + UMP.
Эта реакция, представляющая собой первый этап сборки олигосахарид-пирофосфорил-долихола, а также другие реакции, протекающие позднее, суммированы на рис. 54.6.

Рис. 54.5. Структура долихола. Фосфат в долихолфосфате присоединяется к первичной спиртовой группе в левом конце молекулы. Группа в скобках — изопреновый компонент (n-17—20 изопреноидных единиц).

Рис. 54.6. Путь биосинтеза долихол-Р—Р-олигосахарида. Образующиеся специфические связи показаны на рис 54.7. Отметим, что внутренние маннозные остатки происходят из GDP-маннозы, тогда как донорами маннозных остатков, занимающих более наружное положение, и глюкозных остатков являются долихол-Р-манноза и долихол-Р-глюкоза. UDP — уридиндифосфат; Dol — долихол; Р — фосфат; UMP — уридинмонофосфат; GDP — гуанозиндифосфат; М — манноза; G — глюкоза.
Суть последующих этапов сборки олигосахарид- пирофосфорил-долихола можно свести к следующему:
а) второй остаток GIcNAc присоединяется к первому; донором и в этом случае служит UDPGlcNAc;
б) происходит присоединение пяти остатков Man с использованием в качестве донора GDP-маннозы;
в) присоединяются еще четыре дополнительных остатка Man, при этом донором служит Dol-Р-Маn, который образуется в ходе реакции
![]()
г) наконец, образуются три периферических остатка глюкозы, их донором является Dol-P-Glc, образующийся в реакции, аналогичной представленной выше, за тем исключением, что в качестве субстратов здесь выступают Dol-P и UDPGlc.
Следует отметить, что роль доноров первых 7 сахаров (2 остатка GIcNAc и 5 остатков Man) выполняют нуклеотидсахара, а последних 7 сахаров (4 остатка Man и 3 остатка Glc) — долихолсахара. Итогом всех описанных реакций является сборка соединения, представленного на рис. 54.7 и кратко обозначенного как (Glc)3 (Man)g (GlcNAc)2-P—P-Dol.
Олигосахарид, присоединенный к долихолу-Р—Р, переносится целиком с образованием N-гликозидной связи с одним или несколькими специфическими остатками Asn акцепторного белка. Реакция катализируется мембраносвязанным ферментом олигосахарид-трансферазой. Трансфераза узнает и переносит любой гликолипид с общей структурой R—(GlcNAc)2-P—P-Dol. Гликозилирование происходит по остатку Asn трипептидной последовательности Asn-X-Ser/Thr, где X — любая аминокислота, за исключением, вероятно, пролина или аспартата. При этом предпочтительно используется трипептид, содержащийся в ß-спирали. Лишь треть остатков Asn, являющихся потенциальными акцепторными центрами, реально подвергаются гликозилированию. Акцепторные белки могут принадлежать и к секреторному, и к общему мембранному классу. Цитозольные белки гликозилируются редко. Реакция переноса и последующие процессы в ходе гликозилирования N-связанных гликопротеинов, а также их субклеточная локализация представлены на рис. 54.8.
Другим продуктом олигосахарид-трансферазной реакции является долихол-Р—Р, который затем превращается в долихол-Р под действием фосфатазы. Долихол-Р может вновь служить акцептором для синтеза следующей молекулы олигосахарид- Р—Р-долихола.
2. Процессинг олигосахаридной цепи
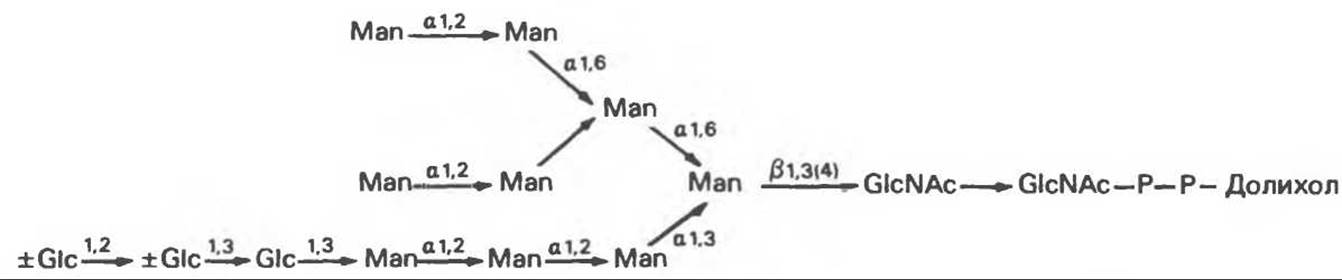
Рис. 54.7. Структура долихол-Р—Р-олигосахарида. (Reproduced, with permission, from Lennarz W. J. The Biochemistry of Glycoproteins and Proteoglycans. Plenum Press, 1980.)
а) Ранняя стадия. Различные реакции, участвующие в этом процессинге, представлены на рис. 54.8. Олигосахарид-трансфераза катализирует реакцию 1 (см. выше). Реакции 2 и 3 сводятся к удалению одного концевого и двух соседних остатков Gic под действием глюкозидазы I и глюкозидазы II соответственно. В случае богатых маннозой гликопротеинов процесс на этом может либо остановиться, либо будут отщепляться еще и остатки Man (числом до 4-х). Однако для образования сложных цепей необходимы дополнительные стадии. Четыре внешних остатка Man должны удалиться в реакциях 4 и 5 при участии двух различных маннозидаз. В реакции 6 остаток GlcNAc присоединяется к одному из остатков Man под действием GlcNAc-трансферазы I. В результате становится возможной реакция 7, которая катализируется другой маннозидазой (а-маннозидазой II Гольджи). Она приводит к уменьшению числа остатков Man до 3 (рис. 54.4).
Важный дополнительный путь представлен на рис. 54.8 (реакции I и II). Он включает ферменты, предназначенные для лизосом и направляемые в них специфическим химическим маркером. В реакции I остаток GlcNAc-І-Р присоединяется к 6-му атому углерода одного или нескольких специфических остатков Man этих ферментов. Реакция катализируется GlcNAc-фосфотрансферазой, использующей UDPGlcNAc в роли донора и генерирующей в качестве второго продукта UMP:

В реакции II GlcNAc удаляется под действием фосфодиэстеразы, а остатки Man остаются фосфо- рилированными в 6-м положении:

Рецепторы Man-6-P, локализованные в комплексе Гольджи, связывают остаток Man-6-P этих ферментов и направляют их в лизосомы. Фибробласты больных с I-клеточной болезнью (см. ниже) характеризуются резким дефицитом активности GlcNAc-фосфотрансферазы.
б) Поздняя стадия. Для сборки типичной сложной олигосахаридной цепи необходимо, чтобы к структуре, образовавшейся в реакции 7, были присоединены дополнительные сахара. Так, в реакции 8 к периферическому остатку Man второй ветви биантенной структуры, представленной на рис. 54.8, присоединяется второй остаток GlcNAc; фермент, катализирующий эту реакцию — GlcNAc-трансфераза II. Реакции 9, 10 и 11 состоят в присоединении к указанным местам остатков Fuc, Gal и NeuAc и катализируются соответственно фукозил-, галактозид- и сиалил-трансферазами.
Субклеточная локализация. Как показано на рис. 54.8, главными структурами, участвующими в процессах гликозилирования, являются эндоплазматический ретикулум и комплекс Гольджи. Присоединение олигосахарида протекает в шероховатом эндоплазматическом ретикулуме во-время или после трансляции. Удаление Glc и некоторых из периферических остатков Man также происходит в эндоплазматическом ретикулуме. Комплекс Гольджи состоит из цис-, медиальной и транс-цистерн; они могут быть разделены с помощью соответствующих методик центрифугирования. Везикулы, содержащие гликопротеины, по-видимому, формируются в эндоплазматическом ретикулуме и переносятся в цис- цистерну Гольджи. В ряде исследований показано, что ферменты, участвующие в биосинтезе гликопротеинов, обладают различной локализацией в цистернах Гольджи. Как видно из рис. 54.8, а-маннозидаза I (катализирующая реакцию 5) присутствует главным образом в цис-цистернах, а фукозил-, галактозил-и сиалил-трансферазы (катализирующие реакции 9, 10 и 11) — в транс-цистернах комплекса Гольджи.
Регуляция гликозилирования гликопротеинов
Гликозилирование гликопротеинов — это сложный процесс, в котором принимает участие большое количество ферментов. В настоящее время уже описано 7 отдельных GlcNAc-трансфераз, а теоретически их может быть еще больше. Существует также множество других видов гликозилтрансфераз (например, сиалилтрансферазы). К регуляторным факторам первой стадии (т. е. сборки и переноса олигосахаридов) биосинтеза N-связанных гликопротеинов относят 1) наличие соответствующих акцепторных центров в белках; 2) уровень Dol-P в ткани; 3) активность олигосахаридтрансферазы.
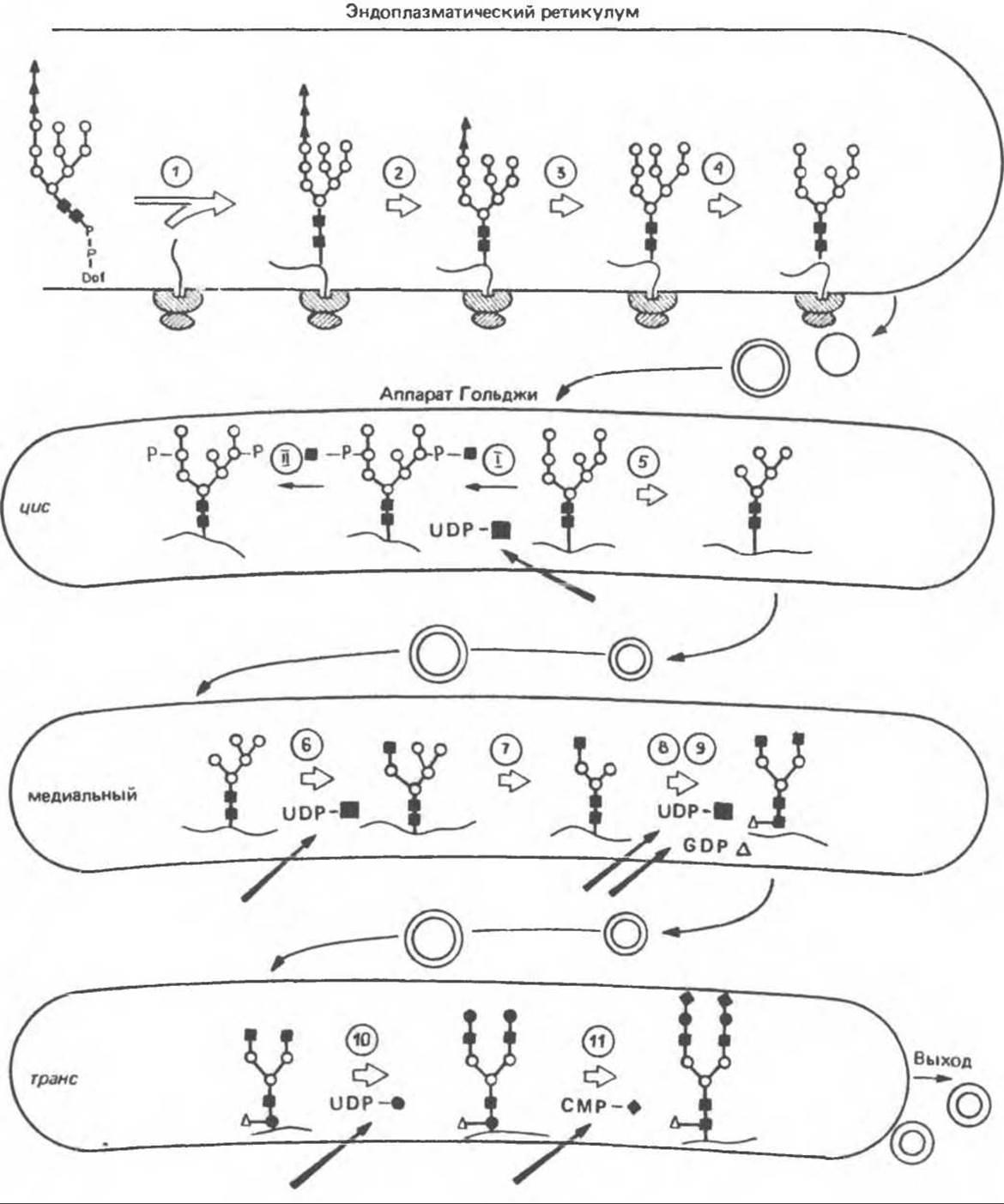
Рис. 54.8. Схема процессинга олигосахаридов. Реакция катализируется следующими ферментами: 1 — олигосахаридтрансферазой: 2 — а-глюкозидазой I; 3 — а-глюкозидазой II; 4 — ферментами эндоплазматического ретикулума — а1,2-маннозидазой, N-ацетилглюкозаминилфосфотрансферазой, N-ацетилглюкозамин-1 -фосфодиэфир-а-N-ацетилглюкозаминидазой; 5 — а-маннозидазой I комплекса Гольджи; 6 — N-ацетилглюкозаминилтранс- феразой I; 7 — а-маннозидазой II комплекса Гольджи; 8 — N-ацетилглюкозаминилтрансферазой II; 9 — фукозилтрансферазой; 10 — галактозилтрансферазой; 11 — сиалилтрансферазой. ■ — N-ацетилглюкозамин; ○ — манноза; ▲ — глюкоза; ∆ — фукоза; ● — галактоза; ◆ — сиаловая кислота. (Reproduced, with permission, from Kornfeld R., Kornfeld S. Assembly of asparagine-linked oligosaccharides. Annu. Rev. Biochcm., 1985, 54, 631.)
В регуляции процессинга участвуют многие факторы;
1) различные гидролазы и трансферазы играют важную роль в определении типа образующихся олигосахаридных цепей (например, сложных или высокоманнозных). Очевидно, что в отсутствие какой-нибудь трансферазы в ткани не может синтезироваться соответствующая сахарная связь;
2) некоторые ферменты могут проявлять свою активность только после предварительного действия другого фермента. Например, для функционирования а-маннозидазы II комплекса Гольджи необходимо предварительное действие GlcNAc-трансферазы I (рис. 54.8);
3) активность различных трансфераз может периодически увеличиваться и уменьшаться в ходе развития, что отчасти объясняет, каким образом на разных стадиях жизненного цикла организма могут образовываться различные олигосахариды;
4) определенную регуляторную роль играет разная внутриклеточная локализация отдельных гликозилтрасфераз. Например, если белок предназначен для включения в мембраны эндоплазматического ретикулума [например, гидроксиметилглутарил (ГМГ)-СоА-редуктаза] он никогда не поступит в цистерны комплекса Гольджи и не будет взаимодействовать с локализованными там ферментами процессинга. В связи с этим не удивительно, что ГМГ-СоА-редуктаза принадлежит к высокоманнозным гликопротеинам;
5) еще один важный фактор — это конформация белка. Близкородственные гликопротеины вирусов, растущих в одних и тех же клетках, обладают различными типами олигосахаридных цепей. Наилучшее объяснение этого факта состоит, по-видимому, в том, что такие белки должны иметь различную конформацию, определяющую степень процессинга;
6) существуют значительные различия в наборе ферментов процессинга в клетках разных видов. Олигосахариды вируса Sindbis варьируют (от богатых маннозой до сложных) в зависимости от типа клетки хозяина, в которой растет этот вирус;
7) в настоящее время большое внимание привлекают исследования активности ферментов процессинга гликопротеинов в различных типах раковых клеток. Показано, например, что данные клетки синтезируют олигосахаридные цепи, отличающиеся от таковых в здоровых клетках (обладающие высокой разветвленностью). Особый интерес представляет корреляция активности отдельных ферментов процессинга с метастатическими свойствами некоторых типов опухолевых клеток (см. гл 57).
Ингибиторы процессов, участвующих в гликозилировании
Известен ряд соединений, ингибирующих различные реакции процессинга гликопротеинов. Наиболее известные среди них — туникамицин, дезоксиноджиримицин и свайнсонин. Ингибируемые ими реакции указаны в табл. 54.6. Перечисленные агенты могут быть использованы в эксперименте для подавления различных стадий биосинтеза гликопротеинов и изучения влияния на него специфических сдвигов, вызываемых этими соединениями. Например, если клетки растут в присутствии туникамицина, гликозилирования их N-связанных гликопротеинов не происходит. В некоторых случаях отмечается увеличение чувствительности таких белков к протеолизу. Ингибирование гликозилирования, по-видимому, не оказывает существенного влияния на секрецию гликопротеинов, которая остается нормальной.
Таблица 54.6. Три ингибитора ферментов, участвующих в гликозилировании гликопротеинов, и место их действия
|
Ингибитор |
Место действия |
|
Туникамицин |
Ингибирует катализируемое ферментом присоединение GlcNAc к долихолу-Р, первый этап в биосинтезе олигосахарид-Р—Р-долихола |
|
Дезоксиноджиримицин |
Ингибитор глюкозидаз I и II |
|
Свайнсонин |
Ингибитор маннозидазы II |