Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Синтез белка и генетический код
Мутации
Мутации — это изменения в нуклеотидной последовательности гена. Даже если первоначально мутация произошла в некодирующей цепи гена, одна из образующихся в ходе репликации дочерних молекул будет обязательно содержать мутацию в соответствующем месте кодирующей цепи и даст начало популяции мутантных клеток.
Мутации замены оснований
Различают два типа замены оснований транзиции и трансверсии. Под транзициями понимают замену пуриновых оснований на пуриновые, а пиримидиновых — на пиримидиновые. Трансверсиями называют замены пуриновых оснований на пиримидиновые или пиримидиновых оснований на пуриновые (рис. 40.3).
Если нуклеотидная последовательность гена, содержащего замену, транскрибируется, то образовавшаяся молекула мРНК будет иметь комплементарную замену в соответствующем локусе. Точковая замена в молекуле мРНК при трансляции в аминокислотную последовательность может приводить к разным последствиям:
1) если замена приходится на третий нуклеотид кодона, то вследствие вырожденности генетического кода существует вероятность того, что аминокислотная последовательность останется неизменной и мутация никак не проявится;
2) может иметь место миссенс-эффект, когда одна аминокислота вследствие замены нуклеотида замещается другой аминокислотой. Такая замена, в зависимости от ее локализации в аминокислотной последовательности белка, может быть приемлемой, частично приемлемой или неприемлемой в отношении функции данного белка. Из анализа генетического кода можно заключить, что чаще всего точковые мутации будут приводить к заменам на аминокислоты с довольно похожими функциональными группами. Если происходит приемлемая замена, молекула белка может оказаться функционально неотличимой от нормальной. В результате частично приемлемой замены нарушается нормальное функционирование белка. И наконец, неприемлемая замена приводит к полной потере его функции;
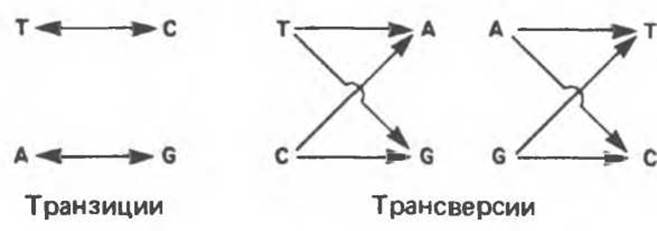
Рис. 40.3. Схема возникновения транзиций и трансверсий.
3) в результате толковой мутации может возникнуть нонсенс-кодон, присутствие которого приводит к преждевременной терминации синтеза белка. Как правило, фрагмент, образующийся в результате преждевременной терминации, не способен выполнять функцию интактной молекулы белка.
Мутации глобиновых генов
Роль мутаций удобно проанализировать на примере генов гемоглобинов. В этой области накоплен большой фактический материал, касающийся аминокислотных последовательностей нормальных и измененных гемоглобинов (см. гл. 6). На примере гемоглобиновой молекулы можно продемонстрировать влияние толковых замен аминокислот, а также проиллюстрировать некоторые из рассмотренных ранее общих особенностей генетического кода.
Некоторые мутации не проявляются в явном виде. Отсутствие влияния отдельных толковых мутаций прямо можно показать только с помощью определения нуклеотидной последовательности гена гемоглобина или соответствующих мРНК большого числа людей с нормальным гемоглобином. Однако, на основании косвенных данных можно судить о том, что в гене ß-цепи кодон 67 (кодирующий валин) не является идентичным у всех индивидов с нормальным ß-глобином. В гемоглобине типа Милуоки в 67 положении ß-цепи расположена глутаминовая кислота, а в гемоглобине Бристоль — аспарагиновая кислота. Если считать замены в положении 67 аминокислотной цепи ß-глобина следствиями однонуклеотидных замен в соответствующем кодоне мРНК, то кодону аспарагиновой кислоты GAU или GAC гемоглобина Бристоль до точковой мутации могли предшествовать валиновые кодоны GUU или GUC. В то же время кодонам глутаминовой кислоты в GAA или GAG в мРНК гемоглобина Милуоки должны были предшествовать валиновые кодоны GUA или GUG. Гемоглобин типа Сидней, имеющий в 67 положении аланин (кодоны GCU; GCC; GCA или GCG), мог произойти вследствие однонуклеотидной замены любого из четырех кодонов валина (GUU; GUC; GUA или GUG) (рис. 40.4).
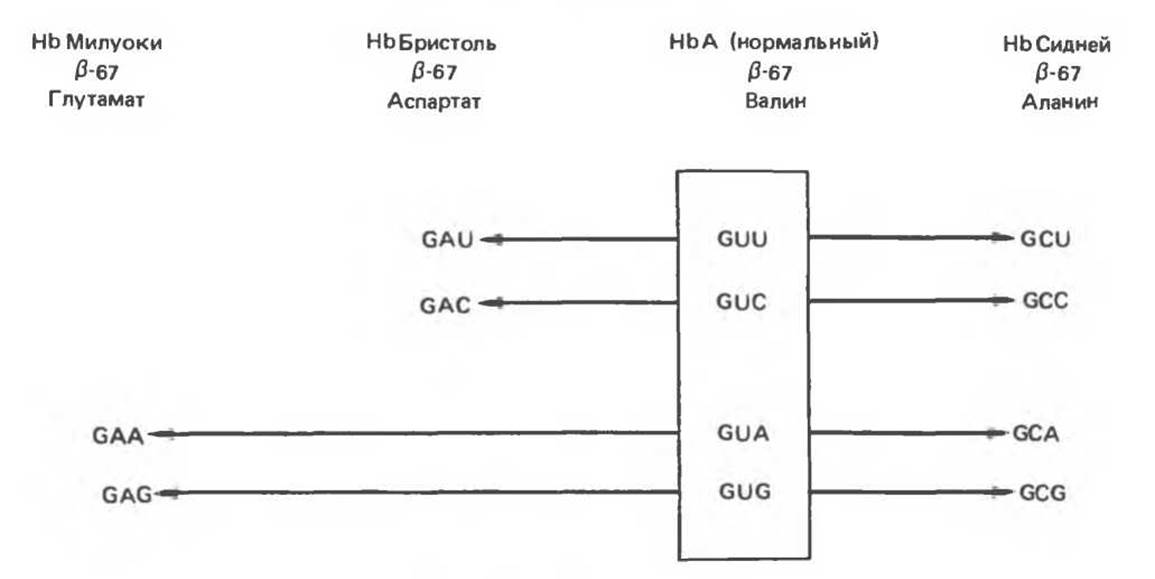
Рис. 40.4. В нормальной ß-цепи гемоглобина А человека в 67-м положении находится валин, кодируемый одним из четырех кодонов, заключенных в прямоугольник. В аномальном гемоглобине типа Милуоки в этом положении обнаруживается глутамат, кодируемый либо GAA-, либо GAG-кодоном. Оба кодона могут возникнуть в результате единичной трансверсии валиновых кодонов GUA или GUG. Аналогично аланин в положении 67 ß-цепи гемоглобина типа Сидней может быть результатом однонуклеотидной замены в любом из четырех валиновых кодонов. Аспарагиновая кислота в гемоглобине типа Бристоль может появиться в результате замены одного нуклеотида в одном из двух валиновых кодонов GUU или GUC.
Миссенс-мутации
А. Приемлемые миссенс-мутации. Примером приемлемых миссенс-мутаций в структурном гене ß-цепи гемоглобина (рис. 40.5, вверху) может служить мутация, которая выявляется по изменению электрофоретической подвижности гемоглобина эритроцитов практически здоровых людей. У представителей по крайней мере двух японских семей выявлен вариант гемоглобина, называемый гемоглобином Хикари. В молекуле гемоглобина этого типа аспарагин в положении 61 ß-цепи замещает лизин. Соответствующий кодон ААА или AAG изменен однонуклеотидной трансверсией на AAU или А АС. Замещение лизина на аспарагин никак не сказывается на нормальной функции ß-цепи гемоглобина Хикари.
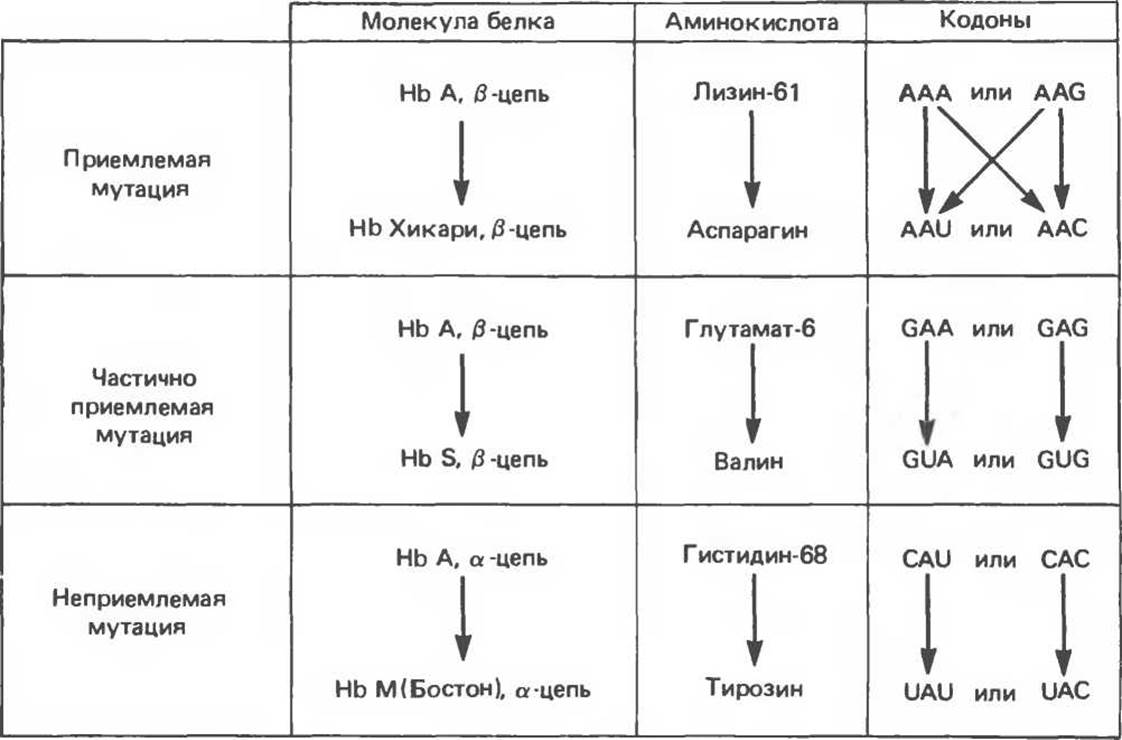
Рис. 40.5. Примеры трех типов миссенс-мутаций, ведущих к появлению аномальных ß-цепей гемоглобина. На рисунке указаны аминокислотные замены и возможные замены в соответствующих кодонах. У гемоглобина Хикари ß-цепь обладает практически нормальными физиологическими функциями при измененной электрофоретической подвижности. Функция гемоглобина S в результате мутации в ß-цепи частично утрачена: он может связывать кислород, но при деоксигенации выпадает в осадок. В гемоглобине М Бостон в результате мутации в a-цепи ион железа ІІ, входящий в состав гема, окисляется до железа III, что полностью исключает связывание кислорода.
Б. Частично приемлемые миссенс-мутации. Частично приемлемые миссенс-мутации лучше всего проиллюстрировать на примере серповидноклеточного гемоглобина S (рис. 40.5, середина). Миссенс-мутация в 6-м кодоне ß-цепи гемоглобина приводит к замене глутаминовой кислоты на валин (вместо кодонов GAA или GAG образуются кодоны GUA или GUG). Такая замена мешает нормальному функционированию гемоглобина и в гомозиготном состоянии приводит к серповидноклеточной анемии. Замену глутамина на валин можно расценивать как частично приемлемую, поскольку измененный гемоглобин хотя и аномально, но связывает и высвобождает кислород.
В. Неприемлемые миссенс-мутации. Неприемлемые миссенс-мутации (рис. 40.5. внизу) приводят к образованию полностью нефункционального гемоглобина. Например, мутация в гене гемоглобина М приводит к тому, что ион Fe2+ входящий в состав гема, окисляется до Fe3+ и гемоглобин переходит в мет-форму. Метгемоглобин не способен переносить кислород (см. гл. 6).
Мутации сдвига рамки считывания
Этот тип мутаций вызывается делениями или вставками нуклеотидов в последовательность гена, что соответствующим образом изменяет и последовательность считываемой с него мРНК. Деления одного нуклеотида в кодирующей цепи приводит к сдвигу рамки считывания в мРНК. Поскольку в последовательности мРНК нет разграничивающих кодоны «знаков пунктуации», транслирующий механизм не узнает делеции. Это приводит к синтезу совершенно иной полипептидной цепи (рис. 40.6, пример 1), в том числе и в области, значительно удаленной от собственно делеции. В результате однонуклеотидной делеции или вставки считываемая информация совершенно искажается, кроме того, могут возникать нонсенс-кодоны, прерывающие дальнейший рост полипептидной цепи (рис. 40. 6, пример 3).
Если делетированы три или кратное трем число нуклеотидов, то с соответствующей мРНК будут считываться молекулы белка, у которых отсутствует определенное число аминокислот (рис. 40. 6, пример 2). Поскольку генетический код построен из триплетов, то в этом случае в области, удаленной от делеции, аминокислотная последовательность останется неискаженной. Если делеция одного или двух нуклеотидов произойдет непосредственно перед или внутри стоп-кодона, то может наблюдаться аномальное удлинение полипептидной цепи. Трансляция продлится вплоть до ближайшего стоп-кодона (рис. 40.6, пример 1). Яркие примеры таких мутаций приведены при обсуждении различных гемоглобинопатий.
Вставки одного, двух или любого, не кратного трем, числа нуклеотидов в ген также приводят к образованию измененной мРНК со сдвигом рамки считывания, что в свою очередь ведет к последствиям, принципиально не отличающимся от тех, что возникают в результате делеций. Это может быть искажение аминокислотной последовательности в протяженной области, вслед за местом вставки; образование нонсенс-кодона (в месте вставки или на некотором расстоянии от него) и преждевременная терминация синтеза белка или сквозное снизывание при элиминировании нормального стоп-кодона. Вставка, возникающая в гене вслед за делецией (или наоборот), может восстановить правильную рамку считывания (рис. 40.6, пример 4). Трансляция такой мРНК приведет к образованию полипептида с искаженным участком, заключенным между сайтами вставки и делеции. За точкой восстановления рамки считывания аминокислотная последовательность будет нормальной. Можно представить множество комбинаций делеций и вставок, в результате которых образуются белки, содержащие участки с измененной структурой, окруженные участками с исходной аминокислотной последовательностью. Этот феномен был убедительно продемонстрирован на бактериофаге Т4, что внесло значительный вклад в доказательство триплетной природы генетического кода.
Супрессорные молекулы тРНК
Выше мы обсуждали появление измененных белковых продуктов в результате мутирования структурных генов, подразумевая, что все молекулы тРНК функционируют нормально. Однако в прокариотических организмах и у низших эукариот обнаружены аномально функционирующие тРНК, сами по себе являющиеся результатом мутаций. Некоторые из таких аномальных молекул тРНК способны супрессировать мутации структурных генов. Супрессорные молекулы тРНК обычно образуются в результате изменений в области антикодона. Они могут супрессировать миссенс-, нонсенс-мутации и мутации сдвига рамки. Однако поскольку супрессорные тРНК не способны отличать нормальный кодон от кодона, возникшего в результате мутации, их присутствие в клетке обычно сопровождается снижением выживаемости. Например, нонсенс-супрессорная тРНК будет супрессировать и нормальные сигналы терминации, допуская таким образом нежелательное сквозное считывание нормальных генов. Молекулы тРНК — супрессоры мутаций сдвига рамки — могут считывать нормальный кодон и первый нуклеотид следующего за ним кодона, что приводит к сдвигу рамки, в том числе и в тех случаях, когда это нежелательно. Супрессорные тРНК, вероятно, могут присутствовать и в клетках млекопитающих, поскольку в них удавалось наблюдать феномен сквозной трансляции через стоп-кодон.
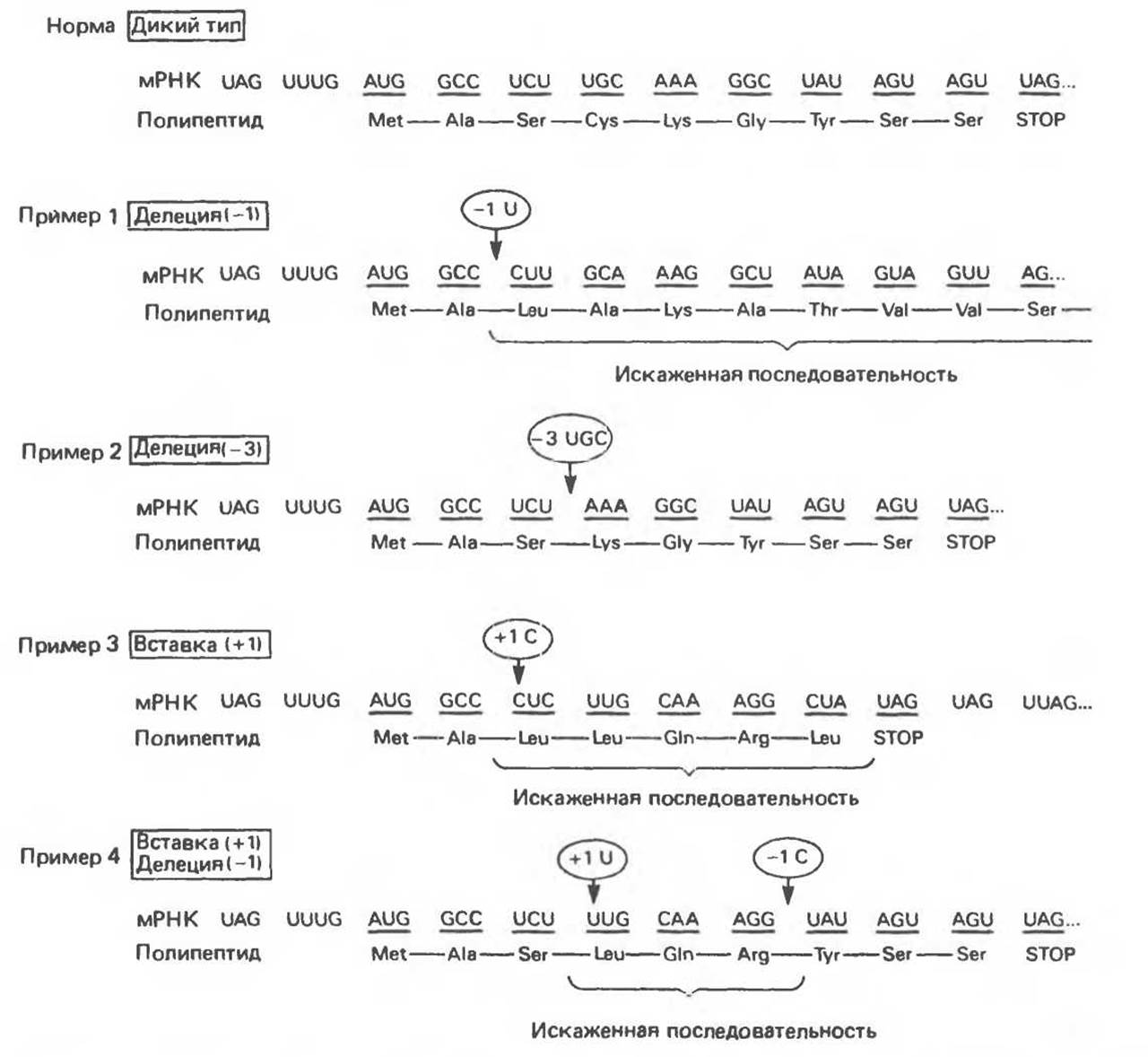
Рис. 40.6. Примеры различных вариантов изменений в структуре мРНК и в транслируемой аминокислотной последовательности, вызванных делениями и вставками в кодирующей области гена. Стрелками обозначены сайты вставок и делений. Цифры в кружках указывают на число встроенных или удаленных нуклеотидов.