Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Мембраны: структура, сборка и функции
Мембранные белки
Белки, ассоциированные с бислоем
Мембранные фосфолипиды играют роль растворителя для мембранных белков, создавая микроокружение, в котором последние могут функционировать. Из 20 аминокислот, входящих в состав белков, шесть являются в высшей степени гидрофобными из-за боковых групп, присоединенных к а-атому углерода, несколько аминокислот слабо гидрофобны, а остальные гидрофильны. Как мы видели в гл. 5, при образовании а-спирали гидрофобность самих пептидных групп минимизируется. Таким образом, белки могут образовывать единое целое с мембраной. Для этого нужно, чтобы их гидрофильные участки выступали из мембраны внутрь клетки и наружу, а гидрофобные пронизывали гидрофобную сердцевину бислоя. И в самом деле, те участки белковых молекул, которые погружены в мембрану, содержат большое количество гидрофобных аминокислот и характеризуются высоким содержанием а-спиралей или β-слоев.
Число разных белков в мембране варьирует от 6—8 в саркоплазматическом ретикулуме до более чем 100 в плазматической мембране. Это ферменты, транспортные белки, структурные белки, антигены (т. е. белки, определяющие гистосовместимость) и рецепторы для разных молекул. Поскольку каждая мембрана характеризуется своим набором белков, говорить о существовании некой типичной структуры мембран нельзя. В табл. 42.2 представлены ферментативные активности, присущие некоторым типам мембран.
Таблица 42.2. Ферментные маркеры различных мембран 1)
|
Мембрана |
Фермент |
|
Плазматическая |
5'-Нуклеотидаза |
|
Аденилатциклаза Na+/K+-ATPa3a |
|
|
Эндоплазматический ретикулум |
Глюкозо-6-фосфатаза |
|
Аппарат Гольджи |
Галактозилтрансфераза |
|
Внутренняя митохондриальная мембрана |
АТРсинтаза |
1) Мембраны содержат много белков; многие из них обладают ферментативной активностью. Некоторые ферменты локализованы в определенных мембранах и могут, таким образом, служить маркерами при очистке этих мембран.
Мембраны являются динамическими структурами.
Мембранные белки и липиды постоянно обновляются. Скорости обновления разных липидов, как и разных белков, варьируют в широком диапазоне. Сами мембраны могут обновляться даже быстрее, чем любой их компонент. Более подробно этот вопрос будет рассмотрен в разделе, посвященном эндоцитозу.
Асимметрия мембран
Асимметрия является важным свойством мембран и, по-видимому, отчасти связана с неравномерным распределением белков в мембране. Трансмембранная асимметрия может быть обусловлена и разной локализацией углеводов, связанных с мембранными белками. Кроме того, на внешней или внутренней стороне мембраны могут быть расположены какие-то специфические ферменты; это касается как митохондриальных, так и плазматических мембран.
Мембраны обладают также локальной асимметрией. В некоторых случаях (например, в щеточной каемке клеток слизистых оболочек) она проявляется почти на макроскопическом уровне. В других случаях (например, в области щелевых контактов, плотных контактов и синапсов, занимающих очень небольшую часть площади мембраны) области локальной асимметрии невелики.
Наблюдается также асимметрия в распределении фосфолипидов между наружной и внутренней сторонами мембран (поперечная асимметрия). Так, холинсодержащие фосфолипиды (фосфатидилхолин и сфингомиелин) располагаются в основном в наружном молекулярном слое, а аминофосфолипиды (фосфатидилсерин и фосфатидилэтаноламин) — преимущественно во внутреннем. Холестерол обычно содержится в наружном слое в больших количествах, чем во внутреннем. Очевидно, что если такая асимметрия в принципе существует, то поперечная подвижность (флип-флоп) мембранных фосфолипидов должна быть ограничена. И в самом деле, для фосфолипидов в синтетических бислоях характерна исключительно низкая скорость перескоков — время существования асимметрии может измеряться днями или неделями. Однако при искусственном включении в синтетические бислои некоторых мембранных белков, например эритроцитарного белка гликофорина, частота флип-флоп-переходов фосфолипидов может возрасти в сотню раз.
Механизмы асимметричного распределения липидов пока не установлены. Участвующие в синтезе фосфолипидов ферменты локализованы на цитоплазматической стороне мембран микросомных везикул. Таким образом, можно предположить, что существуют транслоказы, переносящие определенные фосфолипиды от внутреннего слоя к наружному. Кроме того, в обоих слоях могут присутствовать специфические белки, преимущественно связывающие те или иные фосфолипиды и приводящие к их асимметричному распределению.
Интегральные и периферические мембранные белки
Большинство мембранных белков являются интегральными компонентами мембран (они взаимодействуют с фосфолипидами); почти все достаточно полно изученные белки имеют протяженность, превышающую 5—10 нм, — величину, равную толщине бислоя. Эти интегральные белки обычно представляют собой глобулярные амфифильные структуры. Оба их конца гидрофильны, а участок, пересекающий сердцевину бислоя, гидрофобен. После установления структуры интегральных мембранных белков стало ясно, что некоторые из них (например, молекулы белков-переносчиков) могут пересекать бислой многократно, как это показано на рис. 42.7.
Интегральные белки распределены в бислое асимметрично (рис. 42.8). Если мембрану, содержащую асимметрично распределенные интегральные белки, растворить в детергенте, а затем детергент медленно удалить, то произойдет самоорганизация фосфолипидов и интегральных белков и сформируется мембранная структура, но белки в ней уже не будут специфическим образом ориентированы. Таким образом, асимметричная ориентация в мембране по крайней мере некоторых белков может задаваться при их включении в липидный бислой. Наружная гидрофильная часть амфифильного белка, которая, конечно, синтезируется внутри клетки, должна затем пересечь гидрофобный слой мембраны и в конечном итоге оказаться снаружи. Молекулярные механизмы организации мембран мы обсудим позже.
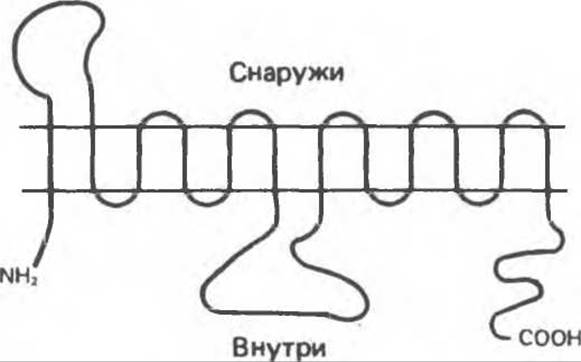
Рис. 42.7. Предполагаемая модель переносчика глюкозы у человека. Предполагается, что переносчик пересекает мембрану 12 раз. Пересекающие мембрану участки могут образовывать амфифильные а-спирали с амидной и гидроксильной боковыми группами и, по-видимому, связывают глюкозу или образуют канал для ее переноса. Амино- и карбоксильный концы цепи находятся на цитоплазматической поверхности. (Из работы Mueckler et al.: Sequence and structure of a human glucose transporter. Science, 1985. 229, 941, с любезного разрешения.)
Периферические белки не взаимодействуют с фосфолипидами в бислое непосредственно; вместо этого они образуют слабые связи с гидрофильными участками специфических интегральных белков. Например, анкирин, периферический белок, связан с интегральным белком полосы III эритроцитарной мембраны. Спектрин, образующий скелет мембраны эритроцита, в свою очередь связан с анкирином и, таким образом, играет важную роль в поддержании двояковогнутой формы эритроцита. Молекулы иммуноглобулина являются интегральными белками плазматической мембраны и высвобождаются только вместе с небольшим фрагментом мембраны. Интегральными белками являются многие рецепторы различных гормонов, и специфические полипептидные гормоны, связывающиеся с этими рецепторами, можно, таким образом, считать периферическими белками. Такие периферические белки, как пептидные гормоны, могут даже детерминировать распределение в плоскости бислоя интегральных белков — их рецепторов (см. ниже).