Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Гормоны гипофиза и гипоталамуса
Гормоны передней доли гипофиза - Группа гормон роста - пролактин - хорионический соматомаммотропин
Передняя доля гипофиза продуцирует большое количество гормонов, стимулирующих различные физиологические и биохимические процессы в тканях-мишенях. Кроме того, гормоны, находящиеся в близком родстве с некоторыми гормонами передней доли гипофиза, синтезируются плацентой. По установившейся традиции эти гормоны рассматривались порознь, однако новые исследования механизма их синтеза и внутриклеточных посредников их действия позволяют объединить указанные гормоны в три общие группы: 1) группа, включающая гормон роста, пролактин и хорионический соматомаммотропин; 2) группа гликопротеиновых гормонов и 3) пептиды семейства проопиомеланокортина.
Гормон роста (ГР), пролактин (ПРЛ) и хорионический соматомаммотропин (ХС; плацентарный лактоген) представляют собой семейство белковых гормонов, обладающих значительной гомологией последовательностей. Их молекулы у разных видов насчитывают 190—199 аминокислотных остатков. Молекулы каждого из гормонов этой группы содержат один остаток триптофана (в положении 85 в ГР и ХС и в положении 91 в пролактине) и две гомологичные дисульфидные связи. Гомология аминокислотного состава ГР и ХС человека составляет 85%, а ГР и ПРЛ человека — 35%. В связи с этим неудивительно, что все три гормона имеют общие антигенные детерминанты, обладают рост-стимулирующей и лактогенной активностью. Продуцируются они только определенными тканями: ГР и ПРЛ — передней долей гипофиза, ХС — синцитиотрофобластными клетками плаценты. Секреция каждого из них, по-видимому, находится под контролем собственного регуляторного механизма (см. ниже).
На основании сходства ГР, ПРЛ и ХС несколько лет назад была высказана гипотеза, согласно которой гены, детерминирующие синтез этих гормонов, возникли в результате дупликации одного гена-предшественника. С помощью метода генной инженерии установлено следующее: у приматов и человека существует несколько генов для ГР и ХС; единственный пролактиновый ген, кодирующий очень сходный белок, по размеру в 5 раз превосходит гены ГР и ХС; гены группы ГР—ХС локализованы у человека в хромосоме 17, а ген пролактина — в хромосоме 6; обнаружена заметная эволюционная дивергенция этих генов. В тканях крысы и крупного рогатого скота на гаплоидный геном приходится по одной копии генов ГР и ПРЛ. У человека выявлен один пролактиновый ген, один функциональный ген гормона роста (ГР-N) и его вариант (ГР-V), кроме того, доказано существование двух экспрессируемых генов хорионического соматомаммотропина (ХС-А и ХС-В) и одного неэкспрессируемого (XC-L). У некоторых видов обезьян имеется по меньшей мере 4 гена семейства ГР—ХС. Кодирующая последовательность всех этих генов организована в 5 экзонов, прерываемых 4 нитронами (рис. 45.2). Эти гены обладают высокой степенью гомологии в 5'-фланкирующих областях и в кодирующих последовательностях (в последнем случае ~93%-ная гомология) и обнаруживают дивергенцию в 3'-фланкирующих областях. Участки сплайсинга высококонсервативны, несмотря на значительно большую длину нитронов в пролактиновом гене.
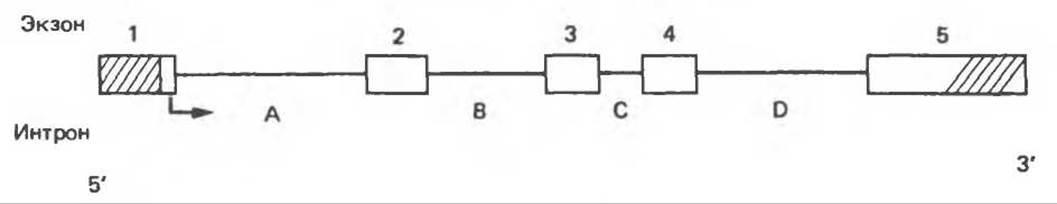
Рис. 45.2. Схематическое изображение структуры гена гормона роста человека. Ген имеет длину около 45 т. п. н. и состоит из 5 экзонов и 4 интронов. Заштрихованные участки обозначают некодирующие области в экзонах 1 и 5. Стрелки указывают направление транскрипции.
Семейство человеческих генов ГР—ХС локализовано в области q 22—24 длинного плеча хромосомы 17. На рис. 45.3 указаны относительные положения каждого из этих генов в ориентации от 5'- к 3'-положению. Гены транскрибируются в направлении 5'→3', и ГР-N отстоит от ХС-В примерно на 45 т. п. н.
Кодирующая последовательность ГР-N детерминирует аминокислотную последовательность циркулирующего ГР; этот ген чувствителен к ДНКазе І, что говорит о его локализации в зоне «активного хроматина». Ген ГР-V, если он экспрессируется, кодирует белок, отличающийся от ГР по 13 аминокислотам. Ген устойчив к ДНКазе I и поэтому может быть неактивным. Ген ГР-V обнаруживается у больных, у которых отсутствует ген ГР-N (наследственная недостаточность ГР); поскольку в таких случаях регистрируется отсутствие гормона роста, ген ГР-V либо является молчащим, либо образует неактивную молекулу ГР. Первое более вероятно, так как в организме указанных больных образуются антитела к экзогенному ГР и, следовательно, их иммунная система не была ранее «знакома» с этой молекулой.
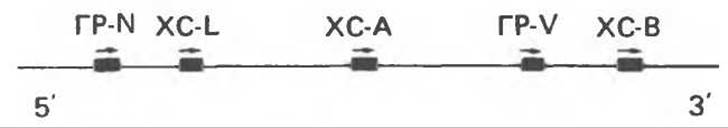
Рис. 45.3. Локализация и ориентация семейства генов ГР (гормона роста) — ХС (хорионического соматомаммотропина) на хромосоме 17 человека. Относительные положения генов семейства ГР и ХС даны в ориентации от 5' к 3'. Стрелки обозначают направление транскрипции.
Гены ХС-А и ХС-В экспрессируются в плаценте; ген ХС-L является молчащим геном.
Гормон роста (ГР)
А. Синтез и структура. Гормон роста синтезируется в соматотрофах, которые составляют подкласс ацидофильных клеток гипофиза и являются наиболее многочисленной группой в этой железе. Концентрация ГР в гипофизе — 5—15 мг/г — значительно превышает содержание других гипофизарных гормонов (их количество исчисляется в мкг/г). Гормон роста у всех видов млекопитающих представляет собой одиночный пептид с молекулярной массой около 22 000. На рис. 45.4 представлена аминокислотная последовательность молекулы гормона роста человека (191 аминокислота). Несмотря на высокую степень гомологии последовательностей гормонов роста различных млекопитающих, в клетках человека активен только собственный гормон роста человека или ГР высших приматов.
Б. Регуляция секреции и синтеза. На секрецию ГР влияет ряд стимулов (сон, стресс), и она, подобно секреции многих гипофизарных гормонов, носит эпизодический и пульсирующий характер. В течение нескольких минут уровень ГР в плазме может измениться в 10 раз. Один из самых больших пиков отмечается вскоре после засыпания, что подтверждает поговорку: «Кто не спит, тот не растет». К другим стимулам относятся стресс (боль, холод, тревога, хирургическое вмешательство), физические упражнения, острая гипогликемия или голодание, белковая пища или аминокислота аргинин. Реакции на стресс могут быть опосредованы катехоламинами, действующими через гипоталамус. Возможна связь этих и многих других эффекторов с основным физиологическим действием ГР, состоящим в сберегании глюкозы. При стрессе, гипогликемии, во время сна или голодания ГР стимулирует липолиз (поступление жирных кислот) и проникновение в клетки аминокислот (потенциальных субстратов глюконеогенеза), сберегая таким образом глюкозу для метаболизма мозга. Ключевую роль может играть внутриклеточная концентрация глюкозы (или ее метаболита) в регулирующей секрецию ГР области вентромедиального ядра гипоталамуса.

Рис. 45.4. Структура молекулы гормона роста человека. Цифры обозначают положение аминокислотных остатков, начиная с N-конца.
На высвобождение ГР оказывает влияние множество агентов, в том числе эстрогены, дофамин, а-адренергические соединения, серотонин, опиатные полипептиды, гормоны кишечника и глюкагон. Точкой приложения действия всех этих факторов является вентромедиальное ядро гипоталамуса, где осуществляется регуляция секреции гормона роста по типу обратной связи (рис. 45.5). Короткая петля системы включает положительный (стимулирующий) регулятор секреции — соматолиберин — и отрицательный (тормозящий) регулятор — соматостатин. Периферическая петля включает инсулиноподобный фактор роста 1 (ИФР-1, известный также как соматомедин С и сульфирующий фактор).
Рост-стимулирующее действие ГР опосредуется в первую очередь ИФР-1, который образуется в печени. ИФР-1 регулирует секрецию ГР, подавляя высвобождение соматолиберина из клеток гипоталамусом и стимулируя высвобождение соматостатина. Ингибирование по короткой петле обратной связи обеспечивается самим ГР, тормозящим высвобождение соматолиберина. Этот гормон образуется в срединном возвышении и, как недавно было показано, стимулирует не только секрецию, но и транскрипцию гена ГР. Некоторые эффекты соматолиберина дублируются дофамином, который также повышает продукцию ГР.
Торможение секреции гормона роста осуществляется соматостатином, который, кроме того, подавляет секрецию глюкагона, инсулина, тиреотропина, фоллитропина, адренокортикотропина и многих других гормонов, но не влияет на высвобождение пролактина. Тетрадекапептид-соматостатин содержит дисульфидный мостик, но активен и в линейной, и в циклической форме (табл. 45.2). Соматостатин синтезируется как часть прогормона (мол. масса 11 500), обладающая такой же биологической активностью, что и 28-членный предшественник. Секрецию соматостатина повышают Са2+, Na+, гормоны щитовидной железы, сАМР и вазоактивный интестинальный пептид. Снижение секреции вызывают атропин, ацетилхолин и ГАМК (у-аминомасляная кислота). Эффект ГАМК снимается пикротоксином и соединениями группы бензодиазепина. Механизм влияния этих агентов на высвобождение соматостатина и ГР гипоталамусом еще не выяснен. Поскольку соматостатин продуцируется целым рядом тканей, может существовать множество различных типов регуляции его синтеза и высвобождения.
По-видимому, соматостатин тормозит секрецию ГР, ингибируя мобилизацию кальция. Не ясно, осуществляется ли это благодаря изменению притока Са2+ в клетку или в силу стабилизации его внутриклеточных резервов. Гормон также ингибирует отток К+, который может в свою очередь снижать приток Са2+.

Рис. 45.5. Схема регуляции секреции гормона роста по механизму обратной связи. Пунктирные линии обозначают ингибиторные эффекты, сплошные линии — стимулирующие эффекты. Описание см. в тексте.
В. Физиологические и биохимические эффекты. ГР
необходим для постнатального роста и для нормализации углеводного, липидного, азотного и минерального обмена. Как упоминалось выше, ростовые эффекты ГР опосредуются главным образом ИФР-1, ген которого относится к семейству инсулиноподобных генов. Первоначально он был известен как «сульфирующий фактор» благодаря своей способности стимулировать включение сульфата в хрящ, позднее его стали называть соматомедин С. По структуре он сходен с проинсулином (см. гл. 51 и рис. 51.8). В плазме человека обнаруживается еще один родственный пептид — инсулиноподобный фактор роста 2 (ИФР-2). Его активность практически идентична той, которую по отношению к крысам называют «активностью, стимулирующей мультипликацию» (фактор ACM). И ИФР-1, и ИФР-2 связываются с мембранными рецепторами, однако они могут быть разделены с помощью специфического радиоиммуноанализа. ИФР-1 состоит из 70 аминокислот, ИФР-2 — из 67. Несмотря на то что содержание ИФР-1 в плазме вдвое меньше содержания ИФР-2, именно ИФР-1 обнаруживает корреляцию с эффектами ГР. Лица с дефицитом ИФР-1, вырабатывающие ИФР-2 в достаточном количестве (см. табл. 45.3), лишены способности к нормальному росту.
Таблица 45.3. Соотношение ГР, ИФР-1 и ИФР-2 при дварфизме (карликовости)
|
Содержание в плазме |
||||
|
ГР |
ИФР-1 |
ИФР-2 |
Ответ на стимуляцию ГР |
|
|
Карлики с дефицитом ГР |
Низкое |
Низкое |
От низкого до нормального |
Есть |
|
Пигмеи |
Нормальное Низкое |
Нормальное |
Нет |
|
|
Карлики Ларона |
Высокое |
Низкое |
Низкое |
Нет |
1. Синтез белка. ГР стимулирует транспорт аминокислот в мышечные клетки и, кроме того, усиливает синтез белка, причем независимо от влияния на транспорт аминокислот. У животных, получающих ГР, возникает положительный азотный баланс, что отражает общее повышение белкового синтеза и снижение содержания аминокислот и мочевины в плазме и моче. Указанные изменения сопровождаются повышением уровня синтеза РНК и ДНК в отдельных тканях. В этом отношении действие ГР сходно с некоторыми эффектами инсулина.
2. Углеводный обмен. В плане влияния на углеводный обмен гормон роста является антагонистом инсулина. Гипергликемия, возникающая после введения ГР, — результат сочетания сниженной периферической утилизации глюкозы и ее повышенной продукции печенью в процессе глюконеогенеза. Действуя на печень, ГР увеличивает содержание в ней гликогена, вероятно, вследствие активации глюконеогенеза из аминокислот. ГР может вызывать нарушение некоторых стадий гликолиза, а также торможение транспорта глюкозы. Обусловлен ли данный эффект прямым действием ГР на транспорт или он является результатом подавления гликолиза, пока не установлено. Ингибирование гликолиза в мышцах может быть также связано с мобилизацией жирных кислот из триацилглицероловых резервов. При длительном введении ГР существует опасность возникновения сахарного диабета.
3. Липидный обмен. При инкубации жировой ткани с ГР in vitro усиливается высвобождение неэстерифицированных (свободных) жирных кислот и глицерола. Введение ГР in vivo вызывает быстрое (30—60 мин) повышение содержания свободных жирных кислот в крови и их окисления в печени. В условиях не достаточности инсулина (например, при диабете) может возрастать кетогенез. Эти эффекты так же, как и действие ГР на углеводный обмен, скорее всего не опосредуются ИФР-1.
4. Минеральный обмен. ГР или, что более вероятно, ИФР-1 способствует положительному балансу кальция, магния и фосфата и вызывает задержку Na+, К+ и Сl-. Первый эффект, возможно, связан с действием ГР на кости: он стимулирует рост длинных костей в области эпифизарных пластинок у детей и аппозиционный или акральный рост у взрослых. У детей ГР усиливает и образование хряща.
5. Пролактиноподобные эффекты. ГР связывается с лактогенными рецепторами и поэтому обладает многими свойствами пролактина, в частности способностью к стимуляции молочных желез, лактогенеза и роста зоба у голубей.
Г. Патофизиология. Недостаточность ГР, обусловленная пангипопитуитаризмом или только отсутствием самого ГР, особенно опасна у детей, поскольку нарушает их способность к нормальному росту. Другие метаболические последствия этой недостаточности менее опасны. Значение различных аспектов действия ГР наглядно иллюстрирует существование разных видов карликовости (табл. 45.3). Карлики с дефицитом ГР нормально реагируют на экзогенный ГР. Описаны два типа резистентности органов-мишеней к гормону. При карликовости Ларона присутствуют избыточные количества ГР-N, но отсутствуют рецепторы ГР в печени. У пигмеев, по-видимому, имеет место пострецепторный дефицит в действии ГР, вследствие чего сохраняются только опосредованные ИФР-1 эффекты гормона.
Если избыток ГР (обусловленный обычно ацидофильной опухолью гипофиза) возникает до зарастания эпифизарных щелей (когда еще возможен ускоренный рост длинных костей), у больного развивается гигантизм. Если же избыточная секреция ГР начинается после зарастания эпифизарных щелей и прекращения роста длинных костей, наблюдается акромегалия. Акральный рост костей приводит к характерным изменениям лица (выступающая челюсть, огромный нос) и увеличению размеров кистей, стоп и черепа. Другие симптомы включают разрастание внутренних органов, истончение кожи и различные метаболические расстройства, в том числе сахарный диабет.
Понимание механизмов регуляции секреции ГР помогает анализировать результаты клинических тестов, применяемых для диагностики перечисленных нарушений. Больные с дефицитом ГР утрачивают способность к повышению его уровня в ответ на индуцированную гипогликемию, введение аргинина или лево-ДОФА. У больных с обусловленным опухолью избытком ГР (гигантизм или акромегалия) не происходит уменьшения количества гормона при введении глюкозы.
Пролактин (ГІРЛ: лактогенный гормон, маммотропин, лютеотропный гормон)
A. Синтез и структура. Пролактин (ПРЛ) — белковый гормон с мол. массой около 23000; его первичная структура представлена на рис. 45.6. Пролактин секретируется лактотрофами — ацидофильными клетками передней доли гипофиза. Количество и размеры этих клеток возрастают в период беременности. О сходстве в структуре и функции между пролактином, гормоном роста и хорионическим соматомаммотропином уже говорилось выше.
Б. Регуляция секреции. Раннее и важное наблюдение, сделанное в ходе изучения регуляции секреции пролактина, заключалось в том, что этот процесс в отличие от секреции других гормонов гипофиза усиливается при помещении железы вне турецкого седла или при полном пересечении ножки гипофиза. Отсюда следует, по-видимому, что секреция пролактина может находиться под тоническим ингибиторным контролем со стороны гормона, тормозящего его высвобождение (пролактостатина), и этим гормоном, вероятно, является дофамин. Гипофизарные клетки обладают рецепторами дофамина; дофамин снижает секрецию пролактина и подавляет транскрипцию пролактинового гена, возможно, путем уменьшения уровня сАМР. Лево-ДОФА, используемый в клинике предшественник дофамина, ингибирует секрецию пролактина и в то же время стимулирует секрецию ГР. В торможении секреции пролактина участвует и гонадолиберин-ассоциированный пептид (ГАП; рис. 45.2). Что касается положительной регуляции секреции пролактина, то наличие пролактин-высвобождающего гормона (пролактолиберина) нельзя считать твердо установленным. Уровень пролактина возрастает на поздних сроках беременности и при лактации. Физиологическим индуктором секреции пролактина является раздражение грудных сосков, процесс секреции активируют также стресс, сон и сексуальные контакты.
B. Физиологическое и биохимическое действие.
Пролактин участвует в инициации и поддержании лактации у млекопитающих. В физиологических количествах он влияет на ткань молочной железы только тогда, когда она испытывает действие женских половых гормонов. Однако в избыточных количествах пролактин может стимулировать развитие железы у овариэктомированных самок, а также у самцов. У грызунов пролактин способен поддерживать существование желтых тел — отсюда название «лютеотропный гормон». Родственные ему молекулы, по-видимому, обеспечивают адаптацию морских рыб к пресной воде, линьку рептилий и продукцию молочка зобом птиц. Внутриклеточный медиатор действия пролактина неизвестен. Высказано предположение о существовании пептида, выполняющего функцию такого медиатора, но это предположение не проверено.
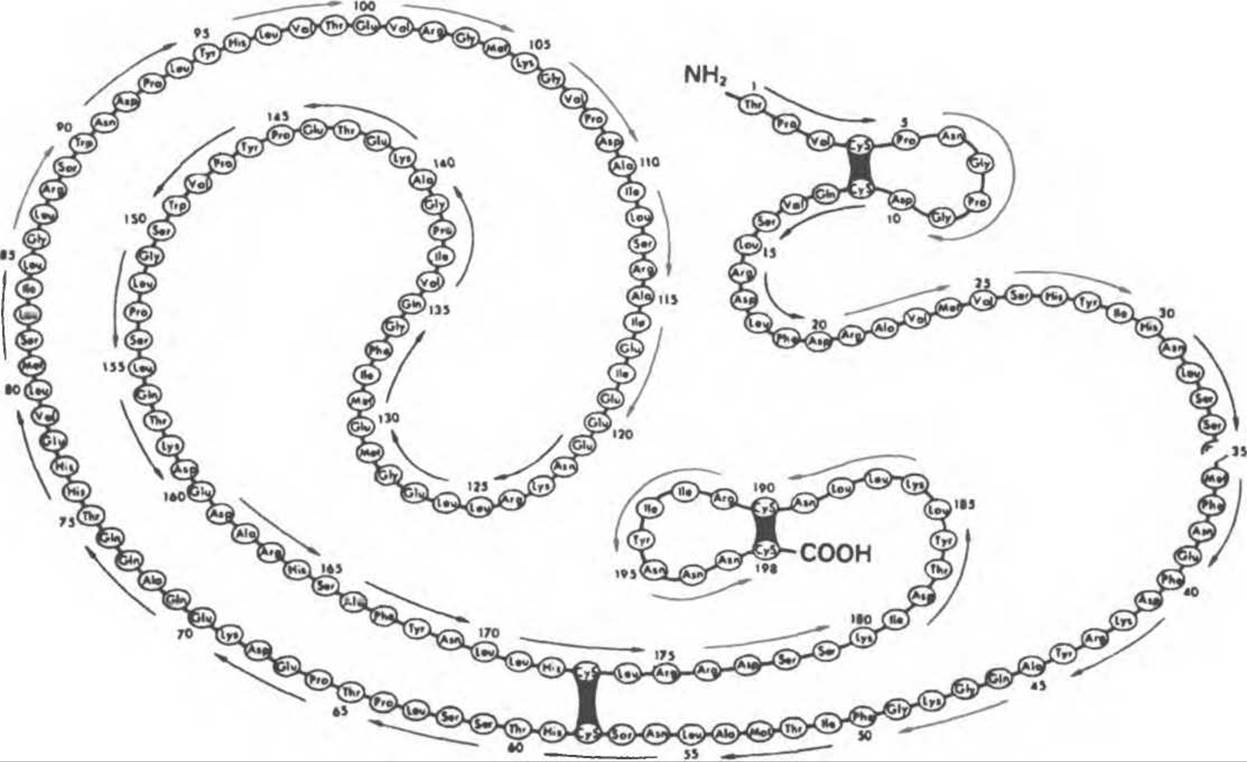
Рис. 45.6. Структура овечьего пролактина.
Г. Патофизиология. Опухоли, состоящие из пролактин-секретирующих клеток, вызывают у женщин аменорею (прекращение менструаций) и галакторею (истечение молока из грудных желез). С избытком пролактина связаны гинекомастия (увеличение грудных желез) у женщин и импотенция у мужчин.
Хорионический соматомаммотропии (ХС; плацентарный лактоген)
Этот последний член семейства ГР—ПРЛ—ХС не выполняет у человека строго определенной функции. При биологических испытаниях он проявляет лактогенную и лютеотропную активность, а его метаболические эффекты качественно сходны с действием гормона роста, включая торможение поглощения глюкозы, стимуляцию высвобождения свободных жирных кислот и глицерола, усиление задержки азота и кальция (несмотря на повышение выделения кальция с мочой), а также снижение мочевой экскреции фосфора и калия. ХС может поддерживать рост развивающегося плода, однако и в тех случаях, когда ни у плода, ни в плаценте нет генов группы ГР—ХС (кроме генов ГР-N и ХС-L), внутриутробное развитие плода и рост младенца в неонатальном периоде протекают нормально. Поскольку ген ХС-L у человека не экспрессирован, возможный источник ХС у таких лиц отсутствует.