Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Треонин
Биосинтез
Данные о синтезе треонина были получены при изучении процессов обмена у различных микроорганизмов. Результаты исследования мутанта Neurospora crassa, нуждающегося для роста как в метионине, так и в треонине, показали, что гомосерин может замещать обе эти аминокислоты [235]. Это явилось первым указанием на возможность синтеза треонина из гомосерина. Найдено, что в культурах мутанта Neurospora, для роста которого необходим только метионин, накапливаются гомосерин и треонин [236]. Дрожжи и Escherichia coli при росте на средах с меченым ацетатом синтезируют треонин и аспарагиновую кислоту, в которых атомы изотопа распределены одинаково [48, 64]. Результаты изотопных исследований также согласуются с предположением, по которому гомосерин является предшественником треонина [117, 233]. Дальнейшие успехи в выяснении путей биосинтеза треонина были достигнуты благодаря исследованиям Коэна и его сотрудников [240—242] и Блэка [243—248]. Найдено, что суспензии мутанта Е. coli, нуждающегося для роста в треонине, способны превращать аспарагиновую кислоту в гомосерин, а суспензии клеток нормальных штаммов Е. coli используют гомосерин для синтеза треонина [240, 241]. В процессе превращения аспарагиновой кислоты в треонин Блэк открыл два новых промежуточных продукта, а именно ß-аспартилфосфат и ß-полуальдегид аспарагиновой кислоты. Промежуточные реакции этого превращения были изучены с использованием очищенных ферментных препаратов, полученных из дрожжей [243—248]. Превращение L-аспарагиновой кислоты в L-ß-аспартилфосфат происходит в присутствии АТФ, ионов магния и фермента ß-аспартокиназы [246]:
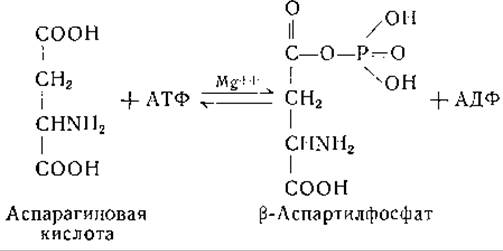
Специфический фермент, действующий при участии трифосфопиридиннуклеотида (дегидрогеназа ß-полуальдегида аспарагиновой кислоты), восстанавливает ß-аспартилфосфат в соответствующую альдегидокисл оту [247]:
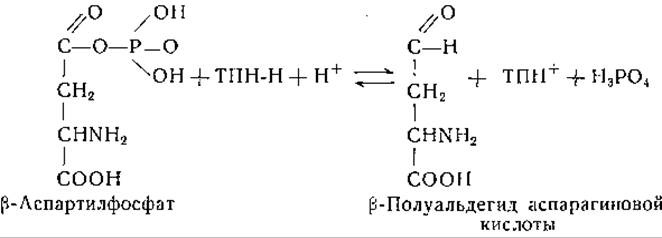
ß-Полуальдегид L-аспарагиновой кислоты восстанавливается гомосериндегидрогеназой (при участии дифосфопиридиннуклеотида) в L-гомосерин; этот фермент проявляет некоторую активность и с трифосфопиридиннуклеотидом [248]:
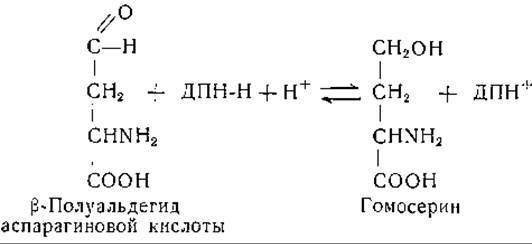
Коэн и сотрудники [249] нашли, что в первой фазе превращения промежуточным соединением служит ß-аспартилкофермент А; данные, полученные при изучении мутантов Е. coli, согласуются с описанной выше цепью реакций [250]. У Е. coli для превращения гомосерина в треонин необходимо присутствие АТФ и пиридоксальсросфата и, хотя для образования треонина необходимы оба кофактора, для исчезновения гомосерина достаточно присутствия одной АТФ. Из этого можно заключить, что процесс превращения гомосерина в треонин протекает с образованием промежуточного соединения1. У различных бактерий треонин может частично замещать аспарагиновую кислоту, необходимую для роста [251, 252]; это объясняется рассмотренным выше превращением аспарагиновой кислоты в треонин. Роль треонинрацемазы у Е. coli [253] (стр. 245) еще не ясна.
Получены данные, показывающие, что а-кетокислота, соответствующая треонину, играет роль предшественника валина и изолейцина (стр. 353). У Neurospora изолейцин может синтезироваться также из ацетальдегида и а-кетомасляной кислоты, образующейся из треонина (стр. 336). В связи с этим представляет интерес обнаружение мутанта N. crassa, при выращивании которого в присутствии треонина в среде накапливаются а-кето-β-метилвалерьяновая, а-кетоизовалерьяновая и пировиноградная кислоты и ацетальдегид [254].