Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Аргинин, орнитин и цитруллин
В 1932 г. Кребс и Гензслайт [268] предложили для объяснения образования мочевины следующий цикл реакций:
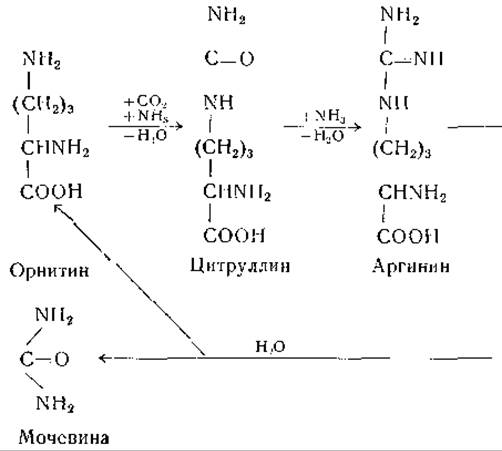
Эта схема находилась в соответствии с экспериментальными данными о каталитическом действии орнитина и цитруллина на образование мочевины в срезах печени. Результаты изотопных исследований на интактных животных [269—271] подтвердили в общих чертах механизм мочевинообразования, предусмотренный гипотезой Кребса и Гензелайта. Доказано наличие всех реакций этого цикла или большинства из них у Neurospora, Escherichia coli, Penicillium и различных молочнокислых бактерий [239, 272, 273, 275—277]. Аргиназа, известная с 1904 г. [274, 278], встречается во многих тканях млекопитающих, в частности в печени и в молочной железе [279—283]. Этот фермент активируется ионами некоторых двухвалентных металлов (Со++, Ni++, Fe++, Мn++) [284—286]. Он обладает некоторой активностью в отношении октопина [287], a-N-бензоиларгинина [288], L-a-уреидо-δ-гуанидиновалерьяновой кислоты [289], агматина [290] и канаванина [291], но не действует на а-кето-δ-гуанидиновалерьяновую кислоту [292], ε-гуанидинокапроновую кислоту [293], S-N-метил-аргинин [294], у-гуанидиномасляную кислоту [294] и на аргининфосфат [295]. При гидролизе канаванина образуются капалин и мочевина (стр. 49).
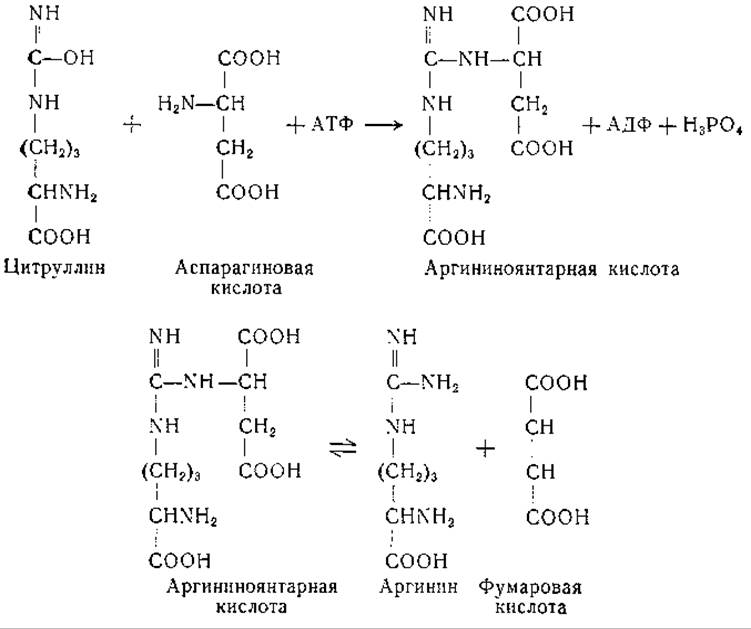
Превращение аргинина в мочевину и орнитин установлено много лет назад, механизмы же превращения орнитина в цитруллин и дитруллина в аргинин были выяснены лишь недавно. Образование аргинина из цитруллина может происходить в бесклеточных препаратах печени и почек [296, 297]. Найдено, что это превращение происходит более активно в присутствии аспарагиновой или глутаминовой кислоты. В дальнейших исследованиях Ратнер и ее сотрудников [298—306] показано, что образование аргинина из цитруллина происходит с обязательным участием аспарагиновой кислоты и аденозинтрифосфата. Реакция протекает в две ступени с образованием промежуточного соединения — L-аргининоянтарной кислоты [307]. При ферментативном расщеплении L-аргининоянтарной кислоты образуются аргинин и фумаровая кислота. Эту последовательность реакций передают следующие уравнения:
У Chlorella обнаружена канаваноянтарная кислота — канаваниновый аналог аргининоянтарной кислоты [308, 309]. Канаваноянтарная кислота образуется путем реакций, аналогичных реакциям, приводящим к образованию аргининоянтарной кислоты; ферментные системы млекопитающих также способны синтезировать канаваноянтарную кислоту и расщеплять ее [310, 311]. Интересно, что препараты почек свиньи катализируют перенос амидиновой группы канаванина на орнитин с образованием каналина и аргинина; реакция обратима. Фракции, полученные из почек, осуществляют также перенос амидиновой группы канаванина на глицин с образованием гуанидинуксусной кислоты (гликоциамина) [311] (стр. 321). Таким образом, аргинин, канаванин и гуанидинуксусная кислота могут служить донаторами амидиновой группы, а орнитин, каналин и глицин — ее акцепторами. Акцептором амидиновой группы может служить также лизин, превращаясь при этом в гомоаргинин [1087]. Высказано предположение, что при указанных реакциях в качестве общего промежуточного соединения образуется амидиновый комплекс фермента [1087, 1088].
Фермент, найденный в клетках Streptococcus faecalis и S. equinus, расщепляет канаванин, с присоединением водорода, на гуанидин и гомосерин [312]:

Печень млекопитающих способна очень активно синтезировать цитруллин. В печени, вероятно, происходит синтез и гидролиз некоторого количества аргинина; цитруллин, образующийся только в печени, переносится током крови к почкам, где осуществляются синтез и гидролиз аргинина. Аргинин плазмы, вероятно, образуется преимущественно в почках, синтезирующих его из цитруллина, но содержащих в сравнении с печенью относительно немного аргиназы. Ферменты, образующие аргининоянтарную кислоту и расщепляющие ее, имеются в печени и почках млекопитающих, в дрожжах и у Neurospora. Фермент, расщепляющий это соединение, найден у Chlorella, Escherichia coli, в бобах канавалии и семенах гороха [313].
Синтез цитруллина из орнитина был впервые обнаружен Борсуком и Дубновым в гомогенатах печени [314]. Коэн и сотрудники [315—319, 323, 327, 328] детально исследовали это превращение и показали, что синтез цитруллина возможен в выделенной из печени растворимой ферментной системе в присутствии АТФ, ионов Mg, СO2, NH3и некоторых a-N-ацилпроизводных глутаминовой кислоты. Установлено, что реакция протекает в две ступени. В первой реакции образуется промежуточный продукт, содержащий карбамильную группу [320—322]; как показали позднее Джонс и ее сотрудники [49], промежуточным продуктом является карбамилфосфат. Эти реакции, которые были осуществлены с ферментными препаратами из тканей млекопитающих и из бактерий, можно представить следующим образом:
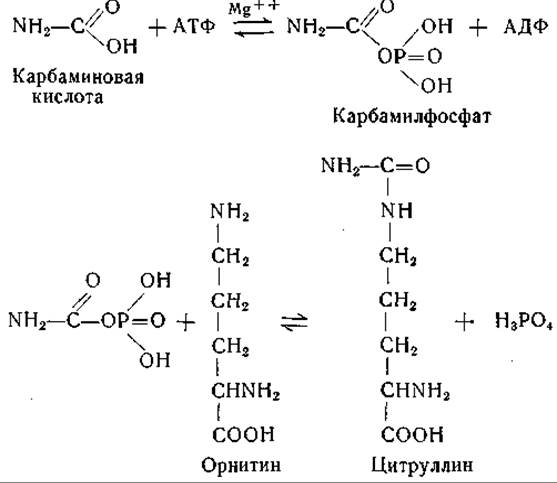
В ферментной системе из печени млекопитающих для первой реакции необходимо присутствие N-ацилпроизводного глутаминовой кислоты, по-видимому N-ацетилглутаминовой кислоты. Этот вопрос требует дальнейшего изучения [324—326, 1089].
В литературе нет данных, касающихся образования карбаминовой кислоты при синтезе мочевины. Образование карбаминовой кислоты может происходить неферментативным путем из аммиака и СO2, но нужно учитывать, что концентрация аммиака в тканях млекопитающих, очевидно, очень низка (стр. 173). Ряд наблюдений показывает, что амидная группа глутамина быстро превращается в мочевину (см. [107, 1080] и стр. 174); обязательно ли при этом превращении промежуточное образованне аммиака, еще не установлено окончательно.
Если во второй реакции, приведенной выше, орнитин заменить аспарагиновой кислотой, то образуется карбамиласпарагиновая кислота [49, 50, 327, 1090]. Известно, что это соединение является предшественником оротовой кислоты (стр. 314).
Исследования, посвященные механизму расщепления аргинина без участия аргиназы, были проведены в опытах с различными микроорганизмами. Не исключена возможность наличия подобных реакций и в животных тканях. Первая ступень расщепления аргинина катализируется ферментом, получившим название аргининдезимидазы [329—332]:
Аргинин + Н2O → Цитруллин + NH3.
Эта система отличается от описанной выше ферментной системы, катализирующей синтез аргинина. Аргининдезимидаза была отделена от фермента, осуществляющего расщепление цитруллина. Превращение цитруллина в орнитин, СO2 и NH3 происходит в присутствии неорганического фосфата, ионов Mg и адениловой кислоты или аденозиндифосфата. То обстоятельство, что в этой системе образуется АТФ, привело к предположению, что реакция протекает с образованием фосфорилированного производного цитруллина [333—339]. В этой реакции арсенат может замещать неорганический фосфат, ионы Mg и нуклеотид. Рассматриваемое превращение, названное цитрул- линфосфорилазной реакцией, происходит, по-видимому, путем фосфорокластического расщепления цитруллина с образованием орнитина и карбамилфосфата. Показано, что от карбамилфосфата остаток фосфорной кислоты переносится на аденозиндифосфат [49]. Следовательно, в расщеплении цитруллина участвует та же реакция, что и в его синтезе. Интересно отметить, что на вероятную роль карбамилфосфата и цитруллинфосфата некоторые исследователи указывали еще до того, как было установлено образование первого из названных соединений в качестве активного промежуточного продукта [337—340].
Орнитин, помимо его роли в цикле мочевинообразования, принимает участие также в других процессах обмена: он превращается в пролин (стр. 349) и в организме птиц соединяется с бензойной кислотой (стр. 267). По некоторым данным, орнитин является предшественником пирролидинового кольца никотина у растения табака [341] (см., однако, стр. 411).
Сакагути [342] приводит экспериментальные данные, указывающие на возможное наличие в белках связей, в которых участвует гуанидиновая группа аргинина. Подобная связь, по-видимому, должна легко гидролизоваться кислотой. Имеются указания на то, что предшественником гуанидиновых групп стрептомицина, возможно, является аргинин [343].
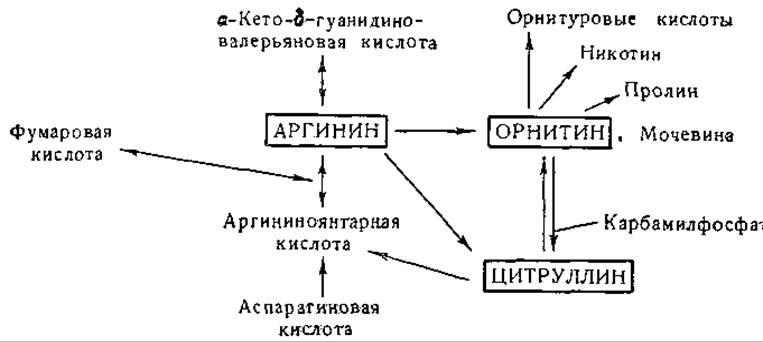
Фиг. 12. Сводная схема превращений аргинина, орнитина и цитруллина.
Описана аминокислотная оксидаза из печени индюка; этот фермент, обладает, по-видимому, относительно специфическим действием на L-диаминокислоты — аргинин, лизин, орнитин, превращая их в соответствующие а-кетокислоты [344].