Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Пролин
Биосинтез у микроорганизмов
При обсуждении промежуточного обмена пролина необходимо рассмотреть взаимоотношения этой аминокислоты с орнитином и глутаминовой кислотой. Поэтому в настоящий раздел включены некоторые данные, относящиеся к синтезу и распаду орнитина и глутаминовой кислоты; другие реакции обмена этих двух аминокислот рассмотрены в соответствующих разделах этой главы.
Путь биосинтеза пролина у Escherichia coli изучали Фогель и Дэвис [345]. Они использовали мутантные штаммы этого организма, у которых блокированы различные стадии биосинтеза. Были выделены три типа мутантов, которые могли расти только в присутствии: а) пролина, б) пролина или у-полуальдегида глутаминовой кислоты и в) пролина, у-полуальдегида глутаминовой кислоты или глутаминовой кислоты. В культурах мутанта (а) накапливался у-полуальдегид глутаминовой кислоты. Это соединение было выделено из культуральной среды, а также синтезировано Фогелем и Дэвисом [345]. 7-Полуальдегид глутаминовой кислоты находится в равновесии со своей циклической формой — ∆1-пирролин-5-карбоновой кислотой; из последней путем ферментативного восстановления образуется пролин. Этот путь биосинтеза пролина встречается также у Neurospora crassa [346] и Torula utilis [347]; он может быть представлен в виде следующей цепи реакций:
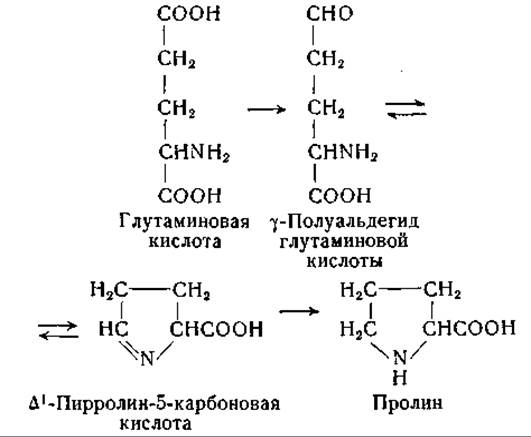
Превращение глутаминовой кислоты в ее у-полуальдегид происходит, возможно, путем реакций, аналогичных тем, которые были установлены Блэком при изучении превращения аспарагиновой кислоты в ß-полуальдегид аспарагиновой кислоты (стр. 333). Восстановление ∆1-пирролин-5-карбоновой кислоты в пролин было изучено в опытах с препаратами из N. crassa и Е. colt, для этой реакции необходимо присутствие дифосфопиридиннуклеотида или трифосфопиридиннуклеотида [348].
У микроорганизмов у-полуальдегид глутаминовой кислоты и его a-N-ацетилпроизводное являются также предшественниками орнитина. Фогель [349—351] изучил мутант Е. coli, нуждающийся в орнитине и накапливающий в процессе роста у-полуальдегид N-ацетилглутаминовой кислоты. Это соединение вступало в реакцию переаминирования с глутаминовой кислотой с образованием a-N-ацетилорнитина, который путем гидролиза превращался в орнитин. Данные, полученные в опытах с изотопами, подтвердили предположение, по которому ацетилирование глутаминовой кислоты является первым звеном в цепи реакций, представленных ниже:
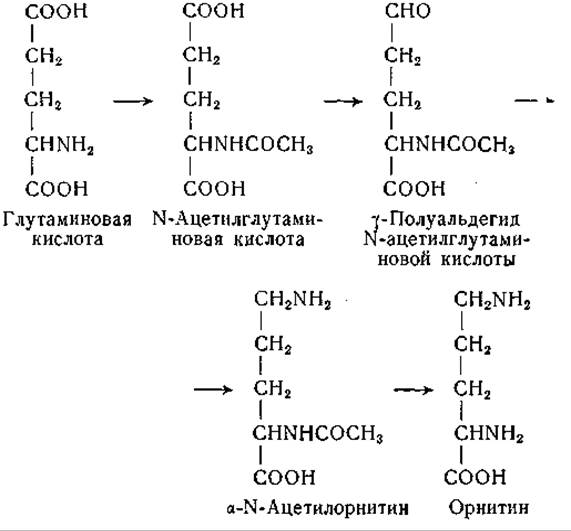
Описано ферментативное ацетилирование глутаминовой кислоты, протекающее при участии кофермента А. Были изучены также приведенная выше реакция переаминирования (стр. 226) и ацилаза, участвующая в последней стадии процесса [351]. У N. crassa и Т. utilis у-полуальдегид ацетилглутаминовой кислоты не участвует в биосинтезе орнитина; это соединение непригодно для поддержания роста мутантов этих организмов. У них орнитин образуется из глутаминовой кислоты и у-полуальдегида глутаминовой кислоты [352]; возможно, однако, что это не единственный путь образования орнитина. Экстракты из Neurospora осуществляют обратимое переаминирование между у-полуальдегидом глутаминовой кислоты и глутаминовой кислотой с образованием a-кетоглутаровой кислоты и орнитина (стр. 226). Если бы этот путь образования орнитина был единственным, то у мутанта Neurospora, нуждающегося в орнитине и не требующего пролина, должна была бы отсутствовать орнитин-транс-аминаза. При исследовании такого мутанта оказалось, что он обладает активной трансаминазой. Из этого следует, что описанный выше путь синтеза орнитина, быть может, не является главным [353]. Вместе с тем в результате реакций переаминирования орнитина возможно его обратимое превращение в пролин без участия глутаминовой кислоты в качестве промежуточного звена: у-полуальдегид глутаминовой кислоты, образующийся при переаминировании орнитина, может путем циклизации и восстановления переходить в пролин. Проблема синтеза орнитина у микроорганизмов подробно рассмотрена Дэвисом [118] и Фогелем [352].