Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Гистидин
Распад гистидина
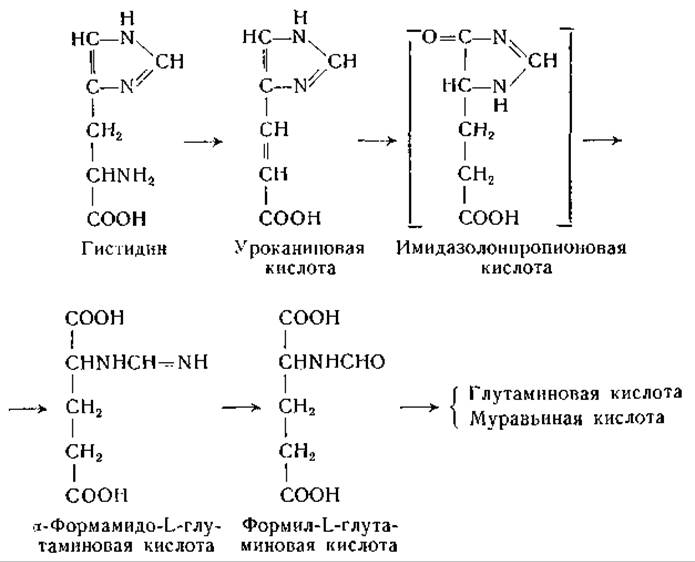
Распад гистидина в печени млекопитающих впервые изучили Дьердь и Рётлер [644] и Эдльбахер [645, 646]. Первоначально предполагали, что эта реакция, приводящая к расщеплению имидазольного кольца, образованию аммиака и исчезновению а-аминного азота (определяемого по Ван-Слайку), катализируется одним специфическим ферментом — гистидазой. Было найдено, что главный продукт превращения гистидина, который в ранних исследованиях не был идентифицирован, легко гидролизуется с образованием аммиака, глутаминовой и муравьиной кислот. Обсуждались различные возможные структуры этого соединения [647—650], но лишь в новейших работах этот процесс расшифрован полностью.
Еще в 1874 г. Яффе [651] наблюдал появление уроканиновой кислоты в моче собаки, но в течение длительного времени это соединение рассматривали как второстепенный побочный продукт обмена гистидина. Между тем превращение гистидина в уроканиновую кислоту наблюдали у бактерий [652, 653]; уроканиновую кислоту часто находили в моче животных после введения гистидина [651, 653—660]. Сера и сотрудники [661, 662], а также другие авторы [663—670] наблюдали превращение гистидина в уроканиновую кислоту в препаратах из ткани печени. Таким образом, стало ясно, что уроканиновая кислота является нормальным продуктом обмена гистидина. В ряде опытов было отмечено превращение уроканиновой кислоты в производные глутаминовой кислоты. Так, например, Такеути [663] при превращении уроканиновой кислоты получил оптически недеятельный изоглутамин; Сера и Айхара [662] и Оямада [665] выделили соединения, оказавшиеся формилпроизводными изоглутамина. Недавно Тейбор и Хаяиси [671] нашли, что бесклеточные экстракты из Pseudomonas fluorescens катализируют превращение L-гистидина с образованием L-глутаминовой кислоты, муравьиной кислоты и двух молей аммиака. При использовании меченого гистидина было установлено, что а-аминогруппа глутаминовой кислоты образуется из у-азота имидазольного кольца, а а-аминогруппа и 5-атом азота гистидина являются источниками образующегося аммиака [633]. В опытах с С14-гистидином показано, что муравьиная кислота образуется из углерода, находящегося в положении 2 имидазольного кольца [673]. Превращение гистидина в уроканиновую кислоту, установленное при разнообразных опытах [661—670, 673—678], катализирует фермент гистидиндезаминаза (гистидаза, дезаминогистидаза; стр. 196). Гистидазная реакция в противоположность реакции, катализируемой аспартазой, необратима, что согласуется с неспособностью уроканиновой кислоты замещать гистидин в опытах по обеспечению роста крыс [630]. Гистидиндезаминаза найдена у бактерий и в печени животных [648, 661, 663, 668, 679—682]. Имеющиеся данные не позволяют сделать окончательного вывода о природе кофакторов, участвующих в действии этого фермента, хотя опубликованы данные, указывающие на участие сульфгидрильных групп [673, 680, 683, 684], фолевой кислоты [680] и ионов металла [673, 681, 683].
Уроканиновая кислота входит в состав мурексина (уроканилхолина) найденного в тканях Murex irunculus и других моллюсков. Обнаружено, что физиологическое действие уроканилхолина сходно с действием никотина и кураре [672, 685].
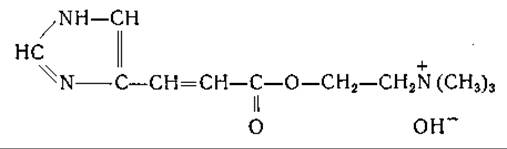
Уроканиновая кислота найдена в поте; возможно, что она играет роль в защите кожи от действия ультрафиолетовых лучей [686, 687].
Ряд исследователей изучал распад уроканиновой кислоты под действием фермента уроканазы. Продукт действия уроканазы получен в кристаллическом виде несколькими авторами и идентифицирован по-разному — как формил-DL-изоглутамин [665, 668], формил-L-глутамин [648] и а-формамидо-L-глутаминовая кислота [650, 683, 688—690]. Дальнейшие исследования [691, 692] подтвердили, что это соединение является а-формамидо-L-глутаминовой кислотой. Оказалось, что это соединение не подвергается быстрому превращению в печени, но довольно легко поддается неферментативному расщеплению с образованием глутаминовой кислоты и изоглутамина. Между тем получены данные о превращении гистидина в глутаминовую кислоту в препаратах печени [674, 676]. Pseudomonas и некоторые другие бактерии легко превращают уроканиновую кислоту, гистидин и а-формамидоглутаминовую кислоту в глутаминовую кислоту, муравьиную кислоту и аммиак; при этом превращении промежуточным продуктом, по-видимому, является формил-L-глутаминовая кислота [683, 689, 693—695].
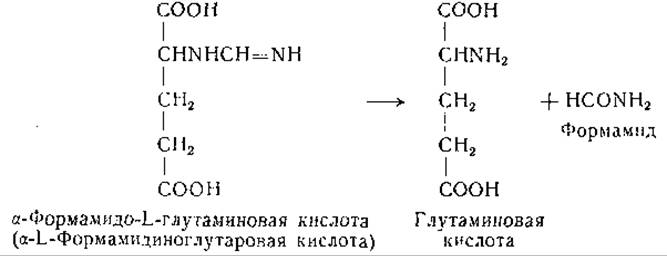
Высказано предположение, что в гистидиндезаминазной реакции участвует фолевая кислота [680, 696]. В моче крыс при недостаточности фолевой кислоты найдена а-формамидо-L-глутаминовая кислота [678, 690, 697, 698], что также указывает на участие фолевой кислоты в обмене гистидина. Дальнейшие исследования показали, что за счет а-формамидо-L-глутаминовой кислоты может происходить формилирование тетрагидрофолевой кислоты [1122]; описана реакция, катализируемая препаратами печени, при которой от а-формамидо-L-глутаминовой кислоты к тетрагидрофолевой кислоте переносится формимино- группа с образованием N10-формиминотетрагидрофолевой кислоты, превращающейся затем в N10-формилтетрагидрофолевую кислоту.
Имеющиеся данные находятся в соответствии со схемой превращения гистидина в глутаминовую кислоту, приведенной ниже. Эта схема предложена Суда и его сотрудниками и Тейбором и Мелером для Pseudomonas и для печени (до стадии образования формамидо-L-глутаминовой кислоты). Другие возможные схемы распада гистидина предусматривают превращение гипотетического промежуточного продукта, имидазолонпропионовой кислоты, в гидантоинпропионовую кислоту и далее в карбамилглутаминовую и глутаминовую кислоты. Возможно также образование а-формилизоглутамина из имидазолонпропионовой кислоты или из уроканиновой кислоты.
Магазаник и Баусер [699, 700] и Ваксман и Баркер [701] нашли, что у некоторых микроорганизмов (Clostridium tetanomorphum и Aerobacter aerogenes) в процессе обмена гистидина накапливается формамид. У этих микроорганизмов распад а-формамидо-L-глутаминовой кислоты, по-видимому, происходит путем гидролиза до формамида.
Гистидин может распадаться не только через уроканиновую кислоту, но и другими путями. Например, Рош и его сотрудники [702, 703] наблюдали в гепатопанкреасе мидий превращение гистидина в ряд имидазольных соединений — имидазолпировиноградную и имидазолуксусную кислоты и имидазолметанол. Гистидин может переходить в карнозин (который гидролизуется специфической пептидазой [704]) и в ансерин (стр. 70). Тиолгистидин входит в состав эрготионеина (стр. 55), который был впервые выделен из спорыньи [705] и найден в эритроцитах и различных тканях животных [706, 707]. Имеются данные, показывающие, что эрготионеин животных тканей имеет источником эрготионеин пищи. У крысы эрготионеин при очень низких концентрациях его в пище (1:100 000) накапливается в эритроцитах [708, 709]. Эрготионеин был также найден в фильтратах культур N. crassa. Он, очевидно, синтезируется этим организмом из гистидина; однако тиолгистидин, вероятно, не является промежуточным звеном в этом процессе. Сера эрготионеина может доставляться метионином или цистеином, а метальные группы — метионином [1123].
Большое физиологическое значение имеет реакция декарбоксилирования гистидина с образованием гистамина (табл. 20); последний, как известно, обладает интенсивным фармакологическим действием [710]. В тучных клетках содержится большое количество гистамина, и они обладают высокой гистидиндекарбоксилазной активностью. Гистамин в организме находится в связанной форме, природа которой остается еще не выясненной [1124]. Гистамин окисляется гистаминазой (диаминоксидазой, стр. 192) с образованием имидазолацетальдегида. Превращение имидазолацетальдегида в имидазолуксусную кислоту осуществлено в опытах с ксантиноксидазой, а также с альдегиддегидрогеназой и дифосфопиридиннуклеотидом [711]. Окисление гистамина в имидазолуксусную кислоту наблюдали у животных некоторых видов в опытах in vivo [712—717].
Клетки штамма Pseudomonas, адаптированного к имидазолуксуской кислите, превращали это соединение в формиласпарагиновую кислоту путем следующей реакции [718]:
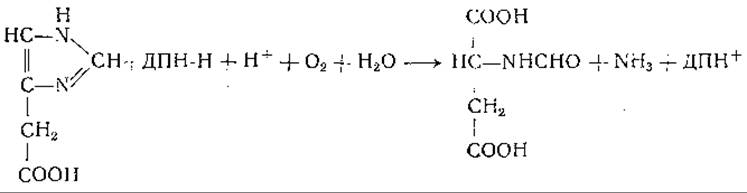
Указаний на наличие подобной реакции у животных в настоящее время нет. После введения крысам меченой имидазолуксусной кислоты наблюдали выделение рибонуклеозида имидазолуксусной кислоты [719]. Этот продукт выделялся и после инъекции крысам гистамина. Имидазолуксусная кислота является, по-видимому, главным продуктом обмена гистамина у крысы.
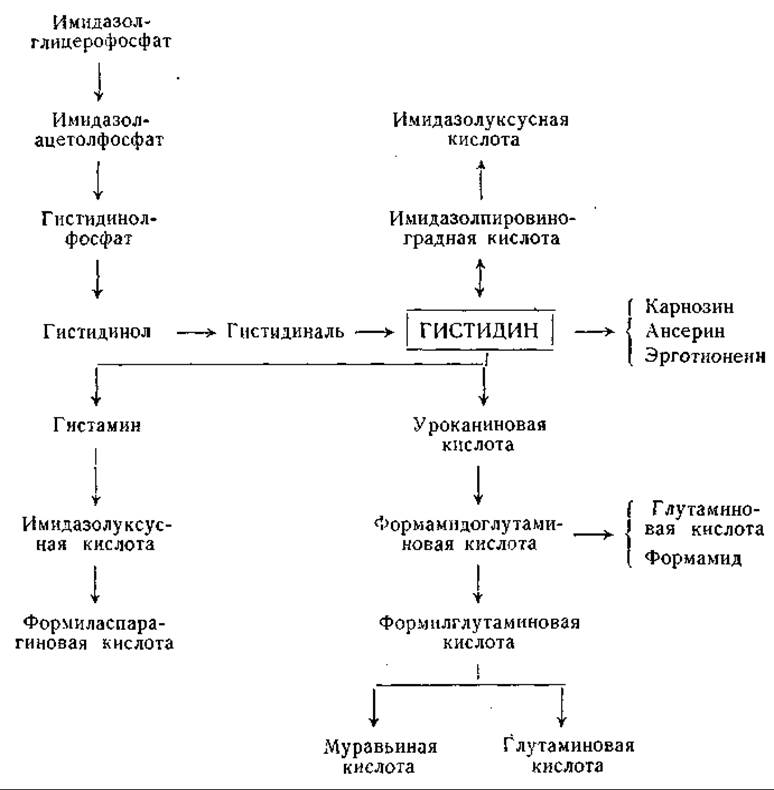
Фиг. 18. Сводная схема превращений гистидина.
Имеется сообщение о том, что гистидин может действовать как кофермент при некоторых реакциях, катализируемых карбогидразами кишечника и другими ферментами [720]. Обнаружение ферментативного синтеза N-ацетилимидазола в экстрактах из Clostridium kluyveri послужило поводом для предположений об участии имидазольной группы гистидина в реакциях переноса ацильных остатков [1125].
N-1-Метилгистидин и N-3-метилгистидин встречаются в природе (стр. 62), но об их обмене известно мало. При введении этих метилгистидинов в организм крысы, курицы, кролика или лягушки основная масса введенного соединения выделяется в неизмененном виде [1126].