Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Фенилаланин и тирозин
Обмен фенилаланина и тирозина у животных
Уже давно известно, что при распаде фенилаланина и тирозина в организме животных образуется ацетоуксусная кислота. Начало расшифровки этого превращения было положено исследованиями о некоторых врожденных пороках обмена веществ у человека (см. гл. V). Выяснение промежуточных реакций этого процесса значительно продвинулось в последние годы в результате исследований с применением меченых метаболитов и различных ферментных препаратов. Экспериментальные данные о выделении гомогентизиновой кислоты у больных алкаптонурией, о повышенном выделении гомогентизиновой кислоты после приема с пищей фенилаланина и тирозина [930], а также об образовании ацетоуксусной кислоты из гомогентизиновой кислоты в перфузируемой печени [931, 932] дали основание предполагать, что гомогентизиновая кислота играет роль промежуточного продукта в обмене ароматических аминокислот. Было установлено, что у нормальных животных гомогентизиновая кислота, подобно фенилаланину и тирозину, подвергается окислению с образованием, в числе других продуктов, ацетоуксусной кислоты. При скармливании животным больших количеств фенилаланина и тирозина наблюдается выделение гомогентизиновой кислоты [933—938].
Превращение фенилаланина в тирозин было установлено еще в 1909 г. Нейбауэром [1930]; в настоящее время известно, что у животных эта реакция в количественном отношении занимает большое место. В 1913 г. Эмбден и Бальдес [931] наблюдали образование тирозина из фенилаланина в опытах с перфузией печени. У субъекта, страдающего тирозинозом, после введения фенилаланина повышалась экскреция тирозина с мочой [939]. О снижении потребности животных в пищевом фенилаланине при включении в рацион тирозина уже говорилось (стр. 121). Известно, далее, что недоношенные младенцы, страдающие С-гиповитаминозом, после введения фенилаланина выделяют тирозин [940, 941]. Все эти данные свидетельствуют о превращении фенилаланина в тирозин. Этот процесс удалось однозначно доказать в опытах на крысах путем скармливания им фенилаланина, меченного дейтерием; из тканей животных был выделен тирозин с соответствующей меткой [942]. В организме больных, страдающих фенилпировиноградной олигофренией, эта реакция протекает в крайне ограниченном масштабе (стр. 475).
Юденфренд и Купер [943] осуществили превращение фенилаланина в тирозин в опытах in vitro при помощи ферментной системы, полученной из печени (фенилаланингидроксилаза). Механизм этой реакции сложен; по-видимому, для реакции необходимы две белковые фракции, дифосфопиридиннуклеотид, какой-нибудь альдегид, кислород и ионы Fe++ [923, 1134]. Результаты опытов с применением меченого тирозина показали, что обратного превращения тирозина в фенилаланин в организме животных не происходит [944]. Процесс превращения фенилаланина в тирозин наблюдали в мышцах и в печени [224]. Некоторые микроорганизмы способны катализировать образование тирозина из фенилаланина [923], но большинство бактерий, по-видимому, не обладает соответствующей ферментной системой.
Превращение фенилаланина в ацетоуксусную кислоту было изучено в опытах с применением изотопного углерода [946—951]. В этих изящных и убедительных исследованиях было показано, что: а) а-углеродный атом фенилаланина становится углеродом карбоксильной группы ацетоуксусной кислоты, б) атом С-2 бензольного ядра является предшественником карбонильного углеродного атома ацетоуксусной кислоты, в) атомы С-1 или С-3 ядра служат предшественниками углеродного атома метальной группы ацетоуксусной кислоты. В других исследованиях [947— 950] найдено, что β-углеродный атом тирозина становится а-углеродным атомом ацетоуксусной кислоты. Эти данные свидетельствуют о перемещении боковой цепи в процессе окисления фенилаланина и тирозина. Установлено, что при распаде тирозина и фенилаланина образуются два четырехуглеродных фрагмента; один из них представляют кетоновые тела, а другой — яблочная кислота или близкое к ней соединение [951]. Изложенные выше данные могут быть представлены в виде следующей схемы:
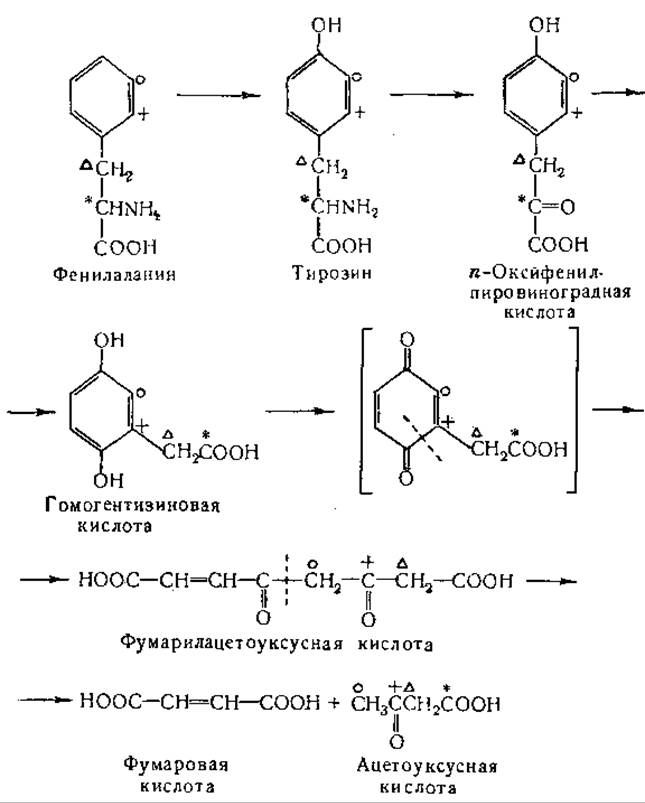
Приведенная выше цепь последовательных реакции была подтверждена результатами опытов с очищенными ферментами, причем были обнаружены дополнительные промежуточные продукты. Первый этап превращения тирозина состоит в образовании n-оксифенилпировиноградной кислоты путем реакции переаминирования. Интересно, что в более ранних исследованиях с использованием кашицы печени не наблюдали образования аммиака при окислении тирозина. Переаминирование между а-кетоглутаровой кислотой и тирозином (табл. 21) необходимо для дальнейших реакций окисления [952—954]. Возможность окисления тирозина через 2,5-диоксифенилаланин, очевидно, исключена, так как установлено, что это соединение не окисляется в ферментной системе, окисляющей тирозин [953].
Однако в организме у больных с алкаптанурией 2,5-диоксифенилаланин может превращаться в гомогентизиновую кислоту [955]. n-Оксифенилпировиноградная кислота в опытах in vitro быстро окисляется с образованием тех же продуктов, что и при окислении самого тирозина [953].
Опубликованы данные, свидетельствующие о том, что при окислении n-оксифенилпировиноградной кислоты в гомогентизиновую известную роль играют аскорбиновая кислота [953, 956— 962] и каталаза [1135]. Механизм действия аскорбиновой кислоты еще не ясен; аскорбиновая кислота может быть заменена в эксперименте некоторыми другими соединениями, например изоаскорбиновой кислотой. По вопросу о том, является ли 2,5-диоксифенилпировиноградная кислота промежуточным продуктом при окислении n-оксифенилпировиноградной кислоты, имеются расхождения. Сообщали, что 2,4-диоксифенилпировиноградная кислота накапливается при окислении n-оксифенилпировиноградной кислоты [959]. В более поздних исследованиях найдено, что 2,5-диоксифенилпировиноградная кислота не окисляется с заметной скоростью в ферментной системе, превращающей n-оксифенилпировиноградную кислоту в гомогентизиновую кислоту [961].
При недостаточности аскорбиновой кислоты животные, получившие per os большие количества фенилаланина или тирозина, выделяют с мочой n-оксифенилпировиноградную кислоту; количество выделяемой кислоты уменьшается при введении таким животным аскорбиновой кислоты [934—938]. Интересно, что птероилглутаминовая кислота предотвращает выделение с мочой n-оксифенилпировиноградной кислоты, вызываемое у морских свинок скармливанием тирозина, но не предохраняет животных от скорбута [963]. Окисление тирозина в препаратах печени, полученных от крыс с недостаточностью фолевой кислоты, удавалось активировать добавлением фолевой кислоты in vitro [964, 965].
В опытах с применением изотопов было доказано, что превращение n-оксифенилпировиноградной кислоты в гомогентизиновую сопровождается перемещением боковой цепи. Эта реакция, очевидно, аналогична реакции окисления n-крезола в метилгидрохинон:
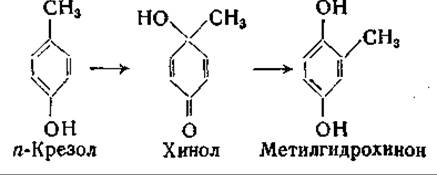
Возможно, что соответствующая биологическая реакция протекает сходным путем [966, 967]; механизм этого превращения и функция аскорбиновой кислоты при нем [968, 969] нуждаются в дальнейшем изучении.
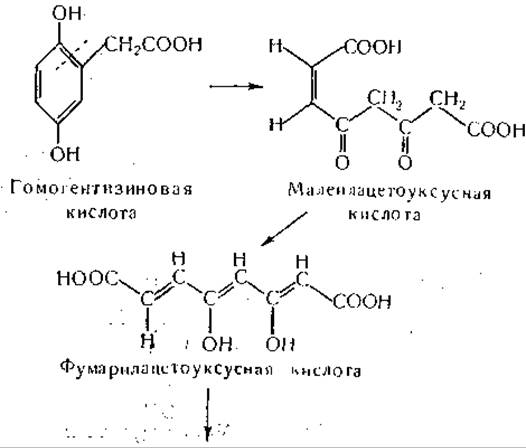
Окисление гомогентизиновой кислоты изучали в различных системах in vitro [970—976]. Фермент, участвующий в этом процессе, найден в печени и почках, а также у одного штамма Pseudomonas-, для его действия необходимо присутствие ионов Fe++; ионы Fe+++ неактивны. Аскорбиновая кислота и глутатион активируют систему — возможно, путем предохранения Fе++ и сульфгидрильных групп от окисления, а, а'-Дипиридил тормозит окисление гомогентизиновой кислоты, по всей вероятности, в результате связывания железа. При действии этой весьма своеобразной ферментной системы потребляется один моль кислорода и образуется малеилацетоуксусная кислота. Этот продукт, образование которого вначале было заподозрено на основании исследования спектров поглощения в ультрафиолетовой области [977], превращается в фумарилацетоуксусную кислоту ферментом, для действия которого необходим в качестве кофактора глутатион [1136, 1137]. Интересно, что только фумарилацетоуксусная кислота, но не малеилацетоуксусная кислота гидролизуется растворимым ферментом печени [970], обнаруженным ранее по его способности гидролизовать такие соединения, как а, y-дикетокислоты и ß, δ-дикетогексановая кислота [978—980]. Окисление гомогентизиновой кислоты и дальнейшие фазы ее обмена можно представить следующим образом:

Описаны три заболевания у человека, связанные с врожденными пороками окисления фенилаланина; они рассматриваются в гл. V.
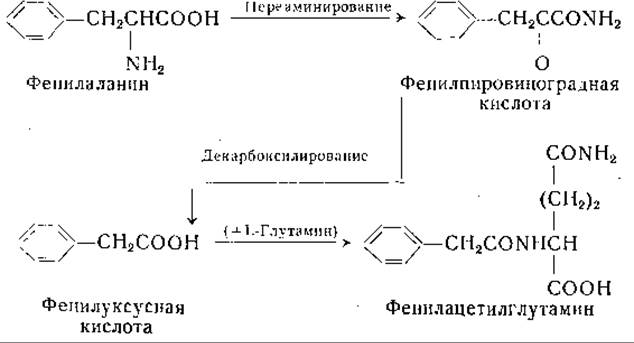
Реакции, приведенные выше, представляют главный путь превращения фенилаланина в организме у млекопитающих, однако известны и другие реакции обмена фенилаланина. Установлено, например, что в нормальной моче человека [981, 982] имеется фенилацетилглутамин и что экскреция этого соединения значительно повышена после введения фенилуксусной кислоты [983—989]. При введении 20 г фенилуксусной кислоты почти вся введенная доза выделяется в виде фенилацетилглутамина. У всех исследованных видов животных (собака, крыса, кролик, обезьяна, лошадь, овца и кошка) нагрузка фенилуксусной кислотой вызывала выделение с мочой фенилацетилглицина. Только у человека и, возможно, у шимпанзе образуется фенилацетилглутамин. Появление этого соединения в моче дает основание предполагать наличие следующих реакций:
Другой путь обмена фенилаланина состоит в превращении его в гиппуровую кислоту. Хотя гиппуровая кислота, выделяемая человеком и животными, образуется главным образом из бензойной кислоты пищи, ее наличие в моче людей при голодании [982], а также данные исследований с применением меченой бензойной кислоты [990] и меченого фенилаланина [991] указывают на то, что некоторая часть выводимой с мочой гиппуровой кислоты имеет эндогенное происхождение (например, из фенилаланина).