Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Фенилаланин и тирозин
Биосинтез у микроорганизмов
Дэвис и сотрудники [118, 890—892] обстоятельно изучили процесс биосинтеза ароматических аминокислот у Escherichia coli и выяснили многие звенья этого процесса. Цепь последовательных реакций, описанная ниже, была установлена главным образом в опытах с мутантами Е. coli и других микроорганизмов [894, 895] (фиг. 20).

Фиг. 20. Схема биогенеза ароматических аминокислот.
Исследования начались с обнаружения мутантов Е. coli, Neurospora crassa и Aerobacter aerogenes, нуждающихся в одновременном присутствии четырех соединений — фенилаланина, тирозина, триптофана и n-аминобензойной кислоты [896]. При некоторых условиях им необходимы также n-оксибензойная кислота [897] и шестой, еще не идентифицированный фактор [898]. Позднее было найдено, что шикимовая кислота — соединение, обнаруженное в ряде растений, — может замещать все шесть факторов, необходимых для роста упомянутых мутантов [896]. Шикимовая кислота накапливается в культурах некоторых микроорганизмов, у которых блокированы более поздние звенья в цепи реакций биосинтеза; эта кислота была выделена и идентифицирована. Найдено, что в культурах мутантов, блокированных на стадии, предшествующей образованию шикимовой кислоты, накапливается 5-дегидрошикимовая кислота [899], и установлено, что предшественником последней является 5-дегидрохинная кислота [900, 901]. Родственная ей хинная кислота, широко распространенная в растениях, оказалась способной обеспечивать рост некоторых мутантов [900, 902]. Между тем получены данные, показывающие, что хинная кислота, очевидно, не является инстинным промежуточным продуктом в биосинтезе ароматических аминокислот. В частности, у организмов, осуществляющих этот синтез, не найдено дегидрогеназы хинной кислоты [903, 904].
Фермент, катализирующий взаимопревращение дегидрошикимовой и шикимовой кислот — редуктаза дегидрошикимовой кислоты, — действует при участии трифосфопиридиннуклеотида [905]. Дегидрохиназа — фермент, катализирующий взаимопревращение дегидрохинной и дегидрошикимовой кислот, — по- видимому, не нуждается в кофакторах. Эти ферменты найдены во всех изучавшихся организмах, синтезирующих ароматические аминокислоты, и отсутствуют у соответствующих мутантных штаммов.
В культурах некоторых мутантов, блокированных на стадиях, следующих за образованием шикимовой кислоты, накапливается 5-фосфошикимовая кислота и неидентифицированное соединение «Z1», из которого при кислотном гидролизе образуется шикимовая кислота [906]. Имеются данные, позволяющие предполагать, что соединение Z1 является истинным промежуточным продуктом, который в процессе биосинтеза следует за шикимовой кислотой. Вместе с тем есть основание думать, что 5-фосфошикимовая кислота не лежит непосредственно на пути биосинтеза [907]. Найдено, что в культурах некоторых нуждающихся в фенилаланине мутантов накапливается другое соединение, названное префеновой кислотой [908—911]. Это соединение очень нестойко; при слабом подкислении оно быстро превращается в фенилпировиноградную кислоту [912, 913]. Некоторые мутанты Е. coli, нуждающиеся в тирозине, также образуют префеновую кислоту. Сформулированы схемы, поясняющие превращение префеновой кислоты в фенилпировиноградную и в n-оксифенилпировиноградную кислоты [912].
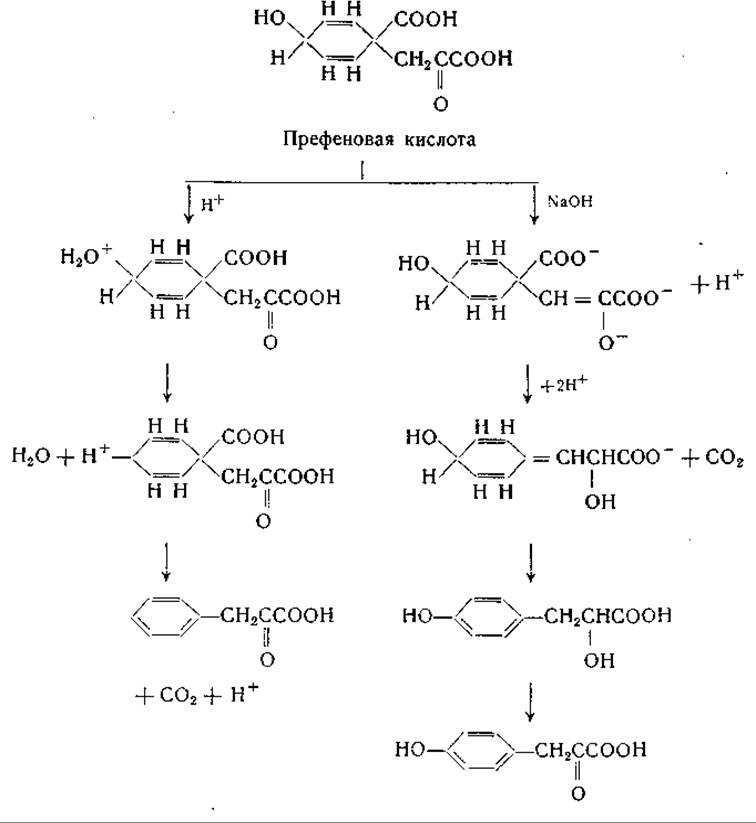
Недавно опубликовано сообщение, согласно которому из префеновой кислоты образуется n-оксифенилмолочная кислота [1132].
Соединение Z1, возможно, служит общим источником образования 1) префеновой кислоты, являющейся предшественником фенилаланина и, возможно, тирозина, 2) антраниловой кислоты, 3) n-оксибензойной кислоты, 4) n-аминобензойной кислоты и 5) неидентифицированного «шестого фактора» (см. фиг. 20). При поисках промежуточного продукта, предшествующего 5-дегидрошикимовой кислоте, было обнаружено соединение V, еще не идентифицированное. Изучение синтеза шикимовой кислоты в клетках Е. coli из меченой глюкозы показало, что углеродный атом карбоксильной группы и атомы С-1 и С-2 ядра происходят из промежуточного продукта гликолиза, содержащего три углеродных атома.

Атомы С-3, С-4, С-5 и С-6 происходят из молекулы тетрозофосфата, образующегося в цикле пентоз [893, 914—916, 1133]. В опытах с бесклеточными экстрактами получены доказательства превращений D-эритрозо-4-фосфата и фосфоэнолпирувата в дегидрошикимовую кислоту. Установлено образование дегидрошикимовой кислоты из седогептулозо-1,7-дифосфата, однако это превращение, по-видимому, связано с распадом седогептулозодифосфата на эритрозо-4-фосфат и фосфоэнолпируват [917]. Путь синтеза ароматических аминокислот, предполагаемый на основании этих исследований, согласуется с данными, полученными другими авторами при изучении биосинтеза тирозина и фенилаланина из меченых предшественников в дрожжах [918—922].
Механизм образования тирозина еще не установлен. Некоторые микроорганизмы способны превращать фенилаланин в тирозин [923], однако у Е. coli этот процесс, по-видимому, не происходит. У этого организма тирозин, вероятно, является продуктом аминирования n-оксифенилпировиноградной кислоты, которая, возможно, образуется из префеновой кислоты (см. выше). Из данных, полученных на Е. coli в опытах с применением антиметаболитов, например фенилсерина, был сделан вывод о возможности образования тирозина путем окисления фенилаланина [924, 925, 928]. Результаты другой работы [926] показывают, что фенилсерин тормозит использование бактериями фенилаланина, но не тирозина и что при этих условиях тирозин, по-видимому, может превращаться в фенилаланин. Возможно, что такие превращения происходят в результате обратного перехода обеих аминокислот в молекулу общего для них предшественника. Высказано также предположение, что а-фенилглицин может служить предшественником фенилаланина [927].
Высшие животные не могут синтезировать ароматические аминокислоты de novo, однако показано, что в организме животных возможны некоторые реакции ароматизации циклических соединений. Хинная кислота, которая переходит в бензойную кислоту, и некоторые другие циклические соединения подвергаются в препаратах печени и почек превращению в ароматические соединения [929].